HCV感染患者糖脂代谢与病情的变化规律研究*
张文萍 ,张秋萍 ,吴弛 ,张仲明 ,罗燕婷 ,杨燕梅 ,黄慧谦
(1.广东省深圳市第三人民医院检验科,深圳 518114;2.广东省深圳市罗湖区妇幼保健院妇产科,深圳518019)
丙型肝炎(HCV)是丙型肝炎病毒引起的,HCV感染后能在约80%的患者体内形成慢性持续性的感染,主要作用的靶器官是肝脏,临床进展为不同程度的肝脏炎症、纤维化、肝硬化以及肝细胞肝癌发生的危险性增加,由此可见,肝纤维化是各种慢性肝病向肝硬化发展的必经阶段,是所有慢性肝病的共同病理基础[1]。HCV感染还可引起各种肝外疾病,其中对葡萄糖的代谢尤为主要,这是因为肝糖元可以直接影响的体内葡萄糖的浓度,而且还可以间接影响胰岛素的灭活、继而影响体内葡萄糖的浓度。有不少文献报道,慢性HCV感染易合并糖尿病,慢性丙肝和丙肝后肝硬化的患者,他们合并糖尿病的机会是远高于慢性乙肝以及乙肝后肝硬化的患者[2,3]。HCV感染者中尤其是肝硬化阶段的患者更加容易合并糖耐量减低即糖尿病[4]。同时,肝脂肪变性也是丙型肝炎肝脏组织学的一大典型特征。HCV感染者中,有肝脂肪变性的占30%-70%[5,6]。本研究拟探讨HCV慢性感染者的糖脂代谢与病情的发展程度的相关性。
1 资料与方法
1.1 研究对象及分组情况 收集深圳市第三人民医院、深圳市人民医院以及北京大学深圳医院2015年10月至2019年10月期间HCV慢性感染者的血标本进行葡萄糖(GLU)、C-肽(CPS)、胰岛素水平(IRI)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇浓度(CHOL)以及甘油三酯(TG)等糖脂代谢的相关的测定,连续3次结果较稳定的指标,查阅病史,剔除了其他基础疾病、以及合并其他病毒感染、单纯酒精性肝病等病例,纳入对象为HCV初治者/经抗病毒治疗已停用1个月的患者;参考丙肝纤维化递增程度按照ARFI分级和FibroScan分级[7]。丙型肝炎的自然史依据中华医学会的丙肝指南来进行分组,结合HCV-RNA,影像学,病理学检查[1]。
将慢性HCV感染者分为病毒携带组、慢性肝炎组、肝硬化组以及肝癌组四组,平均年龄36.5岁,男248例,其中吸烟习惯史为102例,酗酒史202例,女193例,其中吸烟习惯史为2例,饮酒史12例,血压、肾功都正常,无其他导致糖脂代谢异常的相关病变。健康对照组的纳入标准为与研究组患者同时间段、年龄以及性别相当的体检健康人群,选取其糖脂体检指标纳入相应的健康对照数据中。
1.2 检测方法 收集HCV病毒感染患者静脉血清,德国西门子公司ADVIA2400全自动化学发光免疫分析仪测量 GLU、HDL、LDL、CHOL、CPS、IRI所得的值。
1.3 统计学分析 采用SPSS22.0统计软件做了单因素的方差分析,分析不同组别结果均值之间是否存在显著性差异,如果有显著性差异再进行组间的两两比较,主要用LSD-t检验比较各组之间是否有显著性差异,以及Dunnett t检验比较各病例组与对照组之间比较是否有显著性差异,P<0.05为差异有统计学意义。
2 结果
2.1 HCV感染者4组与健康对照组比较 胰岛两项(CPS和IRI)和空腹血糖(GLU)指标分析,C肽含量(CPS)水平在慢性肝炎组和肝硬化组比对照组明显偏高 (P<0.05);慢性肝炎组、肝硬化组和肝癌组的胰岛素水平(IRI)比健康对照组明显偏高 (P<0.05);肝硬化组GLU比健康对照组明显偏高 (P<0.05),见表1。血脂4项中,肝硬化和肝癌组中的CHOL、HDL 水平明显偏低 (P<0.05),TG 水平仅有肝癌组相比健康对照组下降(P<0.05),各组LDL水平与健康对照组均无统计学差异(P>0.05),见表2。
2.2 HCV感染者3组与病毒携带组比较 胰岛两项(CPS和IRI)和空腹血糖(GLU)指标分析:仅肝硬化组CPS、IRI及GLU水平比病毒携带组明显偏高 (P<0.05),其他组与病毒携带组无明显差异(P>0.05),见表1。血脂4项中,肝硬化组和肝癌组中CHOL水平明显偏低 (P<0.05);肝癌组中 TG、HDL水平上升 (P<0.05);各组中 LDL水平与病毒携带组无统计学差异(P>0.05),见表 2。
2.3 HCV感染中肝硬化组、肝癌组与慢性肝炎者组比较 胰岛两项(CPS和IRI)和空腹血糖(GLU)指标分析,仅肝硬化组的CPS、IRI及GLU水平比病毒携带组明显偏高 (P<0.05),其他组与慢性肝炎者组无明显差异(P>0.05),见表1。血脂4项中,肝硬化组和肝癌组中CHOL水平明显减低 (P<0.05);肝癌组中TG、HDL水平上升、肝硬化组中LDL水平上升 (P<0.05)。 见表2。
2.4 HCV感染中肝癌组与肝硬化组之间的比较肝癌中的胰岛两项(CPS和IRI)的水平降低、空腹GLU肝癌组较肝硬化组升高 (P<0.05),见表1。血脂四项中,两组之间的CHOL、TG和HDL水平均上升 (P<0.05);而LDL水平在肝硬化发展成肝癌时反而下降 (P<0.05)。见表2。
2.5 将研究数据转化成折线图1的总体变化情况显示:胰岛两项(CPS和IRI)和空腹血糖(GLU)、以及血脂四项水平在病毒携带组、肝炎组、肝硬化组中的总体趋势呈上升趋势,但从肝硬化到肝癌组中水平突然下降 (P<0.05);因为CPS整个数据小,因此折线图呈现的数据变化幅度小,有统计学差异(P<0.05)。 见图 1。
2.6 纳入该研究的男性人数共占56.2%(248/441),其中有吸烟习惯史人数占23.1%(102/441),均分布在肝硬化组(66例)和肝癌组(36例);酗酒史人数占45.8%(202/441),其中肝硬化组占18.1%(80/441)、肝癌组占 5.4%(24/441);女性 193 例,其中吸烟习惯史人数占0.5%(2/441),饮酒史人数占2.7%(12/441),均为肝硬化或肝癌组,经单因素的方差分析,性别、吸烟和酗酒史是慢性HCV感染的肝纤维程度的独立危险因素(P<0.05)。
3 讨论
HCV是一种嗜肝病毒,靶器官肝脏参与机体蛋白质、脂肪和碳水化合物代谢,长期肝脏功能损害,参与糖酵解与三羧酸循环的多数酶类的活性降低,使得肝脏内的升糖激素减少,肝脏摄取和灭活胰岛素作用受损,引起糖耐量异常,导致胰岛素抵抗(Insulin resistance,IR)和 2 型糖尿病(T2DM)的发生[8]。肝脏也是人体糖代谢的主要场所,慢性HCV感染者不仅会导致肝脏损害,还会有其特异的发病机制,胰岛β细胞功能的减低和IR在其中都起作用。胰岛细胞功能减低,形成的免疫复合物损伤胰岛细胞,病毒在胰腺内复制损害胰岛素分泌不足引起二型糖尿病 (T2DM)[9,10]。有研究HCV转基因鼠模型中进行葡萄糖耐量实验后发现转基因大鼠存在着显著的IR,IR程度与 HCV核心蛋白的表达水平密切相关[11]。
Trpkovic等也证明HCV感染相关性糖尿病的发生的确是通过HCV相关性 IR的发生而发生,并且IR的程度随着HCV感染者肝纤维化程度的加重而上升,糖尿病的发病率亦升高[12]。该项目对深圳地区丙肝患者的糖脂代谢情况进行了研究,结果显示HCV感染中的葡萄糖、胰岛素和C肽的检测结果明显高于健康对照组人群,随着HCV感染者的肝纤维化程度加深,患者的糖脂代谢水平较健康对照组比较,差异性越显著,与我国的研究报道相符[13,14]。
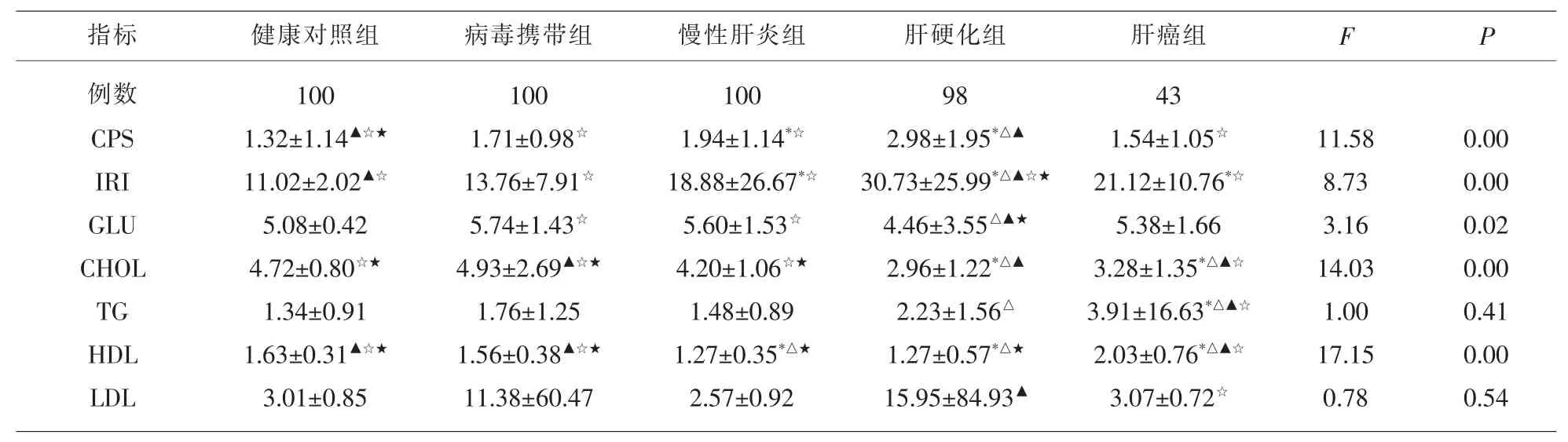
表1 HCV各感染组及健康对照组各项指标LSD-t检验多重比较各组(Groups)之间的差异情况
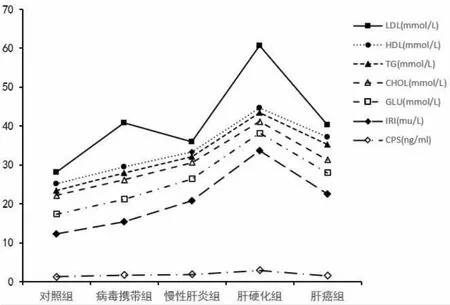
图1 参数在各组中的改变情况
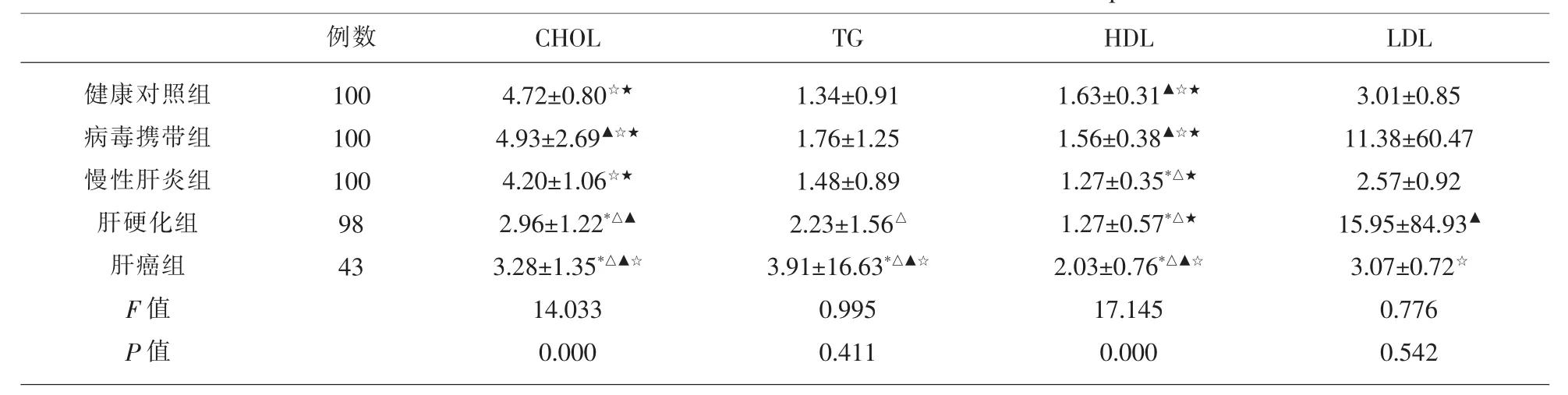
表2 HCV各感染组及健康对照组脂代谢指标LSD-t检验多重比较各组(Groups)之间的差异情况
HCV引起 T2DM的机制主要有干扰胰岛素信号传导、促进肿瘤坏死因子α过度表达、影响脂质代谢等。T2DM可引起HCV患者肝脏脂肪变性,加重肝纤维化进展,造成抗病毒治疗失败,甚至还能促进肿瘤的发生[15]。研究表示,除LDL水平改变不大外,肝硬化组的其他血脂三项水平呈上升趋势,但发展到肝癌组时反而下降,符合HCV肝纤维化糖脂代谢的自然病程,在肝癌阶段失去了自然调控,Kanwal F研究中发现T2DM病情发展可能与慢性HCV感染患者肝细胞纤维化、肝癌等联系密切,对预后造成极大的影响[16]。而且,慢性丙型肝炎有诱导胰岛素抵抗糖尿病(IR)的发生,IR发生后导致肝脏脂肪沉积,甚至发生胆汁淤积性肝病[17]。
慢性丙型肝炎血脂四项结果明显低于正常检测范围。血脂的偏高再加上肝内脂肪的沉积,使胰岛素对肝糖原输出作用被抑制,而肝脏铁含量的增加也可能同时伴有胰腺铁沉积增多,降低了胰腺的外分泌功能,胰岛素的分泌明显受到影响。同时肝脂肪变和铁的沉积还会干扰肝内胰岛素的清除,从而导致胰岛素结果一系列变化[18]。
研究结果充分表明,HCV感染并发的纤维程度和脂质代谢之间的总体趋势存在正关系,并且相互影响着。HCV慢性感染过程中常发生胰岛素抵抗和脂质代谢混乱,且胰岛素抵抗和脂质代谢混乱程度,肝纤维化之间存在明显的相关性,肝纤维化程度随胰岛素抵抗程度的加重而加深,跟单纯非HCV感染引起的糖脂代谢紊乱机制不同,因此进一步了解HCV病毒的感染机制及提高其抗病毒治疗的疗效有着深远的意义。今后应加强HCV诱发胰岛素抵抗以及胰岛素抵抗促进肝纤维化的具体分子机制研究。
另外,男性、吸烟和酗酒是发展为HCV慢性感染发展为肝硬化或肝癌组的独立危险因素[21],女性发生肝硬化比例低,与在HCV相关感染肝细胞癌更低,很可能就是缘于女性更低的吸烟率和酗酒率,这与之前的报道相符。

