犬瘟热病毒时间分辨免疫荧光分析方法的建立及初步应用
陈翠翠,赖宏锐,梁焕坤,钟树海,黎杰星,李来庆
(广州优迪生物科技股份有限公司,广东 广州 510663)
犬瘟热(Canine distemper,CD)是肉食动物的一种急性、高度接触性、热性传染病[1],由副黏病毒科麻疹病毒属的犬瘟热病毒(Canine distemper virus,CDV)感染引起,其死亡率可高达90%[2],雪貂高达100%[3],在家养犬CDV 病死率约为50%。CDV 自然感染宿主除食肉目8 个科外, 还扩展到猪、灵长目的猕猴属和鳍足目海豹科等多种动物,其危害性也越来越大[4-5]。因此早期、快速、准确的诊断犬瘟热病,对养犬业和野生动物保护业具有重要意义。目前,检测CDV 的方法常见有病毒分离、免疫荧光抗体技术、免疫组化、RT-PCR 方法等,但均存在繁琐、重复性差等不足,而且在基层难以推广应用。
时间分辨免疫荧光分析法(Time-resolved fluoroimmunoassay,TRFIA)是一种超微量免疫分析定量检测技术,具有灵敏度高、检测范围宽、操作简便等特点[6]。该方法用具有独特荧光特性的镧系元素及其螯合物为示踪物[7-9],标记蛋白质、抗体、核酸探针等,利用TRFIA 检测仪测定反应产物中的荧光强度,可以快速、精准的定量检测病原感染情况。目前,尚未有CDV TRFIA 的报道。本研究使用一株抗CDV 的单克隆抗体(MAb)作为包被抗体,Eu3+标记的另一株MAb 作为检测抗体,建立了CDV 的双抗体夹心TRFIA,为检测CDV 提供新的技术手段。
1 材料与方法
1.1 主要实验材料 抗CDV单克隆抗体(MAb)3H7(包被抗体,效价1∶160 000)、2G4(检测抗体,效价1∶320 000)和CDV 标准抗原(由犬瘟热病毒的H 蛋白和F 蛋白列通过一段柔性连接肽(GGGGS)n 连接并进行真核表达的重组蛋白,G 表示为甘氨酸,S 表示为,丝氨酸,n≥1。经Meridian Life Science 公司,#2A02219 CDV 病毒标定,相当于1.46×103TCID50/mL)均由广州优迪生物科技股份有限公司制备;铕(Eu3+)标记试剂盒购自PerkinElmer 公司;牛血清白蛋白(BSA)购自Fitzgerald 公司;Sephades-G50 填料购自GE 公司;96 孔板购自Costar 公司;包被缓冲液、洗涤液、封闭液、增强液均为自制。Victor 1420 全自动时间分辨荧光免疫分析检测仪购自PerkinElmer 公司。65 份疑似CDV 患病犬的眼鼻分泌物,15 份CDV 阴性样品均由广州富懋动物医院提供。
CDV、犬细小病毒(Canine parvovirus virus,CPV)、犬副流感病毒(Canine parainfluenza virus, CPIV)、犬腺病毒1 型(Canine adenovirus type 1,CAV-1)、犬冠状病毒(Canine coronavirus,CCV)均购由广州优迪生物科技股份有限公司制备保存。
1.2 固相包被抗体的制备 将包被抗体3H7 采用50 mmol/L、pH9.6 的碳酸盐缓冲液稀释为5 μg/mL,10 μg/mL 和15 μg/mL,利用方阵法进行包被浓度的优化。包被抗体加入96 孔微孔板中包被,4 ℃过夜,弃包被液,加入封闭液(5% BSA 的PBS 溶液,pH 7.4),每孔250 μL,37 ℃封闭2 h,弃掉封闭液,洗涤液(0.5%Tween-20 的PBS 溶液,pH 7.4)洗涤2 次,真空冷冻抽干,于-20℃保存备用。
1.3 Eu3+标记检测抗体及其纯化 将0.5 mg 检测抗体2G4 加入到带有滤膜的离心管中,以8 000 r/min离心8 min。设置Eu3+标记试剂:标记抗体比例分别 为70 μL∶30 μL,60 μL∶40 μL,50 μL∶50 μL,40 μL∶60 μL 和30 μL∶70 μL,利用铕(Eu3+)标记试剂盒采用方阵法进行优化标记比例,并根据Eu3+标记试剂盒说明书所提供的公式计算标记率。
1.4 标准品的制备 用含0.2% BSA、0.1% NaN3、50 mmol/L 的Tris-HCl 缓冲液(pH 7.8),将CDV 抗原配制成浓度为0、5 ng/mL、10 ng/mL、20 ng/mL、40 ng/mL、80 ng/mL、160 ng/mL、640 ng/mL 的系列标准品溶液,每瓶1 mL 分装冻干,-20 ℃保存备用。使用时分别加入1 mL分析缓冲液(8 mmol/L NaCl,0.1%明 胶,0.1% NaN3,0.1 mL/L Tween-80 的Tris-HCl 溶液,pH 7.8)溶解使用。
1.5 TRFIA 方法检测性能评估
1.5.1 绘制标准曲线 使用CDV系列标准品(0、5 ng/mL、10 ng/mL、20 ng/mL、40 ng/mL、80 ng/mL、160 ng/mL、640 ng/mL)绘制标准曲线,每个浓度测定3 个复孔,共测定3 次,用双对数数学模型(Log-Logit)进行标准曲线的拟合。以无CDV 标准品为样本,将其测定的20 次荧光值均值加上2 倍的标准差(mean+2SD)代入标准曲线方程,计算TRFIA 方法的灵敏度。
1.5.2 准确度实验 对浓度已知的3 个CDV 标准品(17.6 ng/mL、21.0 ng/mL 和34.8 ng/mL)分别按1∶2、1∶4、1∶8 倍比稀释,每个样本重复检测3 次,比较样本的测定值、真值并计算其稀释回收率(测定值/真值×100),用稀释回收率分析该检测方法的准确度。
1.5.3 特异性实验 利用本研究建立的TRFIA 方法同 时 检 测CDV 标 准 品、 CPV、 CPIV、 CAV-1、CCV,进行特异性实验。
1.5.4 精密度实验 将CDV 标准品稀释至高(500 ng/mL)、中(100 ng/mL)、低(10 ng/mL)3 个浓度,各设3 个复孔重复检测10 次,计算高、中、低3 个浓度标准品测定的均数、标准差及变异系数(CV),评价该试剂盒精密度。
1.5.5 稳定性实验 用本研究制备的TRFIA 试剂盒置于4 ℃6 个月和37 ℃7 d,对试剂盒的物理外观,剂量-反应曲线的线性、灵敏度、准确度、特异性等指标进行测定,具体检测方法同上。
1.6 临床样本的检测 采用本研究建立的TRFIA 方法与RT-PCR[10]同时检测65 只具CD 临床症状并经CDV 胶体金试纸条诊断为阳性的疑似感染犬和15 只健康犬的眼鼻分泌物,对检测结果进行对比分析,以评估本TRFIA 法的临床检测效果。
1.7 统计学分析 采用SPSS 17.0 统计软件。结果以mean±SD 表示,GraphPad Prism 5 软件计算标准曲线方程, Origin8 软件进行绘图。
2 结 果
2.1 TRFIA 最佳反应条件的确定 本研究建立的双抗体夹心TRFIA 分析法,经过对包被浓度、Eu3+标记试剂:标记抗体比例、反应体系的体积、增强液配方等条件的优化,最终确定了最佳的TRFIA 反应条件如下:包被抗体的浓度为10 μg/mL,100 μL/孔;Eu3+标记试剂:标记抗体最佳比例70 μL∶30 μL(标记物的标记率为每个检测抗体上平均标记9.41 个Eu3+);反应体系为25 μL 标准品或待测样品+200 μL分 析缓冲液+200 μL/孔Eu3+-检测抗体+200 μL/孔增 强 液;增 强 液 配 方:20 μmol β-NTA,50 μmol TOPO,0.1% Triton X-100,0.1 mol/L 邻苯二甲酸氢钾,0.5% 冰醋酸,pH 3.2。具体检测步骤参照文献进行[11]。
2.2 标准曲线及其灵敏度结果 以CDV 标准品系列浓度为横坐标,其对应的荧光值为纵坐标,绘制的标准曲线如图1 所示,方程为:y=2.36+1.025x,线性范围为2.5 ng/mL~640 ng/mL,R2=0.9998,表明本检测方法具有良好的剂量-反应效应。平行测定10 次无CDV 参考标准品的荧光值,并计算其均值(Mean)及标准差(SD),用mean+2SD 代入标准曲线方程,计算得出TRFIA 法的检测下限为0.58 ng/mL。
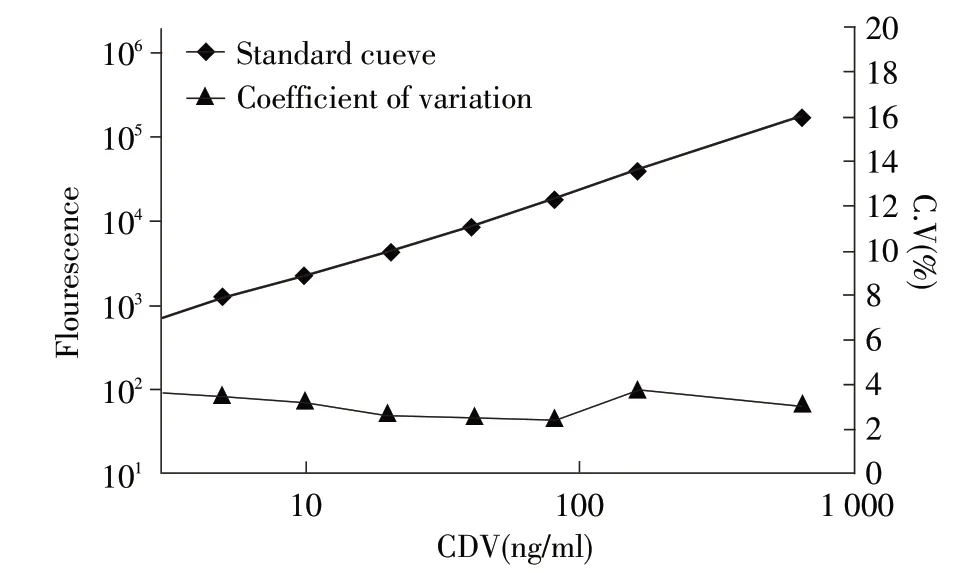
图1 CDV TRFIA 试剂盒的标准曲线及变异系数Fig.1 Standard curve and coefficient of variation of CDV TRFIA Kit
2.3 准确度实验结果 准确度实验结果如表1 所示,3 个样品3 个水平稀释度的稀释回收率在98.98%~105.91%,稀释倍数与浓度呈线性关系,表明本研究建立的TRFIA 法准确度较高。

表1 CDV TRFIA 试剂盒的稀释回收率测定(%)Table 1 Determination of dilution recoveries of CDV TRFIA Kit
2.4 特异性实验结果 利用本研究建立的TRFIA 法检测宠物临床常见病毒,结果显示,除CDV 为阳性外, CPV、CPIV、CAV-1、CCV 均为阴性,无明显交叉反应(表2)。表明该试剂盒特异性良好。
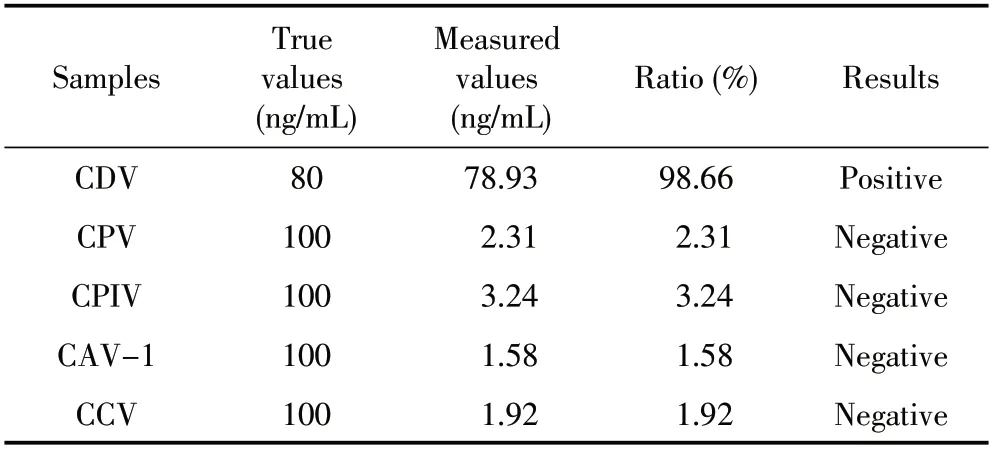
表2 CDV TRFIA 试剂盒的特异性实验结果Table 2 Determination results of the specificity of CDV TRFIA Kitt
2.5 精密度实验结果 用本研究制备的TRFIA 试剂盒进行精密度实验,结果显示:批内CV 值5.60%~7.58%,批间CV 值5.67%~7.64%,批内批间CV 值均小于10%(表3),符合临床检测试剂盒要求。表明该TRFIA 方法制备的试剂盒精密度较高。
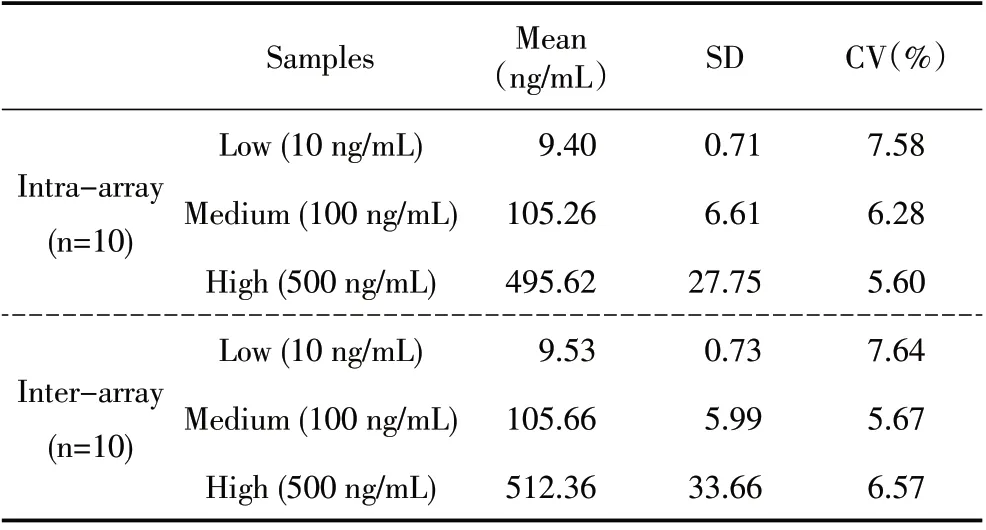
表3 CDV TRFIA 试剂盒的精密度测定结果Table 3 Determination results of the CV of CDV TRFIA Kit
2.6 稳定性实验结果 对本研究制备的TRFIA 试剂盒稳定性测试结果显示,参考标准品的各点荧光值并未随着条件的改变而发生明显变化,试剂盒检测性能无明显改变,符合试剂盒稳定性要求。试剂盒置于4 ℃能稳定保存6 个月以上,37 ℃热破坏性试验能稳定保存7 d 以上。表明该TRFIA 方法制备的试剂盒稳定性好。
2.7 临床样本的检测结果 利用本研究建立的CDV TRFIA 检测试剂盒与RT-PCR 法同时检测临床眼鼻分泌物样品,结果显示,疑似样本63 份阳性,2 份阴性;15 只健康犬均为阴性, 两种检测方法的符合率为100%。表明本研究建立的CDV TRFIA 方法可快速、准确、定量检测CDV 临床样本。
3 讨 论
犬瘟热是由CDV 引起的一种具有高度传染性和致命的全身性疾病,不仅感染犬和其它食肉动物,也在一些非食肉动物发现[12-13]。近几年,宠物犬业发展迅速,CDV 危害严重,造成严重的经济损失。因此,CDV 快速检测技术在该病综合防治中至关重要。
目前,检测CDV 的方法较多。病原学方法主要是实验室对病毒的分离、培养及其鉴定,所需时间长,特异性差。近年来随着科研用仪器设备的不断更新,PCR 和核酸杂交大大提高了CDV 检测的准确性和特异性,缩短了检测时间,但其需要专业的仪器和人员,限制了其广泛应用[14]。在此背景下,胶体金检测试纸因其方便、快捷和成本低廉的优势,在CDV 初级筛查(定性分析)中得到广泛应用[15]。但是对于CDV 的定量分析,目前尚缺乏简便快捷的检测方法。TRFIA 法可实现完全定量分析,具有敏感性强、特异性好、便捷等优势,成为目前最有发展潜力的检测方法。
本研究所研制的试剂盒测定结果显示,试剂盒的灵敏度达到0.58 ng/mL,检测样本浓度在2.5 ng/mL~640 ng/mL 范围内线性良好,检测范围宽,实现了CDV 定量分析,优于病原学和胶体金法仅定性分析的局限性[14-15]。本试剂盒研制参照人体临床检测试剂研制的相关要求(必须设置高中低3 个浓度),并从临床样本实际情况考虑(犬感染瘟热病毒轻重程度不一,造成血液中病毒含量有高有低),设置了高中低3 个浓度,进行精密度实验,其批内与批间的CV 小于10%,达到临床测试要求(批内CV<10%,批间CV<15%);此外,临床样本对比试验表明,本TRFIA法与传统的PCR法相比,检测结果的符合率达到了100%,操作简单快捷,可以替代PCR 法用于CDV 的快速定量分析[6,16]。
综合比较CDV 的病原学分析、胶体金法和PCR法检测的优缺点,本研究研制的TRFIA 法能快速、定量、准确诊断CDV 感染,具有强特异、高敏感、方便快捷等优点,适用于大批量临床样品检测,具有极大的应用前景。

