血清PCT和MIF水平对脓毒症诊断、疾病危重分层及预后的预测效能
凡丽华 刘征 周艳 王靖云 张丽君
脓毒症属于感染性全身炎性反应综合征(SIRS),是常见危重急症之一,尽管现阶段临床监护措施及诊疗技术较为完善,但该疾病病死率仍居高不下,其中严重脓毒症及脓毒症休克是重症监护室患者死亡的主要病因[1,2]。早期确诊并及时给予有效治疗是减少脓毒症患者死亡的重要手段。降钙素原(procalcitonin,PCT)是临床诊断细菌性感染疾病的敏感指标之一,其血浆浓度和炎症活性程度呈正相关[3]。巨噬细胞移动抑制因子(migration inhibitory factor,MIF)在炎性因子产生及释放中的调节作用显著,所以在炎症影响下,血浆MIF浓度也有不同程度的升高现象,因此在脓毒症诊治过程中血浆PCT、MIF浓度具有重要检测意义[4]。本文选取80例脓毒症患者与25例健康人群作为研究对象,分析PCT及MIF水平在脓毒症患者诊断、分级与预后评估中的应用价值,报告如下。
1 资料与方法
1.1 一般资料 选取2016年1月至2019年1月我院收治的221例脓毒症患者为观察组,另选取同期常规体检的107例健康人群为对照组。观察组:男131例,女90例;年龄18~80岁,平均年龄(59.82±3.14)岁。对照组:男54例,女53例;年龄18~78岁,平均年龄(59.18±3.16)岁。其中观察组221例患者按照其疾病程度其分为脓毒症组(52例),严重脓毒症组(123例)及脓毒症休克组(46例)。脓毒症组:男29例,女23例;年龄18~79岁,平均年龄(59.37±3.14)岁;严重脓毒症组:男70例,女53例;年龄19~79岁,平均年龄(59.45±3.11)岁;脓毒症休克组:男32例,女18例;年龄20~78岁,平均年龄(59.67±3.12)岁。并根据患者预后将221例脓毒症患者分为生存组(102例)和死亡组(119例)。生存组:男58例,女54例;年龄19~78岁,平均年龄(59.71±3.12)岁;死亡组:男63例,女56例;年龄20~78岁,平均年龄(59.37±3.18)岁。各组研究对象的临床资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 观察组均在确诊24 h内标本采集,对照组体检当天标本采集。采用EDTA抗凝管对患者外周静脉血,血液样本低速离心,分离血清后保存于-80℃环境下。采用电化学发光免疫分析(ECLIA)对患者血清PCT浓度进行检测;采用酶联免疫吸附测定(ELISA)对患者MIF浓度进行测定。ECLIA法试剂盒由德国Brahms公司提供,ELISA法试剂盒由美国R&D公司提供。
1.3 PCT及MIF水平不同分层方法 根据血清中PCT及MIF的最佳诊断临界值,将血清中PCT浓度>1.600 ng/ml时为PCT(+)组、<1.600 ng/ml时为PCT(-)组;当血清中MIF浓度水平>39.5 ng/ml时为MIF(+)组、<39.5 ng/ml时为MIF(-)组。
2 结果
2.1 脓毒症患者基本资料情况 记录患者30 d的生存情况,其中死亡119例(53.8%),生存102例(46.2%)。其中脓毒症休克组占死亡人数比例最高,为69.6%,且脓毒症患者不同疾病危重程度与患者预后差异有统计学意义(P<0.05)。见表1。

表1 脓毒症患者基本资料情况 例(%)
2.2 脓毒症患者血清中PCT和MIF的诊断价值
2.2.1 脓毒症患者与健康人群血清PCT和MIF水平比较 观察组血清PCT水平、MIF水平均明显高于对照组,差异有统计学意义(P<0.05)。见表2。
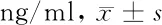

组别PCTMIF观察组(n=221)4.686±0.09750.68±1.940对照组(n=107)1.386±0.25328.96±1.222t值14.827.446P值<0.0001<0.0001
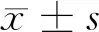
2.2.2 血清中PCT和MIF的ROC曲线:PCT预测脓毒症诊断的曲线下面积(AUC)为0.870(P<0.001)。PCT的最佳诊断临界值为1.600 ng/ml,其中诊断敏感度为96.4%,诊断特异性为82.2%。MIF预测脓毒症诊断的曲线下面积(AUC)为0.865(P<0.01)。MIF的最佳诊断临界点为39.5 ng/ml,其中诊断敏感度为89.1%,诊断特异性为79.4%。但当二者联合诊断脓毒症时。ROC曲线下面积约为0.951,诊断敏感度为92.3%,诊断特异性为90.7%。见图1。
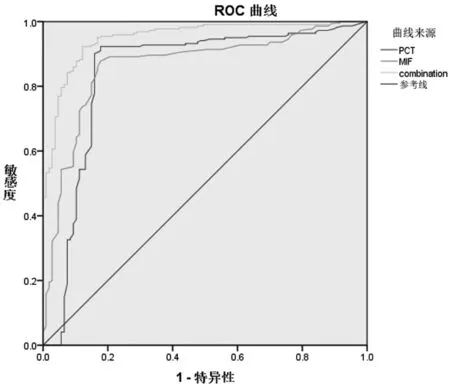
图1 PCT和MIF对脓毒症患者的诊断ROC曲线
2.3 血清中PCT和MIF水平与脓毒症患者疾病危重分层的相关性分析
2.3.1 脓毒症不同分层患者血清PCT和MIF水平比较:严重脓毒症组及脓毒症休克组PCT水平高于脓毒症组,差异有统计学意义(P<0.05);且脓毒症组、严重脓毒症组及脓毒症休克组MIF水平比较,差异有统计学意义(P<0.05)。见表3。
2.3.2 血清中PCT和MIF水平分级和不同脓毒症疾病分层的相关性分析:PCT及MIF不同水平分级与脓毒症患者的不同分层显著相关(P<0.01)。PCT及MIF均阳性在全部脓毒症患者中所占比例最高,为57.0%;而脓毒症休克组中PCT(+)/MIF(+)所占比例在脓毒症不同分层患者中占比最高,为78.3%;脓毒症组中PCT(-)/MIF(-)所占比例在脓毒症不同分层患者中所占比例最高,为30.8%。见表4。
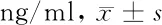
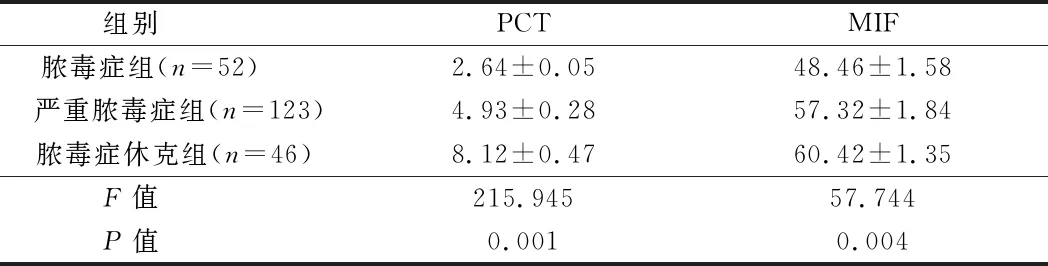
组别 PCTMIF脓毒症组(n=52) 2.64±0.0548.46±1.58严重脓毒症组(n=123)4.93±0.2857.32±1.84脓毒症休克组(n=46)8.12±0.4760.42±1.35F值 215.94557.744P值 0.0010.004
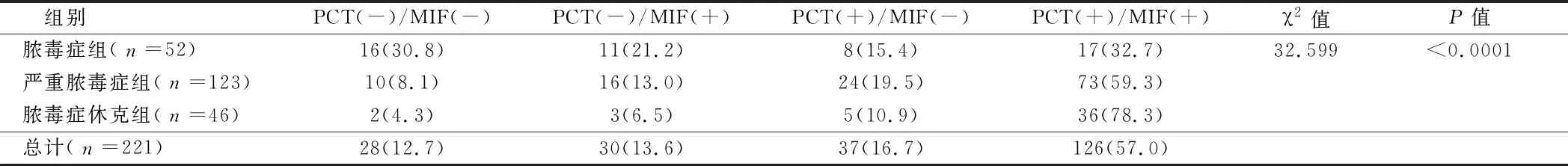
表4 血清中PCT和MIF水平分级与脓毒症患者疾病分层的相关性分析 例(%)
2.4 血清中PCT和MIF水平与脓毒症患者预后的相关性分析
2.4.1 脓毒症不同预后患者血清PCT和MIF水平比较:生存组、死亡组PCT水平比较,差异无统计学意义(P>0.05),但生存组的MIF水平显著低于死亡组,差异有统计学意义(P<0.05)。见表5。
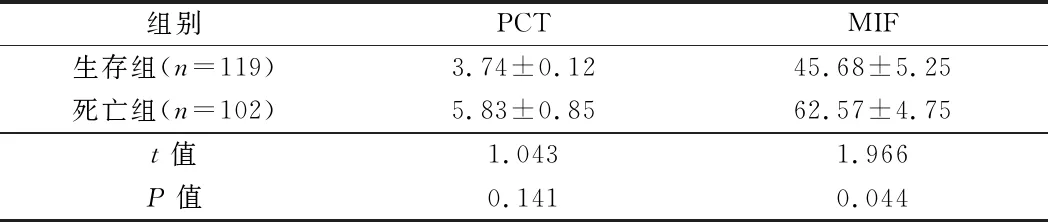
2.4.2 血清中PCT和MIF水平分级与脓毒症患者不同预后相关性分析:PCT(+)/MIF(+)在脓毒症患者生存组及死亡组中所占比例均最高,分别为42.9%和73.5%。PCT及MIF不同水平分级与脓毒症患者的预后显著相关(P<0.0001)。见表6。
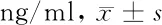
组别PCTMIF生存组(n=119)3.74±0.1245.68±5.25死亡组(n=102)5.83±0.8562.57±4.75t值1.0431.966P值0.1410.044

表6 血清中PCT及MIF不同水平分级与脓毒症患者不同预后相关性分析 例(%)
3 讨论
脓毒症多发生在严重创伤、严重烧伤、外科大手术后及休克患者中,若不能及时给予有效救治,可导致脓毒性休克或多器官功能衰竭,是重症监护室患者死亡的首要病因[5,6]。根据流行病学调查结果,全球每年有脓毒症患者3 150万例次,严重脓毒症患者1 940万例次,对27个发达国家的相关研究展开荟萃分析,得出脓毒症的病死率为17%,严重脓毒症的病死率为26%[7,8]。有研究资料表明,严重脓毒症及脓毒症休克进入重症监护室后最初6 h诊断延误与其死亡有直接关系[9]。且脓毒症的临床死亡率高,从脓毒症发展至脓毒症休克仅需24 h,脓毒症患者典型的三联征为发热、心动过速及呼吸加快,不具典型性,因此诊断及治疗延误现象也是影响其预后的关键因素。本研究纳入221例脓毒症不同疾病分层的患者,期望能够寻找新的诊断及评估脓毒症患者预后的因子,为早期预测脓毒症及疾病分层提供指导,有效提高脓毒症患者的生存率,具有重要临床意义。
目前,临床主要以C-反应蛋白、红细胞沉降率、白细胞计数、脑利尿钠肽、D-二聚体、白介素-6等为脓毒症生物标记物,在脓毒症诊断及病情评估中的应用价值较高,但存在病原微生物培养时间长、阳性检出率低等缺点,且在评估脓毒症患者预后方面临床价值一般[10,11]。现阶段,随着医疗水平上升,科学技术不断发展,更多生物标记物被用于脓毒症诊断、疾病危重分层及预后评估中,且取得了更为理想的效果。PCT是降钙素的前提,属于糖蛋白的一种,由116个氨基酸组成,主要反映全身炎症活跃程度,健康人群血清中的含量极低,但在严重感染、全炎性反应、多器官功能衰竭及脓毒症发生时,PCT浓度均可见明显增加现象,所以在病毒感染及细菌感染鉴别诊断中的应用价值显著[12,13]。MIF是 SIRS发生及发展中的关键介质,由115个氨基酸组成,在多器官组织中均存在,且参与多种疾病的病理病变过程,是一种多效能蛋白分子,具有细胞因子、神经内分泌激素及酶的特性,能够抑制巨噬细胞游走,促进巨噬细胞在炎症局部激活,并促进了IL-1、IL-8、TNF-α等细胞因子分泌,在机体炎性反应中的参与积极性高,所以在脓毒症患者中积极测定其浓度,对患者诊治有重要的参考价值[14]。
本研究评估PCT及MIF对脓毒症患者的诊断,疾病分层及预后价值。本研究结果显示,观察组PCT及MIF浓度显著高于对照组(P<0.05),说明在脓毒症诊断中PCT及MIF浓度的临床意义较大。对两种因子的ROC曲线分析发现,PCT及MIF单独诊断时,均具有较好的诊断预测价值,但两者的诊断特异性较差限制了预测的准确性。当血清中PCT及MIF联合诊断时,不仅能有效提高脓毒症的诊断效能,更能有效增加诊断的准确性。此外,严重脓毒症组及脓毒症休克组PCT及MIF水平显著高于脓毒症组(P<0.05),说明两种因子在脓毒症病情危重分层中的临床价值也较高。赵倩等[15]研究中,重点对降钙素原在脓毒症患者病情及预后评估中的价值进行了分析,结果证实PCT值能够准确评估患者病情,且PCT水平与患者的病程呈正相关。与本研究一致。逯峰等[16]的大鼠实验研究表明,在脓毒症大鼠实施盲肠结扎穿孔法(cecal ligation plus puncture,CLP)建立严重腹腔感染模型后6 h,大鼠血清中MIF水平已经明显上升,说明脓毒症大鼠炎性反应在炎症感染6 h内就已经发生。这些研究结果提示PCT与MIF对脓毒症疾病严重程度分层具有重要的参考价值。然而,本研究结果发现PCT水平在脓毒症患者不同预后中无显著差异(P>0.05),提示PCT浓度不能准确的预测脓毒症患者的死亡结局,所以对脓毒症患者预后的评估需要效能更高的生物学指标。但生存组中MIF水平显著低于死亡组,这可能是由于细菌感染能刺激MIF分泌,但应激反应对MIF分泌也有激活作用,巨噬细胞被激活后MIF能够大量分泌[17,18]。程圆圆等[19]也报道了PCT及MIF对脓毒症患者的诊断、疾病分层及预后的临床价值。但本研究纳入了更多的脓毒症样本与健康对照组,更能说明PCT和MIF在脓毒症患者中的临床意义。此外,本研究首次评估了PCT及MIF不同水平的分级与脓毒症疾病严重程度及预后之间的相关性,表明PCT(+)/MIF(+)与脓毒症疾病严重程度分层及患者预后具有一定相关性。
综上所述,在脓毒症诊治过程中,可将PCT、MIF联合测定,不仅能够快速识别与诊断脓毒症,还能对其病情分层进行明确分级,准确评估其预后,为临床治疗方案的制定提供重要资料,且PCT、MIF检测经济性高、方便快捷、可重复性强,可在临床进一步推广。

