儿童耐氨苄西林流感嗜血杆菌耐药机制及同源性研究
王姜琳, 孙 杰, 杨慧健, 王冰洁, 潘 芬, 张 泓
(1. 上海交通大学附属儿童医院检验科,上海 200040;2. 上海健康医学院附属嘉定区中心医院检验科,上海 201800)
流感嗜血杆菌(Haemophilus influenzae,Hi)是一种革兰阴性杆菌,常寄居于人上呼吸道,为条件致病菌,也是儿童社区获得性感染的主要致病菌。感染Hi的儿童占全部感染人群的20%[1-2],在革兰阴性杆菌所致的肺炎中位居第三[3],可引起肺炎、支气管炎、化脓性脑膜炎、血流感染和中耳炎等感染性疾病,严重威胁儿童的身体健康[4-5]。氨苄西林作为治疗Hi的主要抗菌药物,近年来耐药率不断上升。产β-内酰胺酶是Hi对氨苄西林耐药的主要机制,不产β-内酰胺酶氨苄西林耐药(beta-lactamase-negetive ampicillin-resistance strains,BLNAR)菌目前占耐药株的8%~10%[6-7],逐渐受到临床关注,但其耐药机制及分子流行病学特征目前尚不明确。本研究对117株Hi临床分离株进行耐药性、氨苄西林耐药机制及同源性分析,以期为临床抗感染治疗和控制耐药提供参考。
1 材料和方法
1.1 菌株来源
117株Hi菌株(剔除重复菌株)均分离自2018年4—6月上海交通大学附属儿童医院住院患儿各类临床样本,其中114株分离自痰液样本,2株分离自鼻咽拭子样本,1株分离自肺泡灌洗液样本。所有菌株均接种于40%甘油肉汤菌种保存液,-80 ℃冰箱保存。
1.2 试剂与仪器
巧克力平板(上海科玛嘉微生物有限公司),氨苄西林、氨苄西林-舒巴坦、克拉霉素、复方磺胺甲噁唑、头孢类、氯霉素、左氧氟沙星及美罗培南等抗菌药物粉剂、硝酸噻吩试纸(英国Oxiod公司),WHB 96孔药物敏感性试验微孔板(美国赛默飞世尔公司),引物合成、聚合酶链反应(polymerase chain reaction,PCR)扩增试剂盒及1 000 bp相对分子质量标准[生工生物工程(上海)有限公司],Z480 PCR扩增仪(瑞士罗氏公司),Gel DocXR+凝胶成像系统(美国Bio-Rad公司),测序由上海柏辰生物公司完成。
1.3 方法
1.3.1 Hi菌株复苏及鉴定 将保存于-80 ℃的Hi菌株复苏,分区划线接种于巧克力平板,35℃、5%CO2条件下培养20~24 h,挑取巧克力平板上可疑菌落密集划线于TSA平板上,并贴上V、X及V+X因子纸片,于37℃、5%CO2条件下培养20~24 h。若出现卫星现象(即V、X因子周围不生长,仅在V+X因子周围生长)则鉴定为Hi。
1.3.2 体外药物敏感性试验 采用微量肉汤稀释法进行体外药物敏感性试验,质控菌株Hi (ATCC 49247),结果判读参照美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)M100-S26文件。
1.3.3 氨苄西林耐药Hi菌株β-内酰胺酶检测 用头孢硝噻纸片刮取少许巧克力平板上耐氨苄西林Hi菌落,15 min内观察,若纸片变红为β-内酰胺酶阳性,反之为阴性。
1.3.4 氨苄西林耐药Hi菌株DNA模板制备 采用煮沸法提取氨苄西林耐药菌株DNA模板。挑取1接种环的Hi菌落,置于含有300 μL无菌0.9%氯化钠溶液的无菌Eppendorf管中研磨均匀,100 ℃恒温金属浴中温浴10 min,1 500×g离心机离心1 min,吸取上清液即为细菌DNA模板,保存于-20 ℃冰箱备用。
1.3.5 氨苄西林耐药HiTEM-1、ROB-1及ftsI基因PCR扩增 (1)引物设计。依据文献[6-7]与GeneBank数据库设计β-内酰胺酶TEM-1、ROB-1基因及编码青霉素结合蛋白3的ftsI基因引物,引物由生工生物工程(上海)有限公司合成,并经过次黄嘌呤-氨基蝶呤-胸腺嘧啶脱氧核苷酸纯化。引物序列见表1。(2)PCR扩增体系。PCR反应体系总体积为50 μL:10 mmol/L dNTP 1 μL,10×buffer 5 μL,Mg+3 μL,Taq DNA聚合酶0.5 μL,10 μmol/L上、下游引物各1 μL,DNA模版5 μL,无菌去离子水补足至50 μL。扩增条件:94 ℃预变性7 min;94 ℃ 30 s,56 ℃(以TEM-1为例,其余基因引物退火温度见表1)30 s,72 ℃ 30 s循环30次;72 ℃延伸3 min。
1.3.6 琼脂糖凝胶电泳 取5 μL扩增产物与1 μL 6×LoadingBuffer混匀,上样于2%琼脂糖凝胶加样槽中,同时留1个空孔加入5 μL 1 000 bp相对分子质量标准,恒压100 V 30 min,于凝胶成像系统下观察扩增条带。
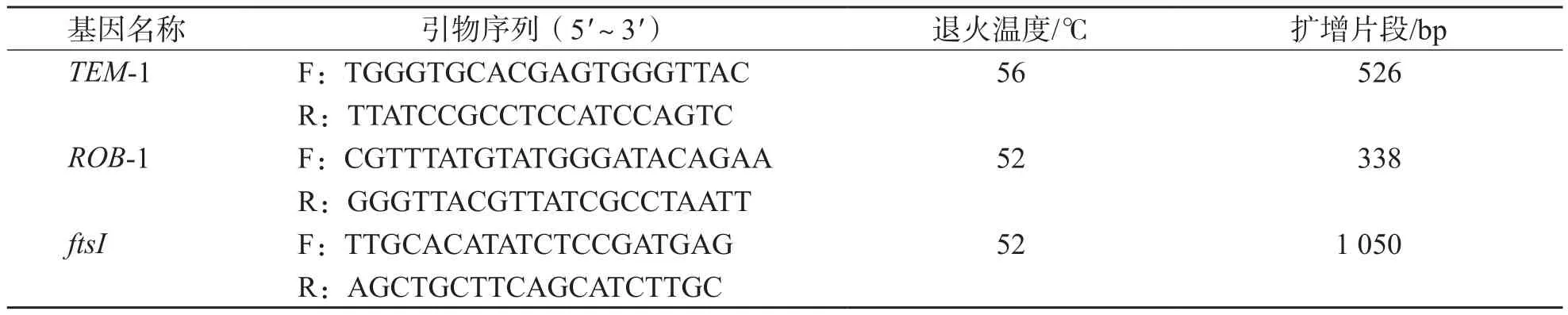
表1 TEM-1、ROB-1及ftsI基因引物序列
1.3.7ftsI基因测序 将PCR扩增后的ftsI基因进行测序,测序结果与Hi的RdKW20标准菌株的ftsI基因进行Blast比对。
1.3.8 氨苄西林耐药菌株多重PCR基因分型 (1)引物设计。依据参考文献[8]与GeneBank数据库设计多重PCR基因引物,其中一对引物来自Hi特异具有长度多态性的染色体DNA片段Hinf,另一对引物来自外膜蛋白P1-Hamp。引物序列见表2。(2)多重PCR扩增体系。10 mmol/L dNTP 1 μL,10×buffer 5 μL,Mg+7 μL,Taq DNA聚合酶0.5 μL,10 μmol/L上、下游引物各1 μL,DNA模版5 μL,无菌去离子水补足至50 μL。扩增条件:94 ℃预变性7 min;94 ℃45 s,45 ℃ 45 s,72 ℃ 45 s循环30次;72 ℃延伸7 min。扩增产物经2.5%凝胶电泳40 min,扩增条带通过GIS ID分析软件进行分型。
1.4 统计学方法
采用SAS V8软件进行统计分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Hi耐药性分析
H i对复方磺胺甲噁唑的耐药率最高(80.3%),对头孢类、氯霉素、左氧氟沙星及美罗培南的敏感率均高于80%。见表3。
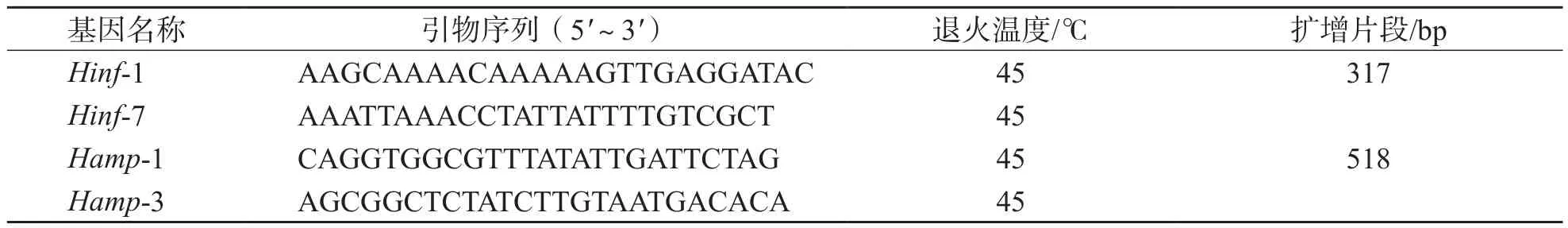
表2 Hinf及Hamp基因引物序列
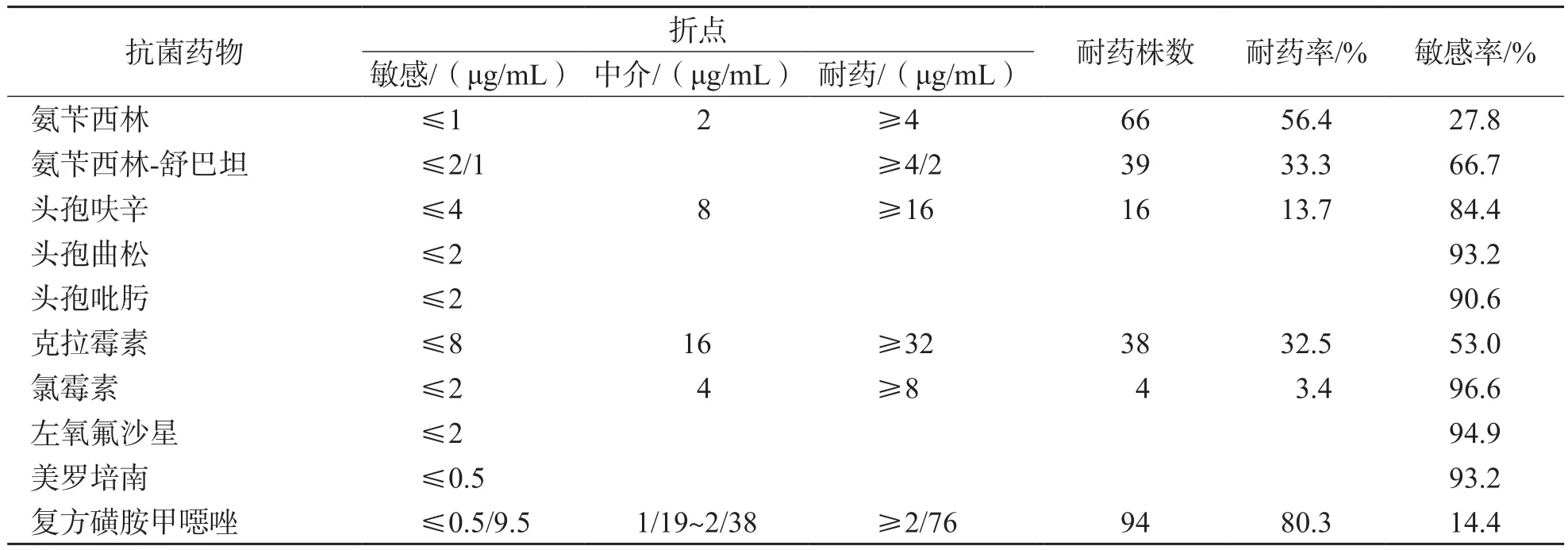
表3 Hi对抗菌药物的耐药性
2.2 氨苄西林耐药Hi菌株β-内酰胺酶检测及产酶基因检测
66株氨苄西林耐药Hi中有54株产β-内酰胺酶,12株不产β-内酰胺酶,β-内酰胺酶检出率为46.2%(54/117)。54株产β-内酰胺酶氨苄西林耐药(beta-lactamase-positive ampicillin-resistance strains,BLPAR)菌产酶基因均为TEM-1基因,未检出ROB-1基因,凝胶电泳图见图1。
2.3 BLNAR菌与BLPAR菌耐药性分析
BLPAR菌株对9种抗菌药物的耐药率均高于BLNAR菌株,但2类耐药菌株只对大环内酯类与磺胺类抗菌药物的耐药率差异有统计学意义(P<0.05),对头孢类和碳青霉烯类抗菌药物的耐药率差异均无统计学意义(P>0.05)。见表4。
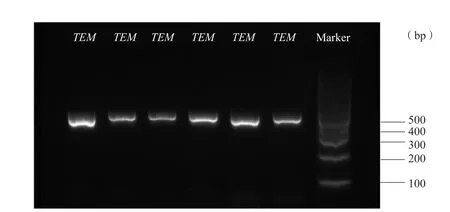
图1 TEM-1基因检测结果
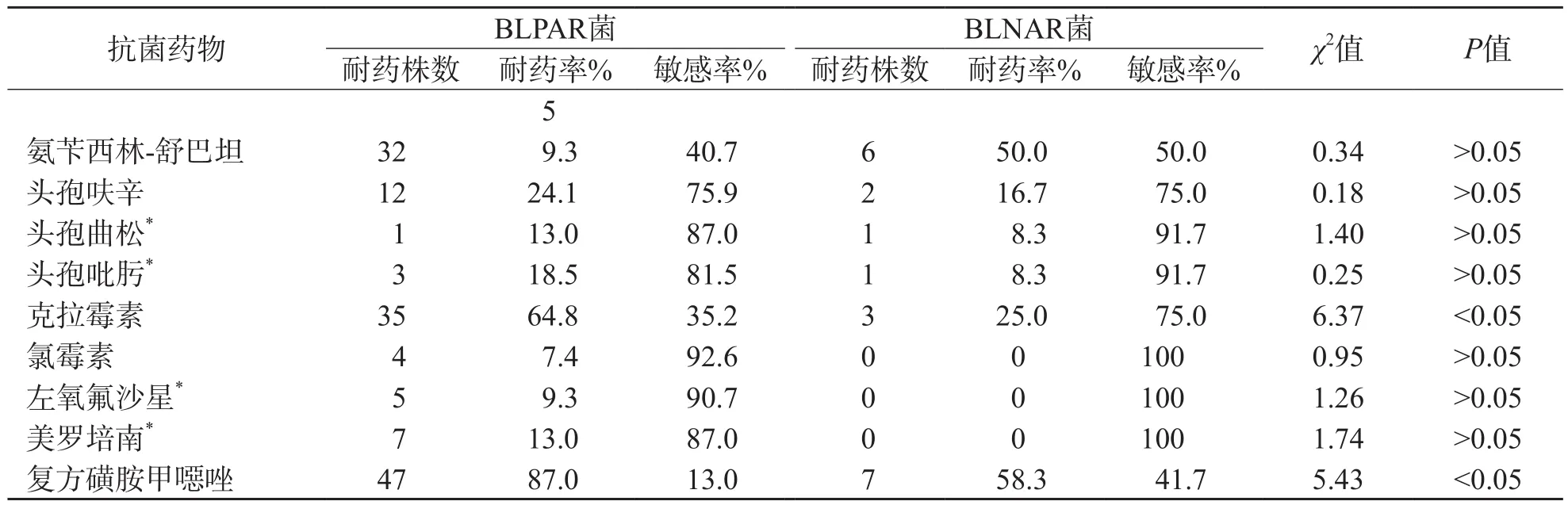
表4 BLPAR与BLNAR Hi菌株对抗菌药物的耐药率与敏感率
2.4 氨苄西林耐药Hi菌株ftsI基因扩增及测序
66株氨苄西林耐药Hi均扩增出ftsI基因,凝胶电泳图见图2。测序结果显示BLPAR菌中有37株HiftsI基因发生氨基酸置换,突变率为68.5%(37/54),BLNAR菌中有9株ftsI基因发生氨基酸置换,突变率为75.0%(9/12);依据不同氨基酸置换形式可将ftsI基因分为不同的基因型[9],2种菌ftsI基因型均以Ⅲ型为主,且SSN序列盒附近均以Ser385Thr置换形式为主,BLPAR菌与BLNAR菌发生Asn526Lys置换合并Ser385Thr置换分别占51.4%(19/37)、77.8%(7/9);BLPAR菌中有2株发生氨基酸置换,但不可分型,1株菌同时具有Ⅰ与Ⅱ型的氨基酸置换形式。37株ftsI基因突变BLPAR菌与9株ftsI基因突变BLNAR菌氨基酸置换形式见表5。
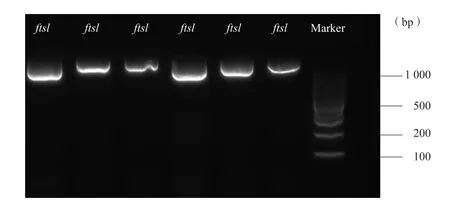
图2 ftsI基因检测结果

表5 BLPAR与BLANR菌不同氨基酸置换形式菌株数
2.5 氨苄西林耐药Hi多重PCR分型结果
66株氨苄西林耐药Hi通过多重PCR分型共分为a、b、c、d、e 5个型[8]。BLPAR菌5个型均有,BLNAR菌仅有a型和e型,不同分型均具有克隆传播趋势。2种菌均以a型为主,分别占63%(34/54)和75%(9/12)。凝胶电泳图见图3。
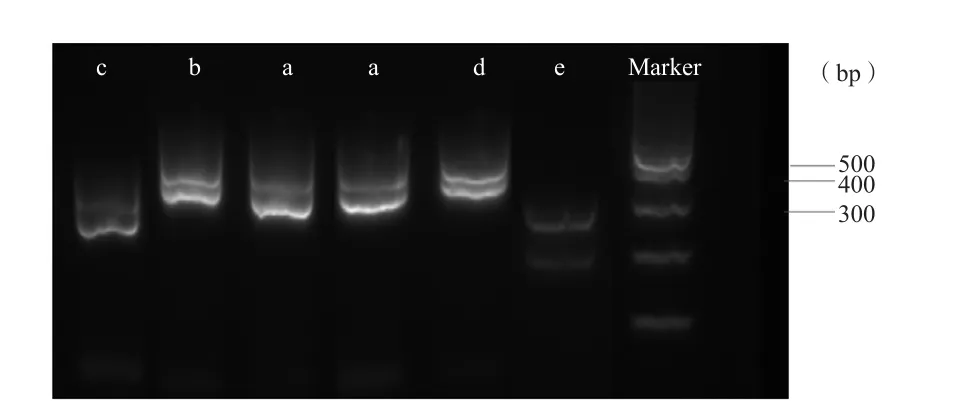
图3 多重PCR分型结果
3 讨论
Hi是一种条件致病菌,常寄居于人的上呼吸道,以1~10岁的儿童感染为主[10],于2—5月及冬春季分离率最高[11]。本研究菌株分离自2018年4—6月(第二季度),患儿年龄均在10岁以内,以患有支气管肺炎为主,分离样本以痰液为主,补充了秦惠宏等[6]对2016年第一季度141株Hi临床分离株的相关研究。
氨苄西林作为β-内酰胺酶类抗菌药物被用于治疗由Hi引起的各种感染,但随着其被广泛使用,耐药率也呈上升趋势。我国2007—2014年CHINET细菌耐药性监测数据显示,Hi对氨苄西林的耐药率由30.1%[12]上升至41.8%[7]。Hi对氨苄西林耐药的机制为产β-内酰胺酶,已知的β-内酰胺酶基因型主要有TEM和ROB型[10],其中以TEM-1型为主[13]。同时还存在其他耐药机制。2007—2014年,我国BLNAR菌株由2.7%[12]上升至8.6%[7]。国外BLNAR菌株占Hi的22.8%~40.8%[14-15],明显高于我国,以日本尤为严重,可能是因地区不同而导致耐药机制出现差异。本研究117株Hi中氨苄西林耐药率为56.4%,β-内酰胺酶检出率为46.2%,产β-内酰胺酶耐药基因均为TEM-1基因,提示产TEM-1型β-内酰胺酶仍是氨苄西林耐药Hi的主要耐药机制,β-内酰胺酶阴性耐药菌株检出率为10.3%,与秦惠宏等[6]报道的相关数据(53.2%、44.7%、12.8%)基本一致,提示上海地区耐氨苄西林Hi检出率及不同机制构成比相对稳定。Hi对复方磺胺甲噁唑的耐药率最高,对氨苄西林-舒巴坦、克拉霉素有较高的耐药率,对头孢类、氯霉素、氟喹诺酮及碳青霉烯类药物有较高的敏感率,可能与儿童用药选择性有关,对氨苄西林与磺胺类抗菌药物的高耐药率表明Hi菌株已经不适合采用这2种抗菌药物进行经验治疗。BLPAR菌株对抗菌药物的耐药率均高于BLNAR菌株,但2种菌只对大环内酯类与磺胺类抗菌药物的耐药率有统计学意义(P<0.05),对头孢类、碳青霉烯类抗菌药物的耐药率均无统计学意义(P>0.05),可见BLPAR所致耐药比BLNAR所致耐药对抗菌药物耐药性的影响更为显著。
既往研究发现,Hi的BLANR菌株耐药机制可能与ftsI基因突变导致青霉素结合蛋白3与β-内酰胺类抗菌药物的亲和力下降有关。根据不同位点的氨基酸置换,UBUKATA等[9]根据ftsI基因测序结果将Hi分为Ⅰ型、Ⅱ型与Ⅲ型。有文献报道BLNAR菌以Ⅱ型为主,并首次检出了同时含有Met377Ile、Ser385Thr和Leu389Phe 3种氨基酸置换的BLNAR菌株[16]。秦惠宏等[6]发现我国上海地区HiftsI基因分型以Ⅲ型为主。表明不同时间、不同国家、不同地区可能会因用药习惯不同而导致ftsI基因型不同。本研究结果显示,54株BLPAR中有37株ftsI基因发生氨基酸置换,突变率为68.5%,表明BLPAR菌除产酶机制以外,也可能同时存在ftsI基因突变机制。这2种机制同时存在的BLPAR菌被称为β-内酰胺酶阳性阿莫西林-克拉维酸耐药Hi。BLNAR菌中有9株ftsI基因发生氨基酸置换,突变率为75.0%(9/12),BLNAR菌中有3株菌未发生ftsI基因突变,提示可能存在着其他耐药机制,如外排泵机制等。2种菌ftsI基因型均以Ⅲ型为主,与秦惠宏等[6]的研究结果一致,表明上海地区氨苄西林耐药HiftsI基因型别相对稳定。不同的ftsI基因型可能是由不同地区用药习惯不同所致。本研究中ftsI基因氨基酸置换形式均以KTG基序附近发生Asn526Lys置换合并SSN基序附近发生Ser385Thr置换为主;BLPAR菌中有2株菌发生氨基酸置换,但不可分型,1株菌同时具有Ⅰ与Ⅱ型的氨基酸置换形式。此外,本研究检出了同时含有Met377Ile、Ser385Thr和Leu389Phe 3种氨基酸置换的BLPAR菌株,值得关注。
多重PCR因基因分型能力与脉冲场凝胶电泳分型能力接近,且比脉冲场凝胶电泳分型方法简便、快捷[17],通常被用于对细菌进行基因分型,从而判定菌株亲缘关系,了解细菌的同源性及分子流行病学特点。本研究多重PCR结果表明,BLPAR菌分为a、b、c、d、e型,BLNAR菌分为a、e型,且均有克隆传播趋势;2种菌均以a型为主,表明氨苄西林耐药Hi以a型为主,与姜敏等[17]的报道一致。不同分型与抗菌药物耐药性及不同氨苄西林耐药机制并无明显的相关性,但都存在克隆传播趋势。
综上所述,Hi对氨苄西林与磺胺类抗菌药物的高耐药率使这2种抗菌药物不适合用于Hi的常规用药;氨苄西林耐药Hi的耐药机制以产TEM-1型β-内酰胺酶为主,不产酶的耐药机制主要是由KTG基序附近发生Asn526Lys置换合并SSN基序附近发生Ser385Thr置换介导ftsI基因突变所致,部分产酶菌株可以同时存在ftsI基因突变,突变机制同不产酶耐药株。2种耐药菌ftsI基因型均以Ⅲ型为主;产酶耐药株比不产酶耐药株对抗菌药物耐药性的影响更为显著;BLPAR菌与BLNAR菌均存在克隆传播趋势。本研究中分离出同时含有Met377Ile、Ser385Thr和Leu389Phe 3种氨基酸置换的BLPAR菌株,另有3株BLNAR未发生ftsI基因突变,可能存在着其他耐药机制,有待于进一步研究。密切观察Hi耐药性、氨苄西林耐药机制及同源性,有助于临床合理进行抗感染治疗和控制耐药。

