活血通络利水方含药血清在高浓度谷氨酸环境下对Müller细胞谷氨酸-天冬氨酸转运体、谷氨酰胺合成酶蛋白表达及活性的影响※
贾 鑫 苏学敏 张 越 袁立飞 杨赞章 张铭连
(河北省眼科医院河北省眼科学重点实验室,河北 邢台 054001)
活血通络利水方为河北省首届名中医张铭连教授基于络病理论和长期临床实践创立的一首活血通络名方,具有活血通络、祛瘀解毒的功效,用于治疗各种原因导致的目络瘀阻而造成的缺血性眼病,并获国家发明专利[1]。活血通络利水方在眼科临床应用20余年,治疗缺血性眼病已取得确切临床疗效,能够提高患者视力,改善视野[2-3],并改善患者血脂水平和血液流变学指标[4]。缺血性眼病视力损伤的发生机制复杂,重要原因之一为视网膜微环境中高浓度的谷氨酸(GLU)对视网膜神经节细胞(RGC)的兴奋性神经毒性损伤[5-6]。Müller细胞作为视网膜内主要的神经胶质细胞,通过GLU-天冬氨酸转运体(GLAST)和谷氨酰胺合成酶(GS)维持视网膜正常的GLU代谢,以支持并保护视网膜各级神经元[7]。为进一步探讨活血通络利水方的作用机制,我们采用高浓度GLU损伤Müller细胞,观察活血通络利水方含药血清对细胞GLAST、GS蛋白表达及活性的影响,以期为中药复方治疗缺血性眼病提供更多的理论依据和防治思路。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞 SD大鼠(雄性)40只,周龄6~8周,体质量(180±20)g,由长沙市天勤生物技术有限公司提供,动物许可证号:SCXK[湘]2014—0011。SD大鼠Müller细胞,由上海哈灵生物科技有限公司提供(批号:HL-C643)。
1.1.2 药物 活血通络利水方药物组成:黄芪30 g,当归尾15 g,赤芍12 g,川芎10 g,桃仁10 g,红花10 g,水蛭6 g,丹参12 g,葛根30 g,丝瓜络10 g,郁金10 g,石菖蒲10 g,泽兰10 g,茺蔚子15 g,金银花30 g。由河北省眼科医院中药房、制剂科提供。经水煎,浓缩为含生药2 g/mL和4 g/mL的合剂。
1.1.3 仪器 二氧化碳培养箱、-80 ℃冰箱(美国Thermo公司);4 ℃冰箱(中国海尔集团);倒置荧光显微镜(日本OLYMPUS公司);酶标仪(美国BioTek公司);TGL-16gR高速冷冻离心机(上海安亭科学仪器厂);电热恒温水槽(上海一恒科学仪器有限公司);小型垂直电泳槽、小型转印电泳槽(美国Bio-Red公司);高效液相色谱仪(日本岛津公司);TS-2型脱色摇床(海门市其林贝尔仪器制造有限公司)。
1.1.4 试剂 0.9%氯化钠注射液(中国石药银湖制药有限公司,国药准字H14020821,批号:41218093009);银杏叶片(扬子江药业集团有限公司,国药准字Z20027949,批号:18070621);GLAST抗体(批号:ab416),GS抗体(批号:ab73593),β-actin抗体(批号:ab8227),GLU(批号:G8415),以上试剂均购自美国Abcam公司;辣根过氧化物酶(HRP)标记的羊抗兔免疫球蛋白G(IgG)(批号:BA1054),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)制备试剂盒(批号:P1200),免疫化学发光法(ECL)试剂盒(批号:AR1170),以上试剂均购自武汉博士德生物工程有限公司;蛋白裂解液(批号:C900226-0050),蛋白印迹膜再生液(批号:C500031),0.22 μm滤膜(批号:F502522),以上试剂均购自生工生物工程上海股份有限公司;噻唑蓝(MTT)(批号:M8180),二喹啉甲酸(BCA)蛋白浓度测定试剂盒(批号:PC0020),二甲基亚砜(批号:D8371),脱脂奶粉(批号:D8340),TBST缓冲液(批号:T1081),以上试剂均购自北京索莱宝科技有限公司;色谱级甲醇(批号:M20003),购自北京谨明生物科技有限公司;聚偏氟乙烯(PVDF)膜(批号:ISEQ00010),购自美国Merck Millipore公司。
1.2 方法
1.2.1 活血通络利水方含药血清制备 将40只健康SD大鼠(雄性)按照随机数字表法分为4组,即正常组、银杏叶组、活血通络利水方低剂量组和活血通络利水方高剂量组,每组10只。活血通络利水方低、高剂量组分别予浓度2、4 g/mL的活血通络利水合剂10 mL/kg(20 g/kg、40 g/kg)灌胃,银杏叶组予银杏叶片水溶剂5.2 mg/kg灌胃,正常组予等容积0.9%氯化钠注射液灌胃,每日1次,连续灌胃7 d。灌胃期间大鼠自由摄取食水。末次给药1 h后,腹主动脉取血,3 500 r/min离心10 min收集血清,灭活,0.22 μm滤膜过滤除菌,分装并保存于-80 ℃冰箱备用。
1.2.2 MTT法检测细胞存活率 Müller细胞以1×105个/mL密度接种于96孔板,每孔加入100 μL DMEM培养基,静置于5%CO2、37 ℃ 培养箱培养。待细胞贴壁后弃去培养基,分别加入含0、0.1、0.5、1、10、20、25、30 mmol/L GLU浓度的培养基处理24 h,各浓度处理组设立5个复孔,之后各孔加入20 μL MTT溶液(5 mg/mL)继续孵育4 h。弃去上清液,各孔加入150 μL二甲基亚砜,摇床震荡15 min溶解结晶物。应用酶标仪于波长570 nm处测量各孔的吸光度值。计算各组吸光度均值,各组均值/0 mmol/L GLU均值为各组细胞存活率。
1.2.3 Western Blot检测GLAST、GS蛋白表达 Müller细胞设为5组,即正常组、模型组、银杏叶组、活血通络利水方低剂量组及活血通络利水方高剂量组,各组设立8个复瓶。细胞以 2×106个/mL 密度接种于 T25 培养瓶,每瓶加入 2 mL DMEM培养基,静置于5%CO2、37 ℃ 培养箱培养。待细胞融合至80%时,正常组、模型组每瓶加入正常血清0.5 mL、培养基2 mL,银杏叶组每瓶加入银杏叶5.2 mg/kg含药血清0.5 mL、培养基2 mL,活血通络利水方低、高剂量组每瓶分别加入活血通络利水方20、40 g/kg含药血清0.5 mL、培养基2 mL。除正常组外,其余4组均加入GLU 25 mmol/L。各组置于培养箱中继续培养24 h后,弃去培养液,加入裂解液充分裂解细胞成匀浆,4 ℃条件下13 300 r/min离心15 min,收集上清蛋白液,即为总蛋白提取物。BCA法测定蛋白浓度,每孔25 μg蛋白上样,10%SDS-PAGE电泳,转至PVDF膜。5%脱脂奶粉封闭液室温封闭1 h,分别孵育GLAST、GS抗体(1∶1 000)4 ℃反应过夜,孵育二抗HRP-羊抗兔IgG(1∶5 000)室温反应1 h,采用ECL试剂盒显影蛋白质。同一张膜使用TBST溶液清洗,加入蛋白印迹膜再生液,室温震荡30 min,TBST溶液清洗,5%脱脂奶粉封闭液室温封闭1 h,之后孵育内参β-actin抗体(1∶5 000),孵育二抗,显影。扫描图像并应用Image J软件分析蛋白条带的灰度值,目的蛋白条带灰度值/内参蛋白条带灰度值为半定量蛋白表达结果。
1.2.4 高效液相色谱(HPLC)法检测GLU含量 Müller细胞设为4组,即模型组、银杏叶组、活血通络利水方低剂量组和活血通络利水方高剂量组,各组设立8个复孔。细胞以 5×105个/mL 密度接种于6孔板,每孔加入2 mL DMEM培养基,静置于5% CO2、37℃培养箱培养。待细胞融合至80%时,模型组每孔加入大鼠正常血清0.5 mL、培养基2 mL,银杏叶组每孔加入银杏叶5.2 mg/kg含药血清0.5 mL、培养基2 mL,活血通络利水方低、高剂量组每孔分别加入活血通络利水方20、40 g/kg含药血清0.5 mL、培养基2 mL,各组均加入GLU 25 mmol/L。各组置于培养箱中继续培养24 h后收集细胞上清液,用色谱级甲醇沉淀蛋白,过滤待测。采用HPLC法测定GLU浓度,色谱柱为大连依利特分析仪器有限公司SinoChrom-BP C18柱(4.6 mm×250 mm,5 μm),流动相为乙腈:磷酸盐缓冲液(0.02 mol/L,pH 6.0),16∶84(V/V),流速为1 mL/min,检测波长为472 nm,柱温20 ℃,进样容积20 μL。将 10 mmol/L GLU 标准品溶液用超纯水稀释成 12.5、25、50、100、250、500、1 000、2 500 μmol/L对照品溶液,设置正常培养液为阴性对照,各对照品溶液和待测样品按前述色谱条件进样,经 HPLC-紫外光谱(UV)检测后得到各组色谱峰面积值。以各对照品组的GLU浓度为横坐标,谱峰面积值为纵坐标,进行线性回归,得到浓度-色谱峰面积值相关的标准曲线方程,再根据各样品组的色谱峰面积值计算得出各样品组的 GLU 浓度。

2 结 果
2.1 不同浓度GLU对Müller细胞存活率的影响 见表1。
由表1可见,GLU(0、0.1、0.5、1、10、20、25、30 mmol/L)处理24 h后,与0 mmol/L GLU浓度比较,0.1、0.5、1、10 mmol/L GLU浓度下Müller细胞存活率升高(P<0.05),20、25、30 mmol/L GLU浓度下Müller细胞存活率逐渐降低(P<0.05)。结果表明,10 mmol/L及以下低浓度GLU促进Müller细胞活性;20、25、30 mmol/L GLU抑制Müller细胞活性,造成细胞损伤,抑制作用随GLU浓度的升高而增强。GLU浓度为25 mmol/L时,Müller细胞存活率与0 mmol/L浓度下细胞存活率相比约为0.67,说明该浓度GLU可以引起细胞毒性损伤并且大部分细胞尚存活,因此后续实验选择25 mmol/L GLU干预Müller细胞以建立GLU损伤细胞模型。
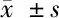

GLU浓度(mmol/L)n24 h存活率051.00±0.030.151.57±0.02∗0.551.47±0.05∗151.30±0.05∗1051.08±0.03∗2050.88±0.03∗2550.67±0.02∗3050.35±0.03∗
与0 mmol/L GLU浓度比较,*P<0.05
2.2 各组含药血清在高浓度GLU环境下对Müller细胞GLAST、GS蛋白表达的影响 见表2、图1。
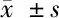
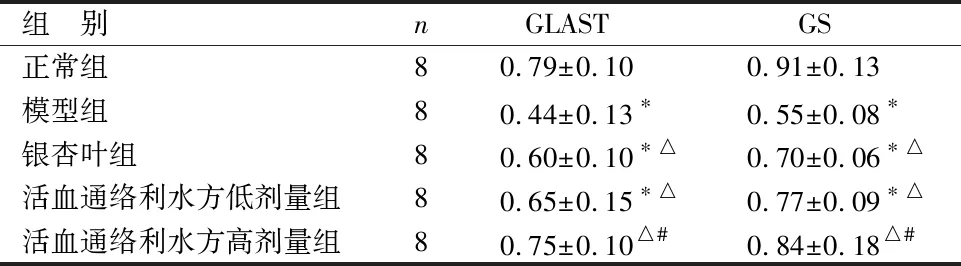
组 别nGLASTGS正常组80.79±0.100.91±0.13模型组80.44±0.13∗0.55±0.08∗银杏叶组80.60±0.10∗△0.70±0.06∗△活血通络利水方低剂量组80.65±0.15∗△0.77±0.09∗△活血通络利水方高剂量组80.75±0.10△#0.84±0.18△#
与正常组比较,*P<0.05;与模型组比较,△P<0.05;与银杏叶组比较,#P<0.05
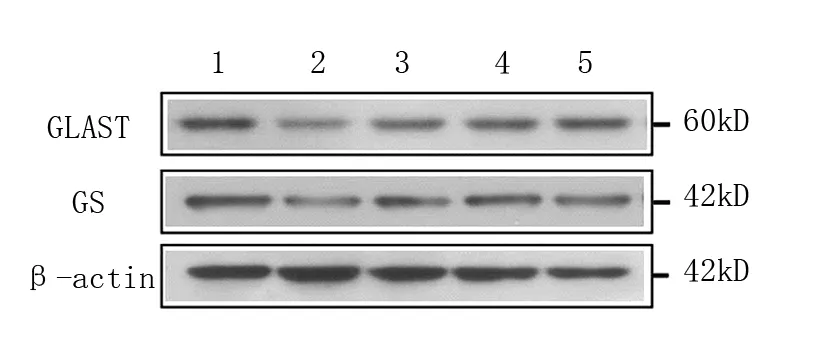
注:1为正常组;2为模型组;3为银杏叶组;4为活血通络利水方低剂量组;5为活血通络利水方高剂量组
图1 各组含药血清在高浓度GLU环境下对Müller细胞GLAST、GS蛋白表达的影响
由表2、图1可见,与正常组比较,模型组、银杏叶组、活血通络利水方低剂量组Müller细胞GLAST、GS蛋白表达水平降低(P<0.05),而活血通络利水方高剂量组与正常组比较差异无统计学意义(P>0.05);与模型组比较,银杏叶组和活血通络利水方低、高剂量组Müller细胞GLAST、GS蛋白表达升高(P<0.05);与银杏叶组比较,活血通络利水方高剂量组Müller细胞GLAST、GS蛋白表达升高(P<0.05)。活血通络利水方低、高剂量组组间Müller细胞GLAST、GS蛋白表达比较差异无统计学意义(P>0.05)。
2.3 各组含药血清对Müller细胞胞外GLU含量的影响 见图2、表3。
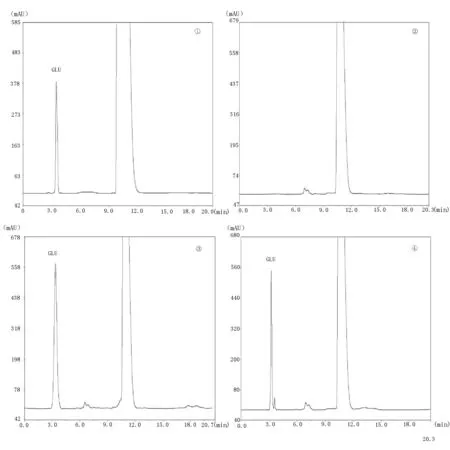
①为GLU对照品溶液;②为正常培养液;③为银杏叶含药血清培养液;④为活血通络利水方含药血清培养液
图2 各组含药血清HPLC色谱图
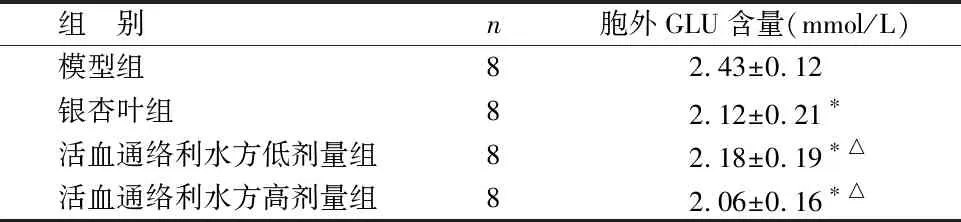
组 别n胞外GLU含量(mmol/L)模型组82.43±0.12银杏叶组82.12±0.21∗活血通络利水方低剂量组82.18±0.19∗△活血通络利水方高剂量组82.06±0.16∗△
与模型组比较,*P<0.05;与银杏叶组比较,△P>0.05
由图2可见,各组样品中GLU的分离度良好,各组培养液中的内源性物质及其他杂质峰不干扰GLU的测定,专属性理想。
由表3可见,与模型组比较,银杏叶组和活血通络利水方低、高剂量组Müller细胞胞外GLU含量降低(P<0.05),即细胞对GLU的摄取能力增强;与银杏叶组比较,活血通络利水方低、高剂量组胞外GLU含量比较差异无统计学意义(P>0.05)。活血通络利水方低、高剂量组组间Müller细胞胞外GLU含量比较差异无统计学意义(P>0.05)。
3 讨 论
缺血性眼病累及视网膜和视神经时,往往影响患者视力,严重者甚至视力丧失。现代医学认为,缺血性视网膜病变的重要原因之一为高浓度GLU对RGC的神经毒性损伤[6]。GLU是中枢神经系统中含量最多、十分重要的兴奋性氨基酸,在视网膜内亦作为主要神经递质介导信息传递,其主要聚集、贮存在光感受器、双极细胞和RGC,冲动传导时经突触短暂释放。Müller细胞作为视网膜最主要的神经胶质细胞,包绕并接触视网膜各级神经元,参与神经递质代谢[7]。正常状况下,Müller细胞通过GLU转运体GLAST摄取突触间隙多余的GLU,经GS作用转化为无神经毒性的谷氨酰胺,再释放到胞外由神经细胞摄入继续转化为GLU释放到突触间隙,即为GLU循环[8]。视网膜缺血、缺氧时,GLU被大量释放,突触间隙的GLU不能被及时清除而浓度升高,过度刺激其受体,引起细胞内Ca2+超载,启动级联反应,导致神经细胞代谢衰竭而损伤死亡,进一步加重缺血、缺氧损伤,形成恶性循环,最终影响视功能[6]。由此可见,调节Müller细胞保护RGC免受高浓度GLU神经毒性损伤具有重要意义,而这一过程中GLAST、GS的作用十分重要。
张铭连教授在中医学络病理论的基础上结合多年临床诊治经验,提出了“目络学说”,强调目络是眼部运行气血、贯通荣卫的枢纽和要道[9]。若目络受邪,则气行不畅,血行滞涩,产生瘀血、痰湿,相互搏结酿生毒邪,损伤目络,虚、瘀、毒、水4种病理因素互相影响,形成恶性循环,终致目络瘀阻,发为缺血性眼病[10]。现代医学已证实的视网膜高浓度GLU对RGC的神经毒性损伤,正是毒邪蕴结、损伤目络的体现之一。张教授在该学说的指导下,基于清代王清任的补阳还五汤以及临床实践,创立了活血通络利水方,临证加减组方治疗缺血性眼病疗效显著[2-3]。活血通络利水方以活血化瘀、益气通络为治则,方中黄芪为补气之要药,大补元气以助血运行,祛瘀通络;当归尾补血,协同行血;川芎、丹参、赤芍活血行滞,以复气机;葛根、石菖蒲轻扬升发,宣气通窍;郁金行气解郁,凉血祛瘀;桃仁、红花活血破瘀;水蛭破血祛瘀。全方养血与活血药同用,补气与通络药并使,相得益彰[11]。高血压、动脉粥样硬化、血管痉挛或血栓阻塞等均为缺血性眼病的重要病因[12]。现代药理研究表明,黄芪可以调控血管平滑肌细胞,扩张血管,调整血压,控制血流,并且改善血液流变学和微循环,增强毛细血管功能,延缓动脉硬化,抑制血小板聚集[13]。川芎所含川芎嗪、阿魏酸具有促进血管舒张、抑制血栓形成的作用[14];丹参能调节血脂代谢,降低血液黏稠度,延缓动脉粥样硬化的发生[15];葛根的主要有效成分葛根素能降低血糖,改善血管功能,增加局部血液灌注[16]。
相关研究证明,活血通络利水方能保护兔视网膜缺血—再灌注损伤,减轻视网膜水肿,其机制可能与减轻视网膜氧化应激损伤和炎性反应、改善Müller细胞水液代谢、抑制血-视网膜屏障通透性升高有关[17-18]。Müller细胞作为视网膜主要的神经胶质细胞,不仅参与维持视网膜水液稳态,亦维持视网膜正常GLU代谢,保护视功能。因此,对Müller细胞GLU代谢功能的测定能够进一步探究活血通络利水方的作用机制。在实验研究中,通过检测Müller细胞GLAST、GS蛋白表达水平和细胞外GLU含量,进而评价Müller细胞GLU代谢功能[19-20]。本研究通过体外培养Müller细胞,观察活血通络利水方含药血清低、高剂量组在高GLU环境下对Müller细胞GLAST、GS蛋白表达和胞外GLU含量的影响,以探究活血通络利水方对Müller细胞GLU代谢功能的调节作用。
观察结果表明,活血通络利水方能够有效促进高GLU环境下Müller细胞GLAST、GS蛋白表达和活性。10 mmol/L 及以下低浓度 GLU 促进Müller细胞活性;20、25、30 mmol/L GLU 抑制 Müller 细胞活性,造成细胞损伤,抑制作用随 GLU 浓度升高而增强;且 GLU 浓度为 25 mmol/L 时,引起细胞毒性损伤的同时大部分细胞尚存活,成功建立 GLU 损伤细胞模型。与正常组比较,模型组Müller细胞GLAST、GS蛋白表达水平降低(P<0.05),说明高浓度GLU抑制Müller细胞GLAST、GS蛋白表达;与模型组比较,银杏叶组和活血通络利水方低、高剂量组Müller细胞GLAST、GS蛋白表达升高(P<0.05),并且细胞外GLU含量均降低(P<0.05),说明药物干预能够挽救Müller细胞GLAST、GS蛋白表达和活性,促进Müller细胞代谢GLU。其中,活血通络利水方高剂量组的调节作用更为明显,该组Müller细胞GLAST、GS蛋白表达水平与银杏叶组比较差异有统计学意义(P<0.05),与正常组和活血通络利水方低剂量组比较差异均无统计学意义(P>0.05),说明活血通络利水方高剂量组对Müller细胞GLAST、GS蛋白表达的上调作用更强,可以恢复到正常水平,优于银杏叶组。然而,活血通络利水方高剂量组胞外GLU含量较低剂量组和银杏叶组均降低,但比较差异无统计学意义(P>0.05),说明活血通络药物干预能够恢复 Müller 细胞 GLAST、GS 蛋白活性,但不同剂量组组间比较差异无统计学意义。综上所述,本研究证实了活血通络利水方含药血清能够对高GLU环境下Müller细胞GLAST、GS蛋白表达和活性发挥正向调节作用,进而调节GLU代谢平衡,进一步丰富了活血通络利水方治疗缺血性眼病的作用机制研究。

