基于光微热量-荧光光谱联用技术研究光催化热力学和动力学的温度效应
覃方红,万婷,邱江源,*,王一惠,肖碧源,黄在银,3,*
1广西民族大学化学化工学院,南宁 530008
2湖北省地质局第六地质大队,湖北 孝感 432000
3广西高校食品安全与药物分析化学重点实验室,南宁 530008
1 引言
光催化技术因具有低温深度反应、净化彻底、绿色环保、氧化性和普适性强等优点而被广泛关注,已在解决环境问题和应对能源危机中发挥巨大的作用1-3。尽管光催化材料的开发已经取得了很大的发展,但其催化机理和催化理论的研究相对滞后。一般认为和大多数光反应一样,由于有光子活化,光催化系统不需要加热,光催化反应对温度的变化不敏感4,因此温度对光催化的影响并不被大家关注。但是温度对反应体系依然具有影响,例如,Meng等5考察了反应温度对刚果红在g-C3N4、TiO2和ZnO三种典型催化剂上的光催化降解效果,发现温度对三种催化剂的光催化活性有积极的影响,讨论温度对不同催化剂上载流子的复合速率和转移势垒的影响,发现光催化降解污染物是涉及到自由基对染料分子的催化氧化过程。同时,由于光催化是一个复杂的多步过程6,温度不仅影响载流子的分离、转移和复合,对后续的光化学反应也有影响,因为随着光照时间的增加,反应温度会升高7。Zhang等8研究发现,光辅助分解的速率与温度成正比。温度对光催化反应速率的影响具有两重性:(1)升温有利于半导体表面的氧化还原反应的进行;(2)升温不利于底物和氧在催化剂表面的吸附,而且温度升高溶解氧浓度会降低9。因此研究反应温度在整个光催化反应过程中的作用机制具有重要意义。
光催化过程的热力学和动力学10-13为反应条件的优化以及反应机理的推测提供科学依据。目前,对光催化机理14,15的研究多借助电子顺磁共振技术16、自由基俘获技术17或理论计算18确定载流子的迁移与转运,但单一的原位技术难以直接提供过程的热力学信息,缺失光催化体系热量变化的热力学信息以及未进行光催化动力学理论的讨论等,导致光催化的热力学、动力学及机理的研究仍不深入。光量热法19无疑提供了研究光化学反应原位过程的新科学方法,该方法实时、无损伤且直观地获取其热力学精细信息。本组自主设计的“光-微热量-荧光光谱联用系统”10,20-24,主要由光量热仪和405 nm的激光诱导荧光光谱仪两部分组成。通过光纤将单色光引入微量热计的样品池和参比池中;在两池周围加载热电堆,分别定量地监测两池产生的微量热效应与均温块之间的热交换,再将样品池和均温块之间的温差信号转换成电信号,放大并记录在计算机中;同时样品池中的另一个平行光纤,将来自光催化的光诱导荧光传送到光纤光谱仪。提供了一种耦合热信息和光谱信息认识光驱动过程的微观机制的原位联用技术,为光热光谱学的建立提供科学的技术支撑。
本文通过光微量热-荧光光谱联用系统研究不同温度下,g-C3N4@Ag@Ag3PO4复合催化剂光催化降解罗丹明B (RhB)的热力学和动力学。这种光量热-荧光光谱联用系统由微热量计和荧光光谱构成,将反应的原位过程、降解速率与原位热力学关联,并用于论证Z-type g-C3N4@Ag@Ag3PO4光催化后续阶段是一个拟零级反应。利用该联用系统同步获取了的g-C3N4@Ag@Ag3PO4在283.15 K、288.15 K、293.15 K、298.15 K和303.15 K的光催化降解罗丹明B的非特异性的热谱曲线和特异性的原位荧光光谱曲线;通过计算,得到了不同反应阶段的热变速率以及反应200-1200 s的反应速率系数,并讨论了温度对上述热力学、动力学参数的影响规律。
2 实验部分
2.1 试剂
尿素(≥ 99%)、硝酸银(≥ 99%)、罗丹明B(≥ 96%)、葡糖糖(≥ 99%)、磷酸二氢钠(≥ 99%)、九水合硝酸铁(≥ 98.5%),均为分析纯,购于上海国药有限公司,使用前未进一步纯化。
2.2 仪器
场发射扫描电子显微镜(SEM)采用德国卡尔蔡司公司生产的SUPRA 55 Sapphire;X射线衍射仪(XRD)采用日本理学株式会社生产的MiniFlex 600;X射线光电子能谱(XPS)为美国赛默飞的VG ESCALAB MKII;微量热仪为绵阳中物热分析仪器公司生产的RD496型号;海洋荧光光谱仪为广州标旗有限公司生产的USB4000-FL。
2.3 样品的制备
取10 g尿素于马弗炉中在氮气保护下550 °C煅烧4 h,得到淡黄色粉末g-C3N4;取2.04 g AgNO3溶于150 mL去离子水中超声溶解,加入120 mg的g-C3N4在暗室中搅拌1 h,再加入10 mL 3 mol·L−1葡萄糖溶液后,置于60 °C水浴中反应2 h,得到g-C3N4@Ag;配制一定量的九水合硝酸铁与磷酸二氢钠混合溶液,加入上述g-C3N4@Ag粉末,反应3 h后,离心、洗涤、烘干即得g-g-C3N4@Ag@Ag3PO4。
2.4 光催化实验
光量热实验前,通过测定KCl在去离子水中的溶解焓对微量热仪进行校准(仪器结构示意图以及具体校准实验步骤见参考文献23)。准确配制1 mg·mL−1g-C3N4@Ag@Ag3PO4和50 mg·L−1罗丹明B的混合溶液,并在室温暗室中搅拌1 h,再取0.5 mL于联用系统的样品池中,同时在参比池加入0.5 mL水,设置温度参数,待基线稳定开启光源(波长405 nm、光强20 W·m−2)光照2 h。
3 结果与讨论
3.1 基本表征
图1分别为g-C3N4、g-C3N4@Ag、g-C3N4@Ag@Ag3PO4的场发射扫描电镜图,由图知g-C3N4为不规则的薄层片状结构,形状类似于银耳;g-C3N4@Ag的光泽更加明亮,这是Ag纳米颗粒附着在g-C3N4纳米片上;在g-C3N4@Ag@Ag3PO4中可以看到有少许白色Ag3PO4沉积在g-C3N4表面上。
图2是g-C3N4@Ag@Ag3PO4的XRD图,其中θ为13.0°和27.5°分别对应g-C3N4的(100)和(002)晶面(PDF标准卡片JCPDS 87-1526),38.1°是Ag的(111)晶面[PDF标准卡片JCPDS 04-0783],33.2°和42.9°分别为Ag3PO4的(210)和(220)晶面[PDF标准卡片JCPDS 06-0505]。
图3为g-C3N4@Ag@Ag3PO4的XPS图,其中Ag 3d中369.6 eV和375.7 eV分别是金属Ag(0)的3d5/2和Ag 3d3/2的结合能23,25,表明存在Ag单质,因此表明合成样品为g-C3N4@Ag@Ag3PO4纳米复合材料。

图1 样品的SEM图Fig. 1 The SEM images of samples.

图 2 g-C3N4、g-C3N4@Ag、g-C3N4@Ag@Ag3PO4的X衍射粉末衍射图Fig. 2 The XRD pattern of g-C3N4, g-C3N4@Ag and g-C3N4@Ag@Ag3PO4.

图3 g-C3N4@Ag@Ag3PO4的X射线光电子能谱Fig. 3 The XPS spectra of g-C3N4@Ag@Ag3PO4.Inset: Ag 3d.
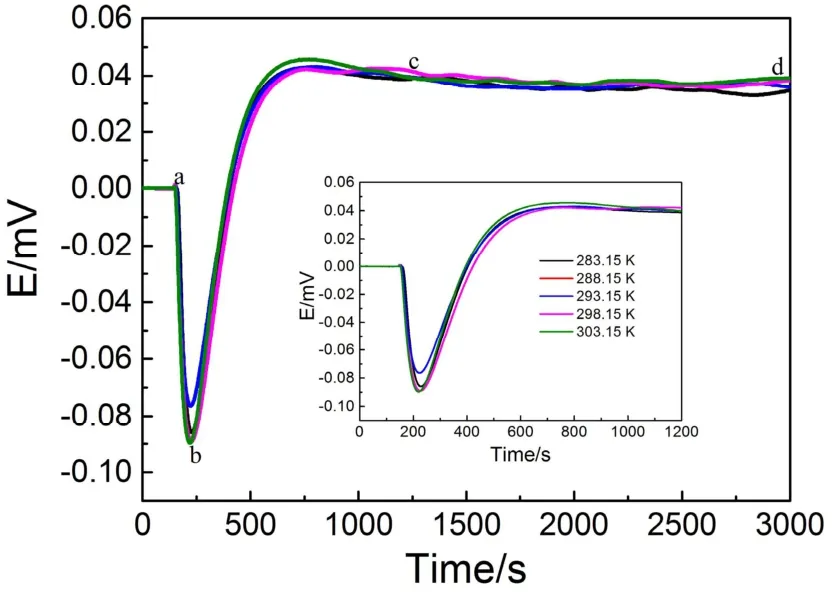
图4 光催化降解热变化曲线Fig. 4 Heat changes curves vs time (s) of photocatalysis.
3.2 光催化降解罗丹明B的原位热力学和动力学研究
图4为光降解原位热电势变化曲线,由图可知,不同温度下光催化g-C3N4@Ag@Ag3PO4催化降解罗丹明B过程均经历了三个阶段:(i) 快速吸热阶段,这是因为催化剂以及罗丹明B分子对光的吸收;(ii) 吸热和放热竞争阶段,这是活性自由基催化降解罗丹明B分子的反应吸热与(i)阶段放热阶段的平衡过程;(iii) 稳定的放热阶段,该过程主要是光催化降解罗丹明B分子和中间产物的放热,由于被激活的催化剂粒子数基本恒定,单位时间产生的高活性强氧化性基团的数目也趋于恒定,因此单位时间的降解放热速率恒定。温度对原位热电势未呈现明显的递变规律,可能的原因是催化剂以及罗丹明B分子光反应过程相对复杂。
根据本组期的工作可知10,20-24,光催化的降解速率与反应的热变速率(dQt/dt)是直接相关的,它们的关系式为:

式中,ΔQt是时间t时的反应热,ΔQtheor0是理论上光催化完全降解罗丹明B的反应热。
光催化降解罗丹明B的热功率与热电势关系为:

式中,Pt是时间t时的热功率,Et是时间t时的热电势(由实验数据直接获得),S为光量热仪的仪器常数(本文中,S= 66.85 ± 0.56 μV·mW−1)。
根据焦耳定律Q=W=P×t及以上各式,热变速率dQt/dt可表示为:
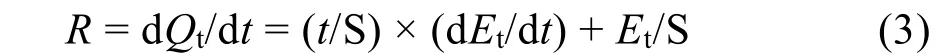

图5 光催化降解的热变速率Fig. 5 The heat flow curves of photocatalysis.
由以上各式及原位热电势变化数据,获得不同温度下光催化降解罗丹明B的热变速率曲线(图5)。
由图5知,光催化热变速率的递变趋势与热电势曲线的特征变化一致,均经历了以下过程:(1)g-C3N4@Ag@Ag3PO4光催化剂的光响应吸热(ab);(2)光降解RhB分子放热与光响应吸热的平衡(bc);(3)光降解RhB分子的稳定放热平台(cd)。图5中的插图是g-C3N4@Ag@Ag3PO4光催化的热变速率平台,该平台放热速率恒定,是一个拟零级反应过程。在283.15 K、288.15 K、293.15 K、298.15 K、303.15 K下的放热速率分别为0.4668 ± 0.3875 μJ·s−1、0.5314 ± 0.3379 μJ·s−1、0.5064 ± 0.3234 μJ·s−1、0.5328 ± 0.3377 μJ·s−1、0.5762 ± 0.3452 μJ·s−1,该体系内不同温度下放热速率差别不大,可能的原因是热谱信息检测为整个体系总体能量的变化,当体系内反应的反应速率随温度的影响不大时,则热变速率不明显。在本实验中反应到达c点后,由于无搅拌,催化剂体系处于沉降平衡,因此在405 nm激光稳定光源照射下,被激活的催化剂数目恒定,单位时间内产生的活性自由基趋于恒定,这决定了cd阶段的放热过程符合拟零级反应动力学。不同反应阶段的整体热效应及cd段稳定平台的热变速率值见表1。

表1 光催化不同阶段的热效应和cd阶段稳定的热变速率(R)Table 1 Heat changes of different stages and the stable exothermic rate (R) of cd.

图6 298.15 K下光催化降解的原位三维荧光降解曲线Fig. 6 The curve of fluorescence intensity vs wavelength (nm) vs time (s) image of photocatalytic degradation at 298.15 K.

图7 光催化降解RhB 在586 nm处荧光强度-时间谱图Fig. 7 The plots of intensity vs time detected by in situ fluorescence spectra at 586 nm of photocatalytic degradation of RhB.
图6是298.15 K的原位荧光强度随波长与时间变化的三维图谱,由图知罗丹明B的最大特征荧光发射峰波长位于586 nm处。
图7是与热量信息同步的光催化降解罗丹明B过程的586 nm波长处荧光强度随时间变化图,由图知光照初期(0-200 s),随着光照时间的延长,罗丹明B的特征荧光发射峰强度骤减,光照1200 s后,荧光发射峰强度基本不再变化。根据Lambert-Beer定律,反应物浓度可由对应的荧光强度变化求得,进而求算出了g-C3N4@Ag@Ag3PO4光催化降解效率,在283.15 K、288.15 K、293.15 K、298.15K、303.15K下的降解效率分别为67.37%、74.71%、74.49%、77.06%、86.64%,则随着温度的升高光催化降解效率增大。
由于光谱信息检测的为体系内罗丹明B的脱色反应,且光催化反应伊始体系不稳定,涉及的反应过程很多,比较复杂;而热谱曲线表明1200 s后进入稳定放热平台,因此选择bc阶段(200-1200 s)内的荧光降解数据进行一级动力学方程26拟合:

其中,C0为反应物起始浓度,C为t时刻反应物浓度,t为反应时间,k为反应速率系数。获得5个温度下的反应速率系数k,则由Arrhenius经验式中的定积分式26:

式中,Ea为光催化反应体系的活化能,R为摩尔气体常数,数值为8.314 J·mol−1·K−1。分别求出排列组合个不同温度区间的活化能,算出平均值为23.82 kJ·mol−1。不同温度下的反应速率系数kbc以及活化能的平均值列于表2。

表2 不同温度下200-1200 s时的动力学参数Table 2 Dynamic data of 200-1200 s at different temperatures.
由表2发现反应时间于200-1200 s,反应温度为283.15-303.15 K条件下,光催化降解罗丹明B的动力学过程的速率系数随着温度的升高而增大,但均在同一数量级,主要原因有:反应速率随温度的升高而增大,则对温度更敏感;当罗丹明B浓度降低到一定浓度时,中间产物仍与罗丹明B分子发生光催化降解竞争反应,温度升高增加了活化分子数加快了反应速率,但温度升高不利于催化剂表面的罗丹明B分子的吸附,单位时间内吸附-脱附的频率高,不利于降解的发生,则反应速率增大不明显。
4 结论
利用光微量热-荧光光谱联用系统,获取了高效光催化复合材料g-C3N4@Ag@Ag3PO4在283.15 K、288.15 K、293.15 K、298.15 K和303.15 K五个温度下,催化罗丹明B降解的原位热力学和动力学精细信息,并研究了温度对光催化过程的热动力学及动力学参数的影响。结果表明:(1)催化降解反应分为三个阶段:(i)污染物和催化剂的光响应过程,(ii)光响应吸热和污染物降解放热的竞争过程,(iii)保持稳定的放热率;(2)原位热流曲线及荧光曲线结果表明,光催化动力学过程包括一级及拟零级动力学过程:(i)由热谱信息知,反应在cd阶段符合拟零级反应特征,但不同温度下放热速率差别不大。(ii)由原位荧光光谱信息知,反应在吸热和放热竞争阶段符合一级动力学特征,且速率系数随温度的升高而增大。通过热谱与光谱技术联用,研究了光催化过程的原位热力学、动力学,有望解决与光相互作用的化学、生物、物理、材料及生物医学等领域各种体系变化过程的热力学、热动力学、光谱动力学及分子水平的过程机理,实现原位多尺度过程的深入而充分表征。

