豆粕影响日本鳗鲡黑仔鳗饲料中发酵豆粕对鱼粉的替代效果:生长、抗氧化能力以及生化指标
李宁宇,刘利平,华雪铭,李 向,姚静婷,吴 盟
(1.农业农村部鱼类营养与环境生态研究中心,上海海洋大学,上海 201306;2.农业农村部淡水水产种质资源重点实验室,上海海洋大学,上海 201306;3.水产科学国家级实验教学示范中心,上海海洋大学,上海 201306)
日本鳗鲡(Anguilla japonica)是一种富含蛋白质和脂肪的优良食用鱼类,其味道鲜美、营养丰富,具有一定的药用功能,自古以来都是我国民间珍贵的滋补食物,被视为“水中人参”。日本鳗鲡仔鱼期的饵料是其存活和变态的关键[1],但可供参考的相关营养饲料学资料非常有限,严重阻碍了日本鳗鲡养殖业的发展。鱼粉一直以来是鳗鲡饲料中不可或缺的优质蛋白源[2],但国内鱼粉资源有限,高度依赖进口。随着世界范围内水产品消费量的增加,水产养殖业对鱼粉的需求量急剧上升,鱼粉价格一直居高不下并成为饲料行业可持续发展的瓶颈[3]。因此减少对鱼粉的依赖是日本鳗鲡仔鱼期饲料研发需要重点关注的问题之一。
豆粕蛋白含量较高,是较为理想的蛋白源[4]。已有的应用研究表明,在不同水产动物间,虽然豆粕替代鱼粉的最适量存在较大差异,但普遍呈现水产动物的生长随豆粕用量增大而下降的趋势[5-8]。蛋氨酸含量不足和抗营养因子含量较高是限制豆粕利用的主要原因,饲料中氨基酸不平衡对水产动物产生的负面效果与饲料中豆粕对鱼粉的替代量成正比[9]。豆粕中的抗营养因子易导致水产动物肠胃炎症,从而影响其生长和生理功能[10]。有研究表明,利用微生物发酵法对原料豆粕进行发酵能更加有效地利用豆粕,减少其负面效果。发酵过程产生的丰富酶类可把大分子量的大豆蛋白高效转化为大豆肽,与具有相同氨基酸组成的大豆蛋白相比,大豆肽表现出许多特有的生化特性和优势[11]。在条石鲷(Oplegnathus fasciatus)[12]、 杂 交 罗 非 鱼(Oreochromis nilolicus×O.aureus)[13]、鲤(Cyprinus carpio)[14]等多种水产动物的研究中发现,饲料中用发酵豆粕分别替代60%、34.2%和100%的鱼粉并不会显著影响实验动物的生长和存活;适量添加发酵豆粕还有助于改善水产动物的消化生理特性,如饲料中添加20%发酵豆粕使黑鲷(Acanthopagrus schlegelii)肠指状绒毛高度增加、数量增多,绒毛间隙变小,肠绒毛弯曲度增加[15]。也有研究发现,相比只使用发酵豆粕的饲料,在含有15%发酵豆粕的饲料中辅以15.45%的豆粕会促进罗氏沼虾(Macrobrachium rosenbergii)的生长[16]。
豆粕发酵后营养特性发生明显改变,其成本也显著高于普通豆粕,因此配方中发酵豆粕和普通豆粕的配比将直接影响饲料质量、价格以及水产动物的生长和健康,但相关研究对此鲜有报道。鉴于此,本文以日本鳗鲡黑仔鳗为研究对象,研究发酵豆粕替代部分鱼粉对其生长性能、血清和肝脏的抗氧化能力以及生化指标的影响,并在此基础上探讨豆粕在不同发酵豆粕替代水平下可能发挥的作用,旨在为日本鳗鲡黑仔鳗饲料中鱼粉、发酵豆粕和豆粕的合理使用提供理论依据,为后续研究的开展提供参考。
1 材料与方法
1.1 饲料配方及制作
参考日本鳗鲡黑仔鳗营养需求(SC/T 1004-2010),设计5组实验饲料。根据发酵豆粕的用量,分别将各组定义为对照组T0(60%鱼粉+5%豆粕)、试验组分别为T10(53%鱼粉+5%豆粕+10%发酵豆粕)、T20(47%鱼粉+5%豆粕+20%发酵豆粕)、T14.5(53%鱼粉 +14.5%发酵豆粕)、T24.5(47%鱼粉 +24.5%发酵豆粕)。将饲料原料充分粉碎,过100目筛网,按照各种饲料原料的质量由小到大逐级混匀,随后密封、干燥,并在避光、低温条件保存。另制备分别添加100 mg·kg-1稀土元素作为外源指示剂的5组饲料,用于表观消化率的测定。每次投喂前根据饲料配方添加鱼油,重复2次过100目筛,加入少量水(饲料∶水 =1∶0.7),将饲料制作成面团状后投喂。饲料配方及成分分析见表1。
1.2 饲养管理
本实验在上海海洋大学滨海基地进行。实验前对水泥池进行消毒处理,使用漂白粉浸泡后用水枪冲洗干净。实验所用日本鳗鲡由长江口捕捞而得,在上海海洋大学实验室循环水系统中用摇蚊幼虫将日本鳗鲡玻璃鳗暂养至黑仔鳗时期,再转至本次实验所在的滨海基地进行为期2周的适应,期间使用对照组饲料投喂。之后挑选外观正常、机体健康以及规格大小相近的实验鱼(0.405±0.003)g放入网箱中。按饲料分成 5组,每组3重复,在水泥池中架设共15个网箱(长 ×宽×高 =1 m×1 m×1.5 m),每网箱投放25尾实验鱼。分组后继续使用对照组饲料暂养1周,待日本鳗鲡生理状况趋于稳定后,正式开始实验。日投喂量为体质量的5%~10%,视摄食情况酌情调整,每日早晚各投喂一次(6∶00、18∶00),每次各占总投喂量的50%。实验周期为76 d,养殖水体24 h充气,水温25~30℃,水溶氧≥6 mg·L-1,氨氮含量≤0.3 mg·L-1。养殖期间不定期吸污换水,始终保持养殖水体清澈干净,每日记录摄食情况及死亡率。
1.3 样品采集
养殖实验结束前5周改用投喂含有稀土元素指示剂的饲料,适应1周后开始收集粪便样本持续4周。每次投喂饲料0.5 h后收集残饵,投喂2 h后采用虹吸法收集新鲜粪便,冷冻干燥至恒重后得到粪便样本,放置于室温条件下的干燥器中保存。
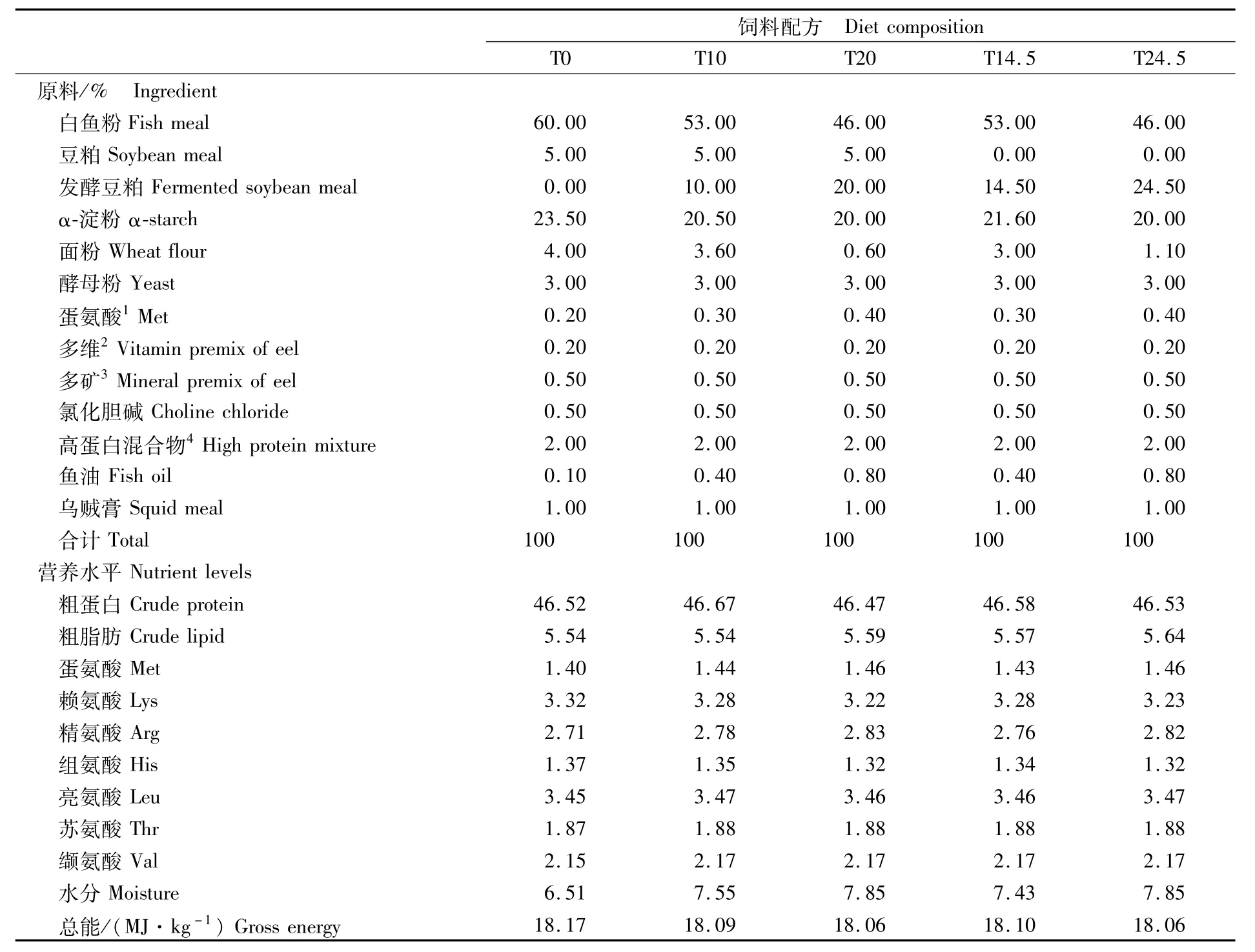
表1 饲料配方及营养水平Tab.1 Com position and nutrient levels of diets (air dry basis,%)
养殖实验结束后,实验鱼饥饿24 h。随后逐个网箱对实验鱼称总重、计数。从每个实验网箱内随机取13尾鱼,用丁香酚麻醉后,分别量体长、称质量;取3尾鱼获取肌肉样品,用于常规营养组成(水分、蛋白、脂肪和灰分)分析;取7尾鱼采用断尾的方式获取全血并置于1.5 mL的无菌离心管中,随后在4℃下静置6 h,3 500 r·min-1离心15 min,取上清液即得血清;取3尾鱼的肝脏,同血清用于抗氧化和生化指标的测定。所有样品均放置在无RNA酶、无菌的离心管中,并暂时保存于液氮中,随后转入-20℃的冰箱中保存以待后续分析测定。
1.4 样品测定与分析
1.4.1 生长性能测定
成活率(survival rate,SR,%)=实验结束时鱼尾数/实验初始时鱼尾数×100
增重率(weight gain rate,WGR,%)=(终末平均体质量-初始平均体质量)/初始平均体质量×100
特定生长率(specific growth rate,SGR,%·d-1)=(ln终末平均体质量-ln初始平均体质量)×100/实验周期
准确称取0.100 0 g已恒重的饲料或粪便置于坩埚中,碳化灰化后,加入混合酸(浓硝酸∶高氯酸=10∶3),加热消解至澄清透明,冷却至室温,用超纯水定容到100 mL容量瓶中。经过0.22μm滤膜过滤后放入进样瓶中。使用ICPMS 7700型电感耦合等离子体质谱仪(安捷伦,美国)对样品中稀土元素进行定量测定,根据以下计算公式得出各饲料组的表观消化率:
表观消化率(apparent digestibility,AD,%)=(1-饲料中稀土元素的含量/粪便中稀土元素的含量)×100。
1.4.2 肌肉常规成分
肌肉常规检测:粗灰分(crude ash,CA)在550℃马弗炉中(GB/T 6438-2007)测定,粗蛋白质(crude protein,CP)采用全自动凯氏定氮仪(GB/T 6432-94)测定,粗脂肪(crude lipid,CL)采用氯仿甲醇法测定,水分(moisture,M)采用(GB/T 6435-2014)方法在105℃条件下烘干测定。
1.4.3 血清及肝脏抗氧化及生化指标
将血清和冰浴匀浆后的肝脏匀浆液(1∶10,w/v)分别稀释至适宜浓度后,使用南京建成生物工程研究所提供的试剂盒测定总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、总抗氧化能力(T-AOC)、谷丙转氨酶(AST)、谷草转氨酶(ALT)、白蛋白(ALB)、总蛋白(TP)、甘油三酯(TG)、总胆固醇(TC)、碱性磷酸酶(AKP)以及肝脏蛋白含量等抗氧化及生化指标。
1.5 数据处理和统计分析
实验结果用平均数±标准差(Mean±SD)表示,所有数据使用SPSS 17.0分析软件中的单因素方差分析(One-Way ANOVA)和Duncan氏法多重比较进行差异显著性分析,其中P<0.05为差异显著。
2 结果与分析
2.1 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗生长性能的影响
由表2可知,除T14.5组外,其余4组之间存活率无显著性差异(P>0.05);豆粕5%含量不变的条件下,在T0、T10、T20 3组中,随着发酵豆粕用量的增加,存活率、特定生长率、增重率、表观消化率均呈现逐渐升高的趋势;豆粕被发酵豆粕替代后,在T10组与T14.5组、T20组与T24.5组的比较中,T10组的特定生长率、增重率以及存活率均显著高于 T14.5组(P<0.05),表观消化率无显著性差异(P>0.05);T20组的特定生长率、增重率、存活率以及表观消化率与T24.5组无显著性差异(P>0.05)。
2.2 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗肌肉营养成分的影响
由表3可知,在 T0、T10、T20 3组中,肌肉粗蛋白含量随着发酵豆粕用量的增加呈先降后增的趋势,且3个组间差异显著(P<0.05);肌肉粗脂肪的趋势则相反。在T10组与T14.5组、T20组与T24.5组的比较中,T10组粗蛋白含量显著低于 T14.5组(P<0.05),T20组粗蛋白含量显著高于 T24.5组(P<0.05),粗脂肪结果均与粗蛋白相反。各组水分均显著低于对照组(P<0.05),粗灰分除 T24.5组外各组与对照组相比无显著性差异(P>0.05)。

表2 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗生长性能的影响Tab.2 Effects of replacement of FM and SBM by FSBM on the grow th performance of Anguilla japonica black fry
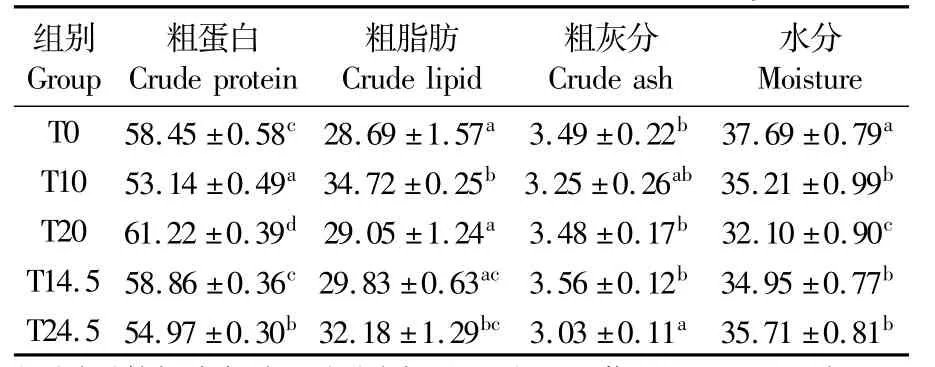
表3 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗肌肉营养成分的影响Tab.3 Effects of rep lacement of FM and SBM by FSBM on muscle nutritional components of Anguilla japonica black fry(%dry basis)
2.3 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗血清抗氧化能力和生化指标的影响
如表4所示,总超氧化物歧化酶(T-SOD)除T10组外均与对照组差异显著(P<0.05),在T0、T10、T20 3组间随着发酵豆粕用量的增加呈现先降低升高的趋势;T10组显著低于T14.5组(P<0.05),T20组显著高于 T24.5组(P<0.05)。丙二醛(MDA)含量各组均显著低于对照组(P<0.05),在 T0、T10、T20 3组中随着发酵豆粕用量的增加呈先降低后升高的趋势;T10组显著小于T14.5组(P<0.05),T20组显著高于 T24.5组(P<0.05)。总抗氧化能力(T-AOC)除 T14.5组外均显著高于对照组(P<0.05),在 T0、T10、T20 3组中随着发酵豆粕用量的增加呈逐渐上升的趋势;T10组显著高于 T14.5(P<0.05),T20组与T24.5差异不显著(P>0.05)。
血清生化指标见表5,在T0、T10、T20 3组间随着发酵豆粕用量的增加,白蛋白(ALB)、甘油三酯(TG)、碱性磷酸酶(AKP)、总胆固醇(TC)呈现逐渐增加的趋势,谷草转氨酶(AST)、总蛋白(TP)呈现先增加后减少的趋势,谷丙转氨酶(ALT)呈现逐渐降低的趋势;在T10与T14.5两组间,T10组 TP、AKP、AST、GLB、AKP显著高于T14.5组(P<0.05),T10组白球比(A/G)显著低于 T14.5组(P<0.05),其余各项指标差异不显著(P>0.05);在 T20与 T24.5两组间,T20组TP、TC、TG、ALB、GLB、AKP、A/G显著高于 T24.5组(P<0.05),ALT和 AST两组间差异不显著(P>0.05)。
2.4 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗肝脏抗氧化能力和生化指标的影响
肝脏抗氧化指标见表6。4个试验组的肝脏T-SOD、T-AOC、CAT活性显著高于对照组(P<0.05),MDA含量各组均低于对照组。在 T0、T10、T20 3组间,随着发酵豆粕用量的升高,TSOD、T-AOC和CAT的活性呈现逐渐增加的趋势,MDA呈现减少的趋势。在T10与T14.5两组之间,T10组 T-SOD、T-AOC、CAT活性显著低于T14.5组(P<0.05);在 T20与 T24.5两组之间,T20组 T-SOD、T-AOC、CAT活性显著低于 T24.5组(P<0.05);MDA在 T10组显著低于 T14.5组(P<0.05),T20组与 T24.5组无显著差异(P>0.05)。
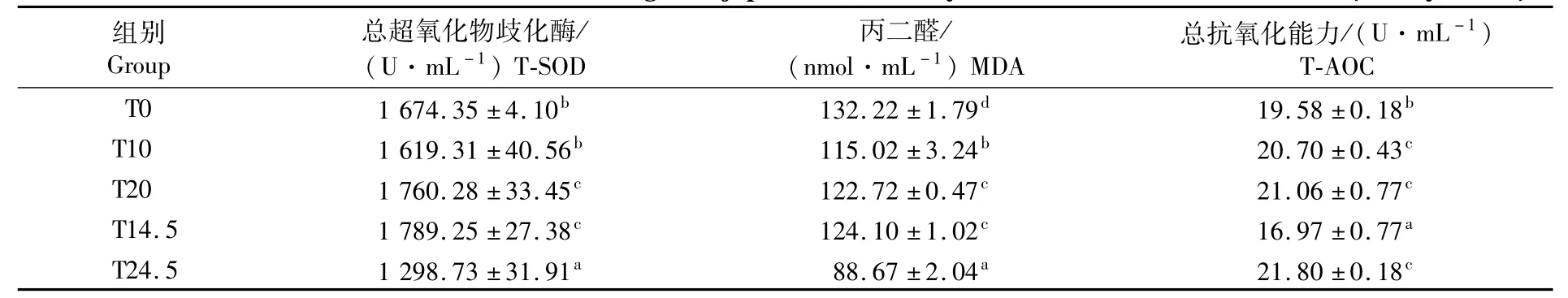
表4 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗血清抗氧化指标的影响Tab.4 Effects of replacement of FM and SBM by FSBM on antioxidant indices in serum of Anguilla japonica black fry (%dry basis)
肝脏生化指标见表7。在 T0、T10、T20 3组间,随着发酵豆粕用量的增加,ALT、AST呈现先减少后增加的趋势,TG呈现逐渐减少的趋势,AKP呈现逐渐增高的趋势。在T10与T14.5两组间,T10组的ALT和TG均显著小于T14.5组(P<0.05),AKP显著大于 T14.5组(P<0.05),AST两组间差异不显著(P>0.05);在 T20与T24.5两组间,T20组 AST显著小于 T24.5组(P<0.05),AKP、ALT显著大于 T24.5组(P<0.05),TG两组间差异不显著(P>0.05)。
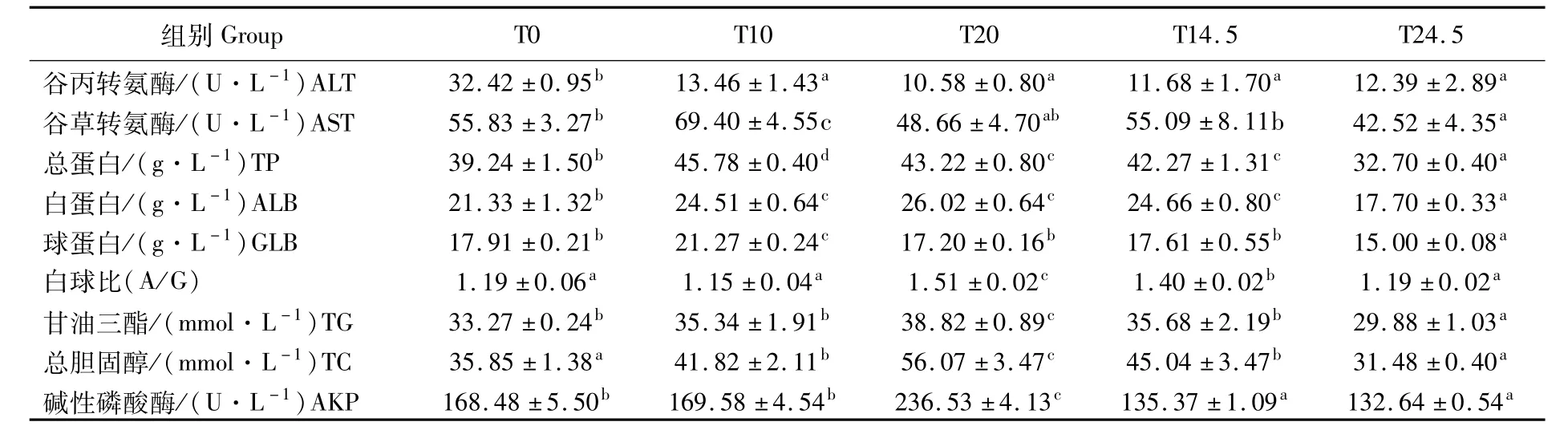
表5 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗血清生化指标的影响Tab.5 Effects of rep lacement of FM and SBM by FSBM on serum biochem ical indices of Anguilla japonica black fry

表6 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗肝脏抗氧化指标的影响Tab.6 Effects of replacement of FM and SBM by FSBM on antioxidant indices in liver of Anguilla japonica black fry

表7 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗肝脏生化指标的影响Tab.7 Effects of rep lacem ent of FM and SBM by FSBM on biochem ical indices in liver of Anguilla japonica black fry
3 讨论
3.1 发酵豆粕替代鱼粉和豆粕对日本鳗鲡生长性能的影响
研究发现,随着饲料中发酵豆粕含量的增加,斑点叉尾鮰(Ietalurus punetaus)[17]、罗氏沼虾[18]、点带石斑鱼(Epinephelus coioides)[19]的生长性能均呈现先升高后降低的趋势,但最适宜用量存在显著的种间差异,分别为2.5%、8%和7%。多数资料显示水产动物对发酵豆粕的耐受性大都在15%以下,当超过此含量时,水产动物的生长性能会有一定程度的下降。而在本实验中,随着发酵豆粕替代鱼粉比例的增加,日本鳗鲡的存活率、增重率、特定生长率以及表观消化率均呈现上升趋势。斑点叉尾鮰[17]的表观消化率也随着发酵豆粕用量的增加而上升,由此推测发酵豆粕有促进日本鳗鲡黑仔鳗肠道吸收的效果。当发酵豆粕用量到达20%时,日本鳗鲡黑仔鳗的各项生长性能都优于其他试验组,可见其对发酵豆粕表现出较高的耐受性。肝、肠、胃等消化酶活性的显著降低与鳗鲡的缓慢生长关系密切[20],在本实验中高用量的发酵豆粕中存在的消化酶可能在一定程度上改善了鳗鲡的生长性能[21]。
有关水产饲料中豆粕替代鱼粉的研究发现,随着豆粕含量的升高,水产动物的生长性能逐渐下降[22-24]。究其原因,是因为豆粕中含有大量的抗营养因子以及限制性氨基酸不足等对水产动物肠道健康产生了负面影响[25-29]。但也有学者发现,在水产动物饲料中添加少量豆粕反而会促进罗氏沼虾的生长[16],本研究中T10组的生长性能显著优于T14.5组、T20组略微优于T 24.5组的结果与其相似。单宁和凝结素作为两种常见的抗营养因子,其单独存在时,会对胰淀粉酶活性产生抑制作用,但二者同时存在时,抑制作用消失[30]。IWASHITA等[31]的研究中也发现,饲料中只添加大豆皂苷会对虹鳟(Oncorhynchus mykiss)肠道产生有害影响,但同时添加大豆皂苷和大豆凝集素时,有害作用便减弱,这说明大豆皂苷和大豆凝集素的联合效应会对虹鳟的肠道形态产生有益影响。由此推测,饲料中一定量的豆粕与发酵豆粕混合使用时所产生的抗营养因子联合效应可能对鳗鲡产生了积极的效应,但产生联合效应的适宜混合比例及其作用机制仍需进一步研究。
3.2 发酵豆粕替代鱼粉和豆粕对日本鳗鲡肌肉营养成分的影响
程成荣和刘永坚[13]研究发现,发酵豆粕部分代替鱼粉对杂交罗非鱼中粗灰分和粗脂肪的含量无显著影响;冷向军等[32]发现,发酵豆粕用量不影响凡纳滨对虾(Litopenaeus vannamei)肌肉中的水分和粗蛋白质含量。然而冯建等[33]对大黄鱼(Pseudosciaena crocea)的研究发现,随着发酵豆粕用量的上升,粗灰分含量呈现上升的趋势。李程琼等[34]发现,发酵豆粕用量为16%和21%时,对日本鳗鲡肌肉中的粗蛋白含量和粗灰分含量的影响不同。上述结果说明发酵豆粕对肌肉成分的影响因水产动物种类而异。本研究中随着饲料中发酵豆粕含量的升高,日本鳗鲡黑仔鳗肌肉粗蛋白、粗灰分与粗脂肪含量也呈现不同的变化。但目前对于发酵豆粕和鱼粉用量影响肌肉营养成分的机制尚不清楚。有研究表明,日本鳗鲡口感主要来自其高脂肪[35]。在本研究中,发酵豆粕的用量为10%时,日本鳗鲡肌肉中的粗脂肪含量显著升高,说明T10组饲料有改善日本鳗鲡黑仔鳗口感的潜质,但其中的机理仍待进一步的研究。
对奥尼罗非鱼(O.niloticus×O.aureus)[22]、牙 鲆 (Paralichthys olivaceus)[23]和 军 曹 鱼(Rachycentron canadum)[36]等研究发现,随着豆粕使用量的增加,肌肉粗蛋白含量逐渐下降,本实验中鱼粉用量由60%下降到53%时T10组与T14.5两组间的对比结果与其一致;但当鱼粉下降到46%时,豆粕的使用(T20组与T24.5组)反而使肌肉粗蛋白含量上升,粗脂肪的结果则相反。上述结果表明,鱼粉与发酵豆粕的配比在一定程度上决定着豆粕对肌肉蛋白质含量的影响,但是否因为在日本鳗鲡黑仔鳗体内产生不同的联合效应,从而在一定程度上影响其生长和生理,并最终在体成分上表现出一定的差异,还有待进一步研究。
3.3 发酵豆粕替代鱼粉和豆粕对日本鳗鲡黑仔鳗血清和肝脏抗氧化能力的影响
与其他水产动物相似,日本鳗鲡机体中也存在氧自由基(OFR)的动态平衡[37-39]。总超氧化物歧化酶(T-SOD)和过氧化氢酶(CAT)在清除氧自由基的稳态系统中发挥着重要的作用。T-SOD可以将O2-化为H2O2和O2,H2O2进而被CAT分解成H2O和丙二醛(MDA)是脂质过氧化后的负面产物,对机体损害严重[41];而总抗氧化能力(T-AOC)是衡量鱼体抗氧化能力的综合指标[42]。在本研究中,比较 T0、T10和 T20 3组发现,发酵豆粕用量增加显著提升了肝脏中TSOD、CAT、T-AOC的水平,降低了MDA的水平,这与刘韬等[43]在凡纳滨对虾中的研究结果一致,说明发酵豆粕可在一定程度上增强日本鳗鲡黑仔鳗肝脏的抗氧化能力;本次实验中,血清T-SOD活性和MDA含量变化也显示出发酵豆粕增强机体抗氧化能力的作用。与T10组相比,T14.5组无论是肝脏还是血清过氧化程度和T-SOD均高于T10组,可能是过高的MDA水平激发了机体清除氧自由基系统的负反馈调节所致。由此可见,当鱼粉用量由60%下降到53%时,10%的发酵豆粕搭配5%的豆粕饲料配比较14.5%的发酵豆粕配比能更显著地提升日本鳗鲡黑仔鳗的抗氧化能力。而T24.5组血清MDA含量显著低于T20组、肝脏T-AOC显著高于T20组,说明当鱼粉用量下降到46%时,不含5%的豆粕可能更有利提升日本鳗鲡黑仔鳗的抗氧化能力。
3.4 发酵豆粕替代鱼粉和豆粕对日本鳗鲡血清和肝脏生化指标的影响
碱性磷酸酶(AKP)可分解磷酸酯使磷酸盐等物质沉积于鱼骨之中,促进水产动物骨骼生长[44-45]。鱼类与高等脊椎动物相似,体内均存在磷的稳态机制[46]。当水产动物血磷含量不足时,AKP便会大量合成并释放进入血液。在T0、T10、T20 3组中,随着发酵豆粕替代量的升高AKP呈现逐渐升高的趋势,推测可能是发酵豆粕降低了日本鳗鲡黑仔鳗的血磷浓度或对磷的利用率,由此激发负反馈调节机制以维持体内磷稳态;在T10组与 T14.5组、T20组与 T24.5组的比较中发现,含有5%豆粕组的肝脏和血清中AKP均显著高于不含5%豆粕组。结合生长指标认为,T10组相比生长缓慢的T14.5组更需要高水平的AKP持续分解产生无机矿物质来供应其骨骼生长;而T20组和T24.5组,生长虽无显著差异,但前者的AKP活性远高于后者,或预示T20组有良好的生长潜力。
甘油三酯(TG)和总胆固醇(TC)是血清脂类的重要组成,均能反映机体脂类代谢的程度。血清中TG主要来源于营养物质消化吸收与糖元和脂肪酸的转化。当血清TG在一定范围内增高时,说明机体脂类代谢增强。胆固醇构成细胞膜的重要成分,当水产动物胆固醇缺失时,细胞容易破裂。卵磷脂胆固醇脂酰基转移酶(lecithincholesterolacyltransferase,LCAT)是在肝脏催化生成血清胆固醇的重要酶类,可催化生成血清中70%~80%的胆固醇,当血清中胆固醇含量降低时,表示LCAT在肝脏中代谢受阻,且往往伴随着血清转氨酶的升高,故血清胆固醇可作为水产动物肝功能代谢的重要指标。在人类等高等动物中,脂类代谢能力较强,TG和TC变化趋势往往一致[47-48];对水产动物而言,由于脂类代谢能力较弱,机体的TC含量比TG更易受饲料脂肪水平影响,两者的变化趋势往往不一致[49]。但在本实验中,血清中的TG和TC含量随发酵豆粕用量增加均呈现逐渐升高的趋势,由此推测日本鳗鲡黑仔鳗具有较强的脂类代谢能力,当鱼粉用量由60%下降到46%时,5%的豆粕有助于机体维持较高的脂肪代谢水平,其中的机理有待进一步挖掘。
谷丙转氨酶(ALT)和谷草转氨酶(AST)是水产动物机体中参与氨基酸代谢的重要酶类,在健康情况下血清中含量较低,主要存在于肝脏中。当肝功能出现损伤时,ALT和AST可由肝脏释放进入血液,使得血清中两者的酶活性出现显著升高,因此可作为反映肝功能的重要指标[50]。血液中的总蛋白(TP)由肝脏合成,包括白蛋白(ALB)和球蛋白(GLB),TP含量升高可以作为水产动物肝脏合成蛋白质能力增强的表现。ALB参与维持水产动物血液中的渗透压并能以胶体的形式对球蛋白起到保护的作用,其含量与有功能的肝脏细胞数量成正比[51]。GLB由浆细胞分泌,其含量增加有利于提高机体的抗病力;ALB与GLB的比值,即白球比(A/G)也能够反映机体的抵抗力,该值的降低说明体内有更多的球蛋白合成用于提高机体免疫机能[52]。T0、T10和 T20 3组间血清中的ALT呈下降的趋势,说明发酵豆粕替代鱼粉有助于减少日本鳗鲡肝脏受损伤的风险;同样,AST分析结果认为,无论在10%还是20%发酵豆粕用量下,搭配5%豆粕比不含有豆粕更能体现保护肝脏的作用[16]。本实验中TP、ALB和GLB含量在T0、T10和T20之间的比较,说明用发酵豆粕替代鱼粉可以不同程度地增强肝功能及蛋白质合成能力,结合转氨酶结果认为在此过程中谷丙转氨酶发挥了重要作用;同不含豆粕的试验组相比,含有5%豆粕提高了血清中的TP以及GLB含量,说明搭配5%豆粕有利于提高日本鳗鲡黑仔鳗的蛋白质合成能力及免疫能力,降低肝脏受损伤的风险,这在T24.5组表现的尤为明显。
4 小结
在本实验中,饲料中用发酵豆粕替代鱼粉可以提高日本鳗鲡黑仔鳗的生长性能、抗氧化能力以及肝功能,且最佳用量为20%。豆粕影响发酵豆粕对鱼粉的替代效果,但效果因发酵豆粕用量而异:用10%的发酵豆粕替代豆粕时,搭配5%的豆粕可以取得较好的生长、抗氧化和保肝效果;用20%的发酵豆粕替代鱼粉时,搭配5%的豆粕能降低肝脏受损的风险,不含5%豆粕则更有利于肝脏的抗氧化能力。

