激光联合全蝎软膏治疗增生性瘢痕疗效评价
王景 张海丽


[摘要]目的:观察并探讨激光联合全蝎软膏对兔耳早期增生性瘢痕的治疗效果。方法:将16只新西兰大白兔随机分为空白对照组、模型组、全蝎软膏组和联合组,每组4只;建模后立即对全蝎软膏组和联合组患处进行药物涂抹或激光照射治疗,对照组和模型组用PBS处理;于治疗后的第50d取各组动物皮肤织进行病理、酶联免疫法(ELISA)、荧光定量PCR和Smad 4蛋白检测。结果:与空白对照组相比,模型组兔耳术后形成增生性瘢痕,联合组和全蝎软膏组经治疗后无瘢痕出现;HE染色结果显示,经激光联合全蝎软膏治疗后组织纤维化程度明显减轻;ELISA和荧光定量PCR检测结果表明,联合组与模型组相比,I型胶原蛋白(Col I)、Ⅲ型胶原蛋白(Col Ⅲ)、肿瘤坏死因子α(TNF-α)及MMP的表达量均显著降低(P<0.05);Western blot结果证实了激光联合全蝎软膏治疗后可显著抑制组织内Smad 4蛋白的表达(P<0.05),从而调控TGF-β细胞通路而抑制增生性瘢痕的形成。结论:本研究证实了激光联合全蝎软膏具有治疗HTS的作用,并为临床上治疗HTS提供新途径。
[关键词]全蝎软膏;半导体激光;增生性瘢痕;早期治疗;Smad 4蛋白;TGF-β通路
Abstract: Objective To observe and explore the therapeutic effect of laser combined with scorpion ointment on early hypertrophic scar in rabbit ears. Methods The sixteen New Zealand white rabbits were randomly divided into blank control group, model group, scorpion ointment group and combined group. After modeling, the patients in the treatment group were immediately treated with drug smear or laser irradiation, while those in the control and model groups were treated with PBS. On the fiftieth day after treatment, the skin tissues of each group were taken for pathological examination, enzyme-linked immunosorbent assay (ELISA), fluorescence quantitative PCR and Smad 4 protein detection. Results Compared with the control group, hypertrophic scar was formed in the model group after ear surgery, and no scar appeared in the laser combined with scorpion ointment group after treatment. The results of HE staining showed that the degree of tissue fibrosis was significantly reduced after laser combined with scorpion ointment treatment. The results of ELISA and quantitative fluorescence PCR showed that the expressions of Col I, Col Ⅲ, TNF-a and MMP in the combined treatment group were significantly lower than those in the model group (P<0.05). The western blot results confirmed that laser combined with scorpion ointment could significantly inhibit the expression of Smad 4 protein in tissues (P<0.05), thereby regulating the TGF-β cell pathway and inhibiting the formation of hypertrophic scars. Conclusion This study confirms that laser combined with scorpion ointment can be used to treat HTS, and provides a new way for clinical treatment of HTS.
Key words: scorpion ointment; semiconductor saser; hypertrophic scar; preemptive therapy; smad 4 Protein; TGF-β pathway
增生性瘢痕(Hypertrophic scar,HTS)是臨床上较为常见的病理性皮肤疾病,其形成的主要原因是组织在自我修复过程中成纤维细胞(Fibroblast,FB)过度增殖,同时以大量的胶原蛋白在细胞外基质(extracellular matrix,ECM)内沉积而最终导致高于正常皮肤组织的增生性瘢痕形成[1-3]。传统医学认为,增生性瘢痕发病的主要原因为“气滞血瘀,余毒未尽”,此外,HTS的形成亦与气虚、血虚和痰湿等个体体质因素相关[4-5]。目前,临床上防治HTS的手段众多,主要包括手术切除、压迫疗法、冷冻、放化疗及药物注射等,以及两种或两种以上联用的综合疗法,但因HTS具体的形成机制尚未明确,致使治疗效果均不理想,仍存在复发率较高、诊疗费用高等问题[6-7]。我国传统医学倡导在HTS创伤形成和愈合的早期即采取治疗措施,以“治未病”为指导思想,选择疗效好、副作用小、费用低,兼以活血化瘀,清除余毒的中药制剂[8]。半导体激光因具有较强的组织修复、强力镇痛、无副作用、无创伤及消炎、消水肿等功效,已在痤疮、湿疹皮肤病等疾病辅助治疗中取得了良好的应用效果[9]。此外,全蝎软膏因其具有抗菌消炎、止痛止痒、活血化瘀及疏经通络之功效,被认为是继丹参、积雪苷霜、三七总甙等又一可用于临床治疗HTS的潜在用药,并已成功作为如下肢静脉溃疡、糖尿病足和干燥性鼻炎等疾病的治疗手段之一[10-12]。本研究通过建立兔耳增生性瘢痕模型,对半导体激光联合全蝎软膏治疗HTS的效果进行综合评价,以期为临床治疗早期HTS疾病提供新的指导方向。
1 材料
1.1 药品及主要试剂:全蝎软膏为黑龙江中医药大学附属二院院内制剂;苏木精-伊红染色液、PBS磷酸盐缓冲液,购自Sigma-Aldrich(上海)贸易有限公司;兔Ⅰ型胶原蛋白(ColⅠ)、兔Ⅲ型胶原蛋白(Col Ⅲ)酶联免疫试剂盒、兔肿瘤坏死因子α(TNF-α)试剂盒,均购自上海酶联生物科技有限公司;反转录试剂盒、SYBR qPCR Mix试剂盒,购自宝生物工程(大连)有限公司;兔抗人Smad4单克隆抗体、兔抗人GAPDH 单克隆抗体,购自武汉菲恩生物科技有限公司;HRP标记羊抗兔二抗,购自北京中杉金桥生物技术有限公司。
1.2 主要仪器:莱纳半导体激光治疗仪(LHH-500IVB)购自上海医康仪器有限公司;显微镜(DM 2 000)购自奥林巴斯株式会社;酶标仪(Multiskan FC)、低温离心机、电子天平、Western blot检测分析仪,购自赛默飞世尔科技(中国)有限公司;高压蒸汽灭菌器(MLS-3751L-PC),购自松下电器(中国)有限公司;涡旋混合仪器(XW-80A)、移液器等,购自德国Eppendorf公司;Real-time PCR仪(CFX96),购自伯乐生命医学产品(上海)有限公司;超微量分光光度计(K5 600),购自上海昂拉仪器有限公司。
1.3 实验动物:清洁级新西兰大白兔体重为2.5~3.5kg,共20只,购自辽宁长生生物技术有限公司。饲养于黑中医附属二院的实验动物中心,购入后调整性饲养1周,环境条件为(25±1)℃、湿度为55%~65%,饮食、进水均自由。
2 方法
2.1 兔耳增生性瘢痕模型的建立及治疗:将16只新西兰大白兔分随机分为四组:对照组(4只)、模型组(4只)、全蝎软膏组(4只)和联合组(半导体激光联合全蝎软膏组,4只),参考Uzun H等瘢痕建立方法[13]。除对照组外,分别用20% 乌拉坦剂量为5.0ml/kg耳缘静脉注射,对实验动物进行麻醉,兔耳部皮肤经75%酒精消毒后避开可见血管,在左右耳沿中线两侧分别作6个直径为8mm大小圆形皮肤缺损创面,用手术刀切除兔耳全层皮肤,刮除软骨膜,保留软骨,出血点压迫止血,每两个创面之间间隔1cm。术后按表1方案直接对患处进行相应的连续治疗50d,其中,激光治疗仪照射参数为:激光波长980nm,激光输出功率为2 800mW,能量密度为10mJ/cm2,记录兔耳瘢痕形态变化。
2.2 动物标本的采集:治疗50d后,无菌条件下切取各试验组兔耳瘢痕对应部位组织,一部分用10%的甲醛溶液进行固定,石蜡包埋后用于病理检测;另一部分储存于-20℃冰箱中备用,留作ColⅠ蛋白、ColⅢ蛋白及兔TNF-α的ELISA检测、荧光定量PCR和Smad4蛋白的Western blot检测。
2.3 HE染色:将固定和包埋的各实验组兔耳组织切成厚度约为5μm的组织切片,置于载玻片上65℃作用4h;按照苏木素-伊红染色液说明书所述,经苏木精染液2min、反蓝液作用3min、伊红染色液1min、梯度酒精脱水后风干、中性树胶封固,于显微镜下观察并拍摄。
2.4 瘢痕组织的ELISA检测:将对照组、模型组、全蝎软膏组和联合组的组织用PBS缓冲液(0.01M, pH=7.4)冲洗4次,弃残留液后晾干;将组织剪碎与一定体积的PBS置于玻璃匀浆器中,于低温下充分研磨,将匀浆于10 000×g离心3min取上清液,经测定浓度后备用。按照兔Ⅰ型胶原蛋白(ColⅠ)酶联免疫试剂盒、兔Ⅲ型胶原蛋白(Col Ⅲ)酶联免疫试剂盒、兔肿瘤坏死因子α(TNF-α)试剂盒内的说明书所述进行操作,分别设置标准孔和样本孔的ELISA检测,反应终止后在450nm波长处检测各孔的OD值并记录。
2.5 Real-time PCR检测:取各实验组组织约0.5g放入EP管中,按照RNA提取试剂盒说明书提取组织内RNA,取1μl提取液于蛋白分析仪测定含量及纯度;按照反转录试剂盒说明书所述配置总反应为10μL反轉录体系,置于PCR以上按37℃ 15min,98℃ 5min,4℃ 30min程序进行反转录,反应后将cDNA定量至100ng/?l。随后,配制体积为20μl的real-time PCR反应体系:SYBR qPCR Mix 10μl,上游/下游引物各 1μl,灭菌去离子水 7μl,cDNA 1μl;反应条件如下:95℃ 3min预变性,95℃ 10s、95℃ 5s、60℃ 30s,共40个循环并于60℃下充分延伸10min,real-time PCR引物见表2,反应结束后导出并整理数据。
2.6 Western blot检测:对上述提取的组织上清液以考马斯亮蓝法测定蛋白浓度,取20μl上清液经SDS-PAGE凝胶电泳作用后转至PVDF膜上;同时,设定甘油醛-3-磷酸脱氢酶(GAPDH)蛋白为内参分别经Smad单克隆抗体及1:2 000 HRP标记羊抗兔二抗孵育,经ECL发光显色条带并将结果使用Western blot图像系统处理分析。
2.7 统计学分析:统计学数据使用SPSS 17.0软件进行分析,以x?±s表示,采用单因素方差分析,以P<0.05表示差异有统计学意义。
3 结果
3.1 瘢痕模型的形态观察:在增生性瘢痕模型建立后立即对患处进行用药处理,并连续治疗50d。与模型组相比,联合组的治疗效果最为显著,可于治疗后的第35d观察到增生性瘢痕消失,且皮肤表面愈合速度较快;而全蝎软膏组经涂抹治疗后皮肤表面愈合速度较前者缓慢,经50d治疗后皮肤表面的瘢痕逐渐消失,见图1。
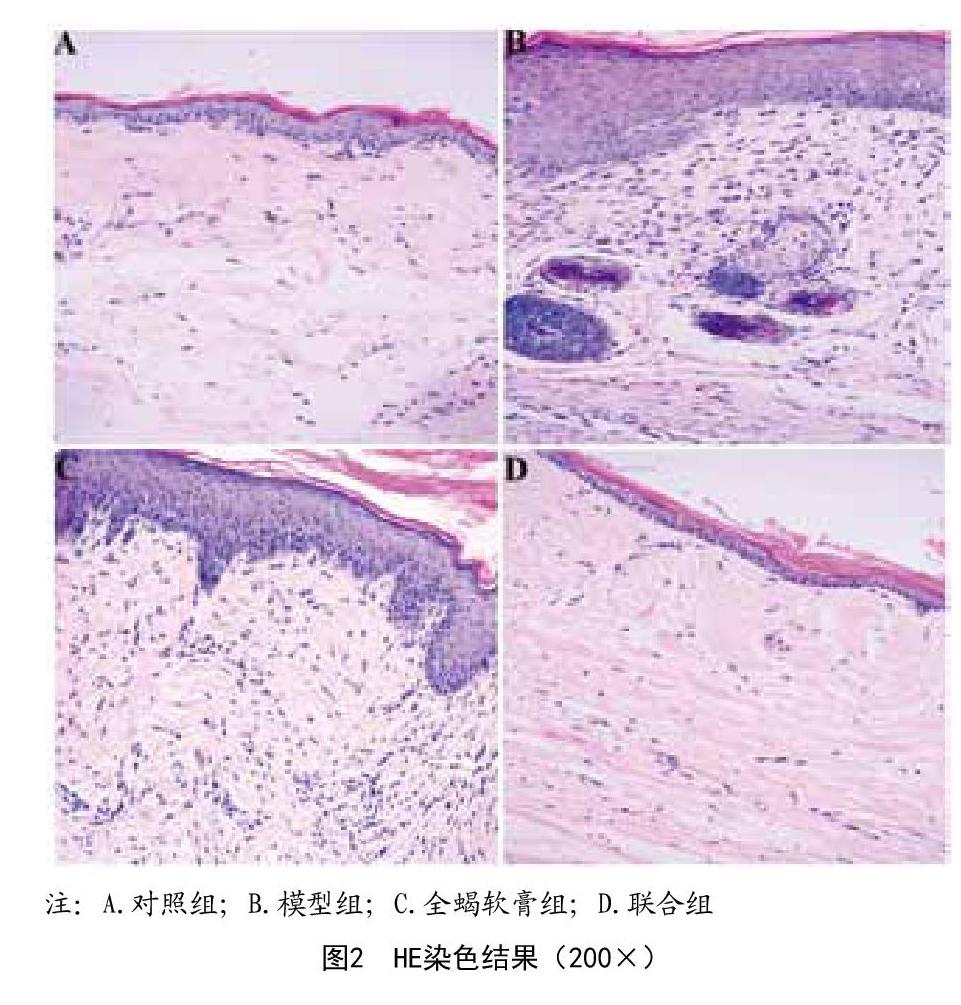
3.2 HE染色观察结果:HE染色结果显示,模型组在镜下观察可见增皮层增厚,大量成纤维细胞聚集、细胞外间质内胶原沉积,且毛细血管炎症细胞浸润;而激光联合全蝎软膏组观察可见,无血管炎症和炎性细胞出现,组织中成纤维细胞和胶原蛋白分布程度与空白对照组类似,而全蝎软膏组组织内则出现较轻的成纤维细胞聚集和少量胶原沉积,且血管增生较轻微,表明激光联合全蝎软膏可明显改善瘢痕组织病理结构,见图2。
3.3 瘢痕组织中胶原蛋白及肿瘤坏死因子检测结果:ELISA检测结果表明,模型组瘢痕组织中ColⅠ胶原蛋白、Col Ⅲ胶原蛋白及肿瘤坏死因子α(TNF-α)表达量均显著升高;而经全蝎软膏组和激光联合全蝎软膏组连续治疗50d后,ColⅠ蛋白、ColⅢ蛋白和TNF-α因子均有不同程度降低,联合组的治疗效果较单独使用全蝎软膏组的治疗效果显著,胶原蛋白和TNF-α的含量与对照组相接近,而全蝎软膏组内胶原蛋白和TNF-α的表达量高于对照组,表明激光联合全蝎软膏方法可以显著降低瘢痕组织中胶原蛋白和肿瘤坏死因子的表达水平(P<0.05),见图3。
3.4 Real-time PCR检测结果:Real-time PCR扩增结果如图4所示,与对照组和模型组相比,全蝎软膏组与联合组的组织内MMP含量均有不同程度的升高,其中联合组MMP上升最显著(P<0.05);而联合组中ColⅠ型胶原蛋白、ColⅢ型胶原蛋白的表达量与其他各组相比显著降低(P<0.05),表明全蝎软膏可以通过影响皮肤组织内的MMP大量合成,从而抑制成纤维细胞的过量表达,同时抑制胶原蛋白在细胞外间质内大量沉积以阻止增生性瘢痕的形成,见图4。
3.5 全蝎软膏对兔耳增生性瘢痕组织中Smad 4蛋白表达的影响:对连续治疗50d后的瘢痕组织进行Western blot检测,结果显示,未经治疗的模型组瘢痕组织中Smad 4蛋白量表达显著升高,而两个治疗组瘢痕组织中Smad 4蛋白水平较模型组均显著降低(P<0.05)。激光联合全蝎软膏治疗后的瘢痕组织中的Smad 4蛋白含量明显降低,而全蝎软膏组次之,提示激光联合全蝎软膏的方法可以显著抑制瘢痕生长并通过降低Smad 4蛋白的表达水平,从而影响TGF-β信号通路的转导,见图5。
4 讨论
增生性瘢痕多因“气滞血瘀,余毒未散”,寒邪长时间客于机体经脉之中,气血运行失常致使机体出现不同程度的气滞血凝现象,久之则形成瘢痕[14]。增生性瘢痕虽不危及生命,但会在不同程度上对患者的生活质量造成影响,如外表美观、肢体疼痛及瘙痒等,严重者甚至影响关节功能,因此,及时、合理、正确地治疗增生性瘢痕疾病对恢复患者的身心健康有着重要的积极意义。我国传统医学对增生性瘢痕的防治历史悠久,临床常见的治疗手段主要以中草药和针灸较为常见,如:丹参、三七、积雪草和川芎等,并已取得了良好治疗效果[4,15]。
目前,对于增生性瘢痕的发病机理尚未明确,选择疗效好、费用低、副作用小的中成药仍是治疗瘢痕性疾病的重要手段。已有许多学者报道并证实了积雪苷霜软膏因具有清热利湿和祛肿消炎等药效,能够对增生性瘢痕疾病起到抑制和治疗作用[16-17]。而本研究选取的全蝎软膏因含有独特的组份(全蝎、蜈蚣、冰片),使其具有清热解毒、活血化瘀、祛腐生肌及抑菌消炎等功效[18],被认为是用于治疗瘢痕疾病的潜在用药。因此,本研究通过建立兔耳增生性瘢痕病理模型,以激光疗法联合全蝎软膏對早期增生性瘢痕疾病进行观察研究。研究结果表明,单独使用全蝎软膏和激光联合全蝎软膏方法治疗均能够在不同程度上治疗增生性瘢痕,但激光辅助疗效更佳,HE染色和ELISA检测结果可见,激光联合全蝎软膏疗法可显著降低组织中成纤维细胞和胶原细胞(ColⅠ型、ColⅢ型)沉积,改善毛细血管内炎症细胞浸润,同时降低TNF-α因子的表达量,与模型组相比差异性显著(P<0.05)。这一研究结果表明全蝎软膏主要通过抑制成纤维细胞增殖、细胞外基质胶原蛋白沉积和降低TNF-α因子表达来抑制增生性瘢痕的形成。
随着对增生性瘢痕疾病的深入研究,已在分子和基因水平上证实了TGF-β-smads信号通路、PI3K/Akt通路和MAPK细胞外通路可参与瘢痕的形成[19],本研究选择的Smad 4蛋白是TGF-β受体下游信号蛋白。Western blot结果显示,经激光联合全蝎软膏治疗后的组织中Smad 4蛋白表达量较模型组显著降低(P<0.05),表明Smad 4蛋白作为TGF-β受体的下游信号蛋白,以正向反馈调节的形式阻断成纤维细胞内TGF-β信号通路传导,从而抑制增生性瘢痕的形成。此外,考虑到全蝎软膏自身的药物特性并兼顾达到治疗早期增生性瘢痕的目的,本研究在兔耳增生性瘢痕模型建立后直接以激光照射辅助全蝎软膏对患处进行治疗,经药物治疗35d后,患处皮肤及可恢复至术前水平,并无增生性瘢痕出现,证明了全蝎软膏作为一种副作用小、安全性好的中药制剂对早期瘢痕具有良好的治疗效果,值得在临床上应用和推广。
[参考文献]
[1]Heppt MV,Breuninger H,Reinholz M,et al.Current strategies in the treatment of scars and keloids[J].Facial Plast Surg,2015,31(4): 386-395.
[2]Zhang Z,Chen J,Huang J,et al.Experimental study of 5-fluorouracil encapsulated ethosomes combined with CO2 fractional laser to treat hypertrophic scar[J].Nanoscale Res Lett,2018,13(1):26.
[3]郭树忠.《现代瘢痕学》书评[J].中国美容医学,2009,18(2):236.
[4]杨明,柯友辉,柯晨,等.中医防治增生性瘢痕的基础研究进展[J].中国美容医学,2018,27(1):152-156.
[5]陈鹏辉,杨冰,马尚清,等.中医抑制增生性瘢痕的研究现状[J].北京中医药大学学报(中医临床版),2013,20(3):52-55.
[6]黄显翔,张伟,叶光荣,等.CO2点阵激光治疗增生性瘢痕的临床疗效及对TGF-β1表达的影响[J].中国美容医学,2018,17(8):108-111.
[7]Youh J,Kimdw,Yoon ES,et al.Comparison of four different lasers for acne scars: Resurfacing and fractional lasers[J].J Plast Reconstr Aesthet Surg,2016,69(4):e87-e95.
[8]陈明岭.中医药防治瘢痕疙瘩的现状及展望[J].中国医学文摘(皮肤科学), 2015,32(1):24-30.
[9]Poetschke J,Dornseifer U,Clementoni MT,et al.Ultrapulsed fractional ablative carbon dioxide laser treatment of hypertrophic burn scars: evaluation of an in-patient controlled,standardized treatment approach[J].Lasers Med Sci,2017,32(5):1031-1040.
[10]夏昆鹏,逄静,张淼,等.电针傍刺配合全蝎软膏治疗褥疮的临床观察[J].世界最新医学信息文摘,2018,18(55):163-164.
[11]王景,郭伟光,滕林,等.全蝎软膏配合湿润烧伤膏治疗糖尿病足32例[J].中国中医药现代远程教育,2014,12(17):33-34.
[12]王晶.全蝎软膏治疗下肢静脉性溃疡(湿热下注型)的临床观察[D].哈尔滨:黑龙江中医药大学,2017.
[13]Uzun H,Bitik O,Hekimoglu R,et al.Angiotensin-converting enzyme inhibitor enalapril reduces formation of hypertrophic scars in a rabbit ear wounding model[J].Plast Reconstr Surg,2013,132(3):361e-371e.
[14]张陶靓.点阵CO2激光联合积雪苷霜治疗兔耳增生性瘢痕的实验研究[D].南京:南京中医药大学,2013.
[15]刘伟源,许贤君,陈燕图.增生性瘢痕的生物学基础及药物应用的研究进展[J].中国美容医学,2018,27(8):151-154.
[16]彭琴,陈力.积雪草苷对增生性瘢痕作用机制研究进展[J].辽宁中医药大学学报,2014,25(3):237-239.
[17]江宇峰,伍超,吴佳俊,等.积雪苷霜软膏对兔耳增生性瘢痕组织中Smad4蛋白表达的影响[J].安徽医药,2015,19(5):834-837.
[18]唐欣莹.全蝎软膏治疗热毒蕴结型糖尿病足的临床观察[D].哈爾滨:黑龙江中医药大学,2016.
[19]史敏,李娜,郭晓波,等.miR-21调控PTEN/PI3K/Akt通路抑制增生性瘢痕形成的机制研究[J].中国美容医学,2019,28(3):92-95.
[收稿日期]2019-08-22
本文引用格式:王景,张海丽,滕林,等.激光联合全蝎软膏治疗增生性瘢痕疗效评价[J].中国美容医学,2020,29(6):27-31.

