硫酸盐对微生物催化石门雄黄尾矿土壤中砷溶解与释放的影响
吴薇薇,陈晓明,曾宪春
(中国地质大学(武汉)环境学院,湖北 武汉 430074)
砷(As)是一种高毒性的非金属元素,以有机或无机形式广泛分布于环境中。自然状态下砷有4种价态:-3、0、+3和+5[1]。砷污染的土壤和水中砷最主要是无机态的亚砷酸盐[As(Ⅲ)]和砷酸盐[As(Ⅴ)],其中亚砷酸盐比砷酸盐具有更强的流动性和毒性。砷化合物已被归为人类致癌物质,高剂量急性砷暴露可能会导致人发生严重的砷中毒甚至死亡,低剂量砷慢性接触可导致人的各种器官和组织产生癌变,也可导致出现角化过度、黄疸、神经病变、糖尿病、心血管疾病、中风、肺病、肝毒性和其他严重疾病[2-3]。据世界卫生组织(WHO)公布,对公共卫生最大的威胁来自受砷污染的地下水。通过作物灌溉和粮食生产中使用高砷地下水或直接饮用受砷污染的地下水使人类暴露于高浓度砷的环境中[3-4]。中国大约有1 960万人受到砷污染地下水的威胁[5]。许多研究表明,地下水中的砷在土壤、沉积物和岩石中主要以砷酸盐的形式存在[6]。
微生物在砷从不溶相中释放到地下水中起着关键的作用[5,7-9]。越来越多的证据表明,呼吸性砷还原菌(DARPs)是砷从不溶相中溶解和释放到地下水中的主要驱动力[10-11]。使用各种有机物,如乳酸盐、乙酸盐、甲酸盐和芳香化合物,或无机物,如硫化物和氢气,作为电子供体[12-14],DARPs可以在厌氧条件下将As(Ⅴ)转化为As(Ⅲ)。呼吸性砷还原酶是位于细胞周质中与细胞相连的砷代谢酶,这使得细菌可以从固相中还原As(Ⅴ),从而溶解与释放到地下水中。可见,从砷污染土壤、沉积物和尾矿中分离出的可培养的DARP,包括Desulfuromonassp.WB3[15],Bacilussp.M17-15[16]和Aeromonassp.JH155[8],能够直接还原吸附砷酸盐或矿物质,并显著增强不溶性砷的溶解与释放。但是,这些研究忽略了一个问题:环境因素如何影响微生物介导的土壤中砷从不溶相向地下水中释放。因此,本文从一处有砷污染历史的地区——湖南石门雄黄矿区采集尾矿土壤样品,利用厌氧操作技术、分子生物学技术等探究了硫酸盐如何影响微生物介导的尾矿土壤中砷的溶解与释放。
1 材料与方法
1.1 尾矿土壤样品采集与分析


图1 石门雄黄矿区尾矿土壤样品TIB的采样点Fig.1 Sampling site of the soil samples named as TIB in the Shimen Realgar Mine area
1.2 硫酸盐对呼吸性砷还原菌(DARPs)介导的尾矿土壤中砷和铁溶解与释放的影响试验
为了探究硫酸盐对砷释放的影响,将3.0 g尾矿土壤样品与10.0 mL无氧改良矿物盐培养基混合,补充10.0 mM乳酸盐和10.0 mM硫酸盐或不补充硫酸盐。将3.0 g尾矿土壤样品与相同的培养基混合而不添加乳酸盐和硫酸盐来制备对照,所有操作均在厌氧手套箱中进行。将所有混合物样品在30℃、厌氧条件下振荡培养,分别在第0 d、4 d、8 d、14 d、21 d、28 d取出约0.5 mL悬浮液用于测量可溶性砷和铁以及乳酸盐、硫酸根的含量。所有处理一式3份,改良矿物盐培养基成分为:3.0 g KH2PO4、3.0 g Na2HPO4、1.0 g NH4Cl、0.5 g KCl、0.01g CaCl2、10.0 mL维生素溶液、5.0 mL微量元素溶液,加去离子水至1 000.0 mL,调节pH值至7.0~7.2。
1.3 基于qPCR技术的arrA基因丰度的分析
实时荧光定量PCR (Real-time Quantitative PCR Detecting System) 技术通过荧光染料或荧光标记的特异性探针,对PCR产物进行标记跟踪,实时在线监控反应过程,并结合相应的软件对产物进行分析,计算待测样品模板的初始浓度。本次试验目的是检测细菌中呼吸性砷还原酶基因(arrA)的浓度[20]。使用土壤DNA提取试剂盒,从培养21 d的混合物样品中提取微生物群落总DNA,将含arrA基因的质粒标准品连续稀释制备标准曲线,用于定量PCR(qPCR)分析。使用引物arrA-CVF1(5′-CGAAGTTCGTCCCGATHACNTGG-3′)和arrA-CVR1(5′-GGGGTGCGGTCYTTNARYTC-3′)[21],所有qPCR均使用SYBR Premi Ex Taq Ⅱ试剂盒(TaKaRa,Japan)和StepOnePlus Real-Time PCR系统(Applied Biosystems,USA)。arrA基因的PCR循环包括94℃预变性5 min,然后进行35个循环:94℃变性30 s,55℃退火30 s和72℃延伸1 min。
1.4 尾矿土壤微生物群落结构分析
使用E.Z.N.A土壤DNA提取试剂盒(Omega,USA)提取尾矿土壤微生物基因组DNA。如前所述[22],使用微生物16S rRNA基因引物338F(5′- ACTCCTACGGGAGGCAGCAG-3′)和806R(5′- GGACTACHVGGGTWTCTAAT-3′)以及IlluminaMiSeq测序平台对尾矿土壤微生物16S rRNA基因进行PCR扩增和测序[15]。环境微生物多样性检测服务由上海美吉生物科技有限公司提供。
2 结果与分析
2.1 尾矿土壤的地球化学特征分析
石门雄黄矿区尾矿土壤样品TIB的地球化学特征分析结果,见表1。
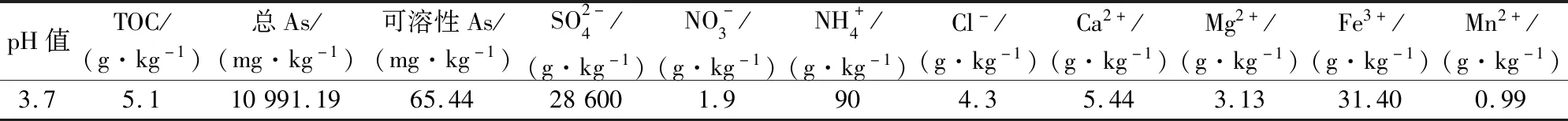
表1 石门雄黄矿区尾矿土壤样品TIB的地球化学特征Table 1 Geochemistry features of the soil sample named as TIB in the Shimen Realgar Mine area
2.2 硫酸盐对呼吸性砷还原菌(DARPs)介导的尾矿土壤中砷和铁溶解与释放的影响
2.2.1 硫酸盐对微生物催化的尾矿土壤中过程中可溶性As(Ⅲ)和Fe(Ⅱ)释放含量变化的影响
为了探究硫酸盐对DARPs催化的尾矿土壤中砷和铁溶解与释放的影响,本次设计了6组试验:灭菌土、灭菌土加乳酸盐、灭菌土加乳酸盐和硫酸盐、活性土、活性土加乳酸盐、活性土加乳酸盐和硫酸盐,其中对照组中灭菌土是由湖北省农业科学院农产品加工与核技术研究所钴-60辐射灭菌,考察了硫酸盐对DARPs催化的尾矿土壤中可溶性As(Ⅲ)和Fe(Ⅱ)释放含量变化的影响,其试验结果见图2。
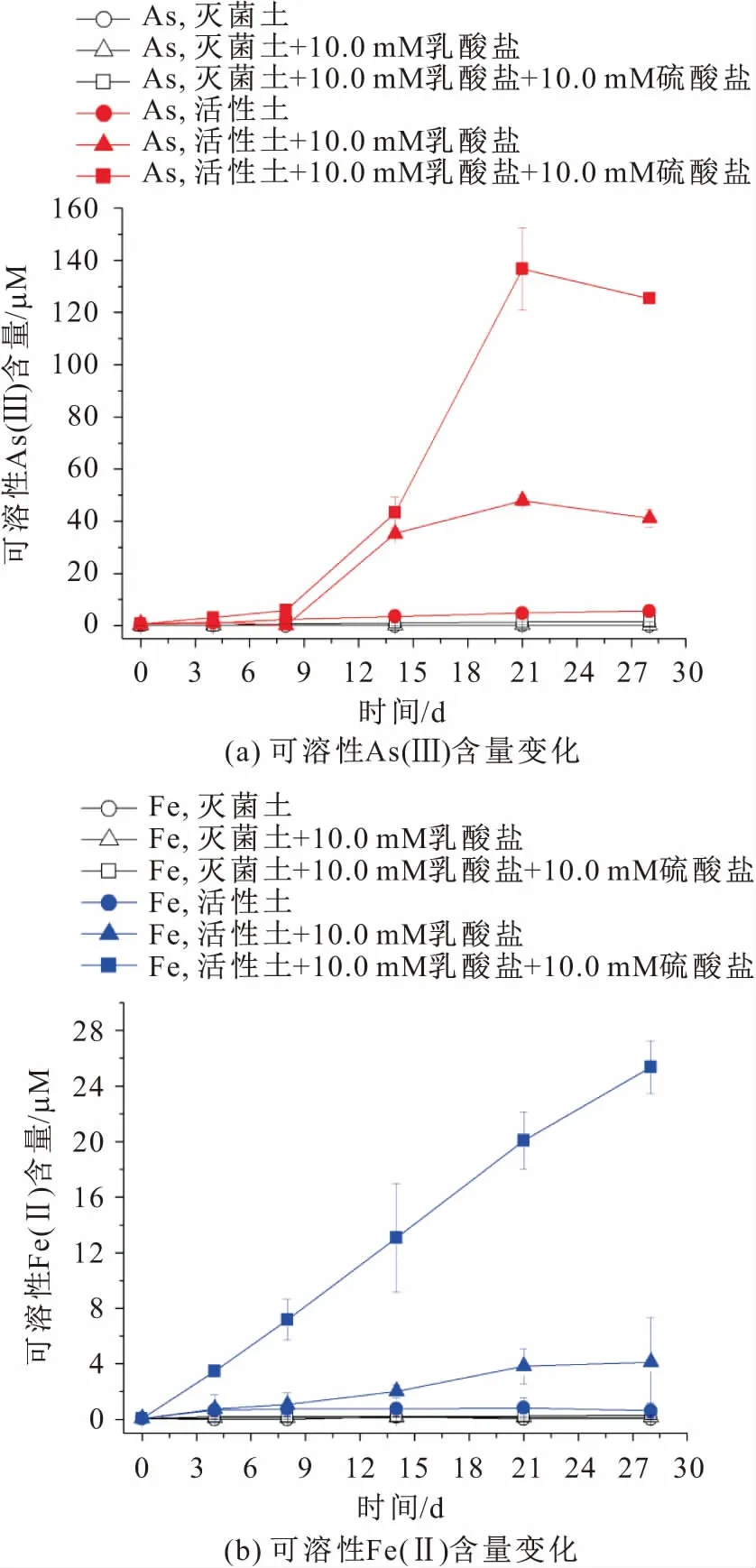
图2 微生物催化从尾矿土壤样品T1B中释放的可溶性As(Ⅲ)和Fe(Ⅱ)含量变化Fig.2 Content of microbial release of As(Ⅲ) and Fe(Ⅱ) from the tailings soil sample T1B
由图2可见,灭菌土试验组中,灭菌土是否添加乳酸盐、硫酸盐对可溶性As(Ⅲ)、Fe(Ⅲ)释放含量变化的影响不明显,说明乳酸盐和硫酸盐对灭菌土中砷、铁溶解与释放的影响较小;相比之下,活性土试验组中,可溶性As(Ⅲ)和Fe(Ⅲ)释放含量有少量增加,培养21 d后可溶性As(Ⅲ)和Fe(Ⅲ)分别有4.83 μM、0.83 μM的释放量,而活性土添加10.0 mM乳酸盐试验组,在无光培养21 d时可溶性As(Ⅲ)和Fe(Ⅲ)分别有47.98 μM、3.83 μM的释放量,比较发现添加乳酸盐厌氧培养至第21 d后可溶性As(Ⅲ)和Fe(Ⅲ)的释放量分别增加了892.55%、504.82%,这表明DARPs利用了乳酸盐作为唯一的电子供体,显著催化了尾矿土壤样品T1B中砷、铁的溶解与释放。
为了分析硫酸盐对DARPs催化尾矿土壤中砷和铁释放的影响,试验设计活性土添加10.0 mM乳酸盐和10.0 mM硫酸盐,在培养8 d、14 d、21 d时,分别释放了15.93 μM、43.30 μM、136.74 μM的砷,7.16 μM、13.06 μM、20.06 μM的铁,将其与活性土不添加硫酸盐试验组进行对比发现,砷的释放量在第8 d、14 d、21 d分别增加了160.67%、22.71%、184.96%,铁的释放量分别增加了574.37%、547.04%、423.35%,且单独检测发现释放的砷、铁均为可溶性As(Ⅲ)、Fe(Ⅱ)。上述结果表明:硫酸盐显著增强了尾矿土壤中DARPs催化的不可溶性砷、铁的溶解与释放。
由图2(a)可见,硫酸盐对微生物介导的尾矿土壤中砷溶解与释放的刺激作用随着时间的推移而减弱,这可能归因于尾矿土壤中硫酸盐还原菌(SRB)的影响,虽然未能使用PCR技术检测尾矿土壤中SRB的存在,但后续试验检测到硫化物的增加表明它可能存在。硫酸盐是SRB的底物,可能激活SRB的增殖,SRB可以将硫酸盐转化为硫化物,沉淀As(Ⅲ)并限制砷从土壤相中溶解与释放到地下水中[23]。
2.2.2 硫酸盐对微生物催化的尾矿土壤中其他物质含量变化的影响
为了探究硫酸盐促进微生物介导的砷和铁释放过程中其他物质含量的变化,本试验设计在第0 d和第21 d分别检测添加硫酸盐试验组中乳酸盐和硫酸盐含量的变化,其试验结果见图3。
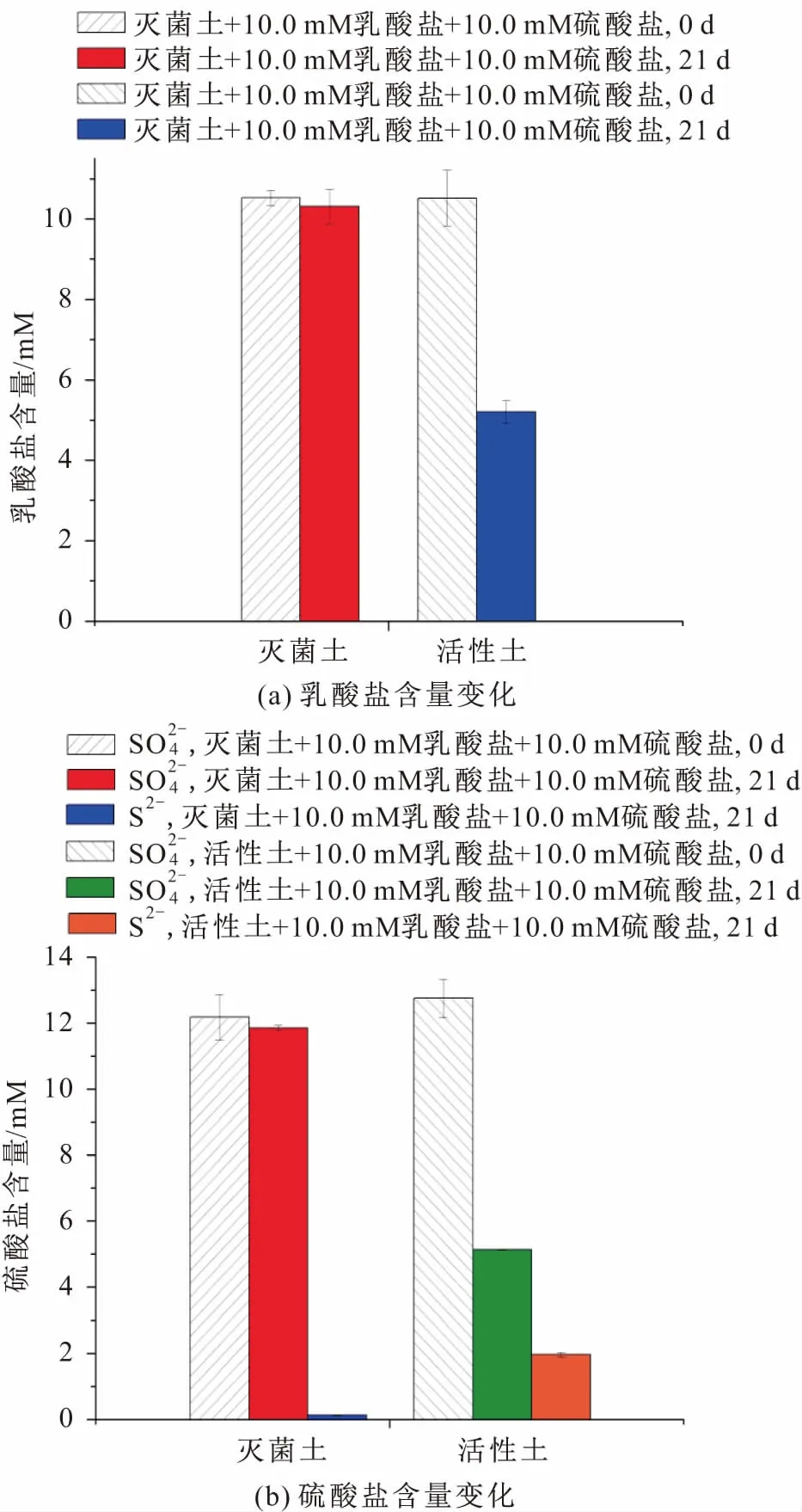
图3 微生物反应过程中尾矿土壤样品T1B中乳酸盐和硫酸盐含量的变化Fig.3 Fate of lactate and sulphate in the tailings soil sample T1B during the microbial reactions
由图3可见,灭菌土中添加的乳酸盐含量减少了0.21 mM,不排除试验误差造成的变化;而活性土中,乳酸盐含量减少了4.80 mM,这说明尾矿土壤样品T1B中微生物群落在促进了砷和铁释放的同时消耗了4.80 mM的乳酸盐[见图3(a)];检测添加硫酸盐试验组中添加的10.0 mM硫酸盐含量的变化,发现除去土壤混合液中自身的硫酸盐和硫化物外,还通过微生物作用产生了1.83 mM硫化物,硫酸盐含量减少了4.91 mM,这表明尾矿土壤样品T1B中细菌可利用硫酸盐,将硫酸盐还原为亚硫酸盐,再进一步还原为硫化物[见图3(b)]。
综上所述,石门雄黄矿区尾矿土壤样品T1B中存在能够利用乳酸盐作为唯一的电子供体,将尾矿土壤中不可溶性As(Ⅴ) 转化为可溶性As(Ⅲ)的DARPs,在这些微生物利用乳酸盐催化尾矿土壤中砷、铁溶解与释放的同时,硫酸盐作为影响因子显著促进了尾矿土壤中砷和铁的释放;体系中硫化物的含量增加、硫酸盐的含量减少,说明尾矿土壤样品T1B中微生物能够还原硫酸盐,产生硫化物。
2.3 硫酸盐促进呼吸性砷还原酶基因的表达
为了进一步了解硫酸盐是否通过促进呼吸性砷还原酶的活性,从而促进尾矿土壤样品T1B中微生物催化的砷和铁释放到水相中,本试验利用qPCR 技术,测定DARPs中arrA基因的丰度。厌氧培养21 d后,提取添加或者不添加10.0 mM硫酸盐两个试验组的DNA,检测arrA基因的丰度,其试验结果见图4。
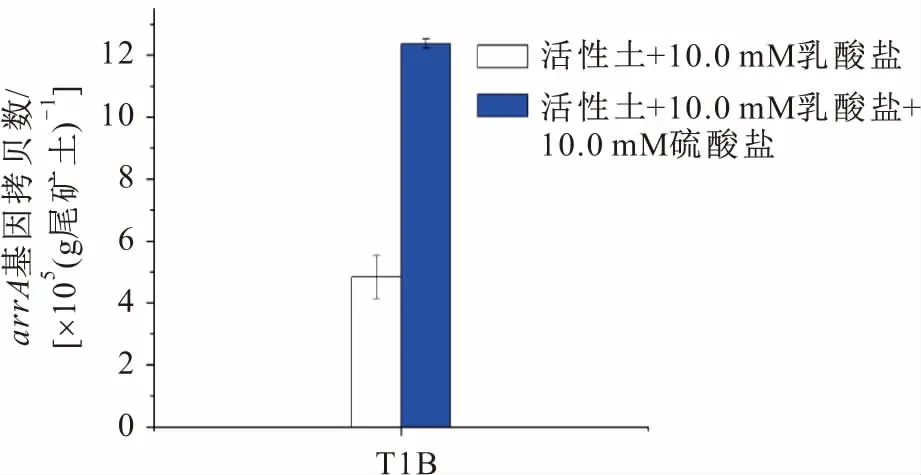
图4 硫酸盐对尾矿土壤样品T1B中arrA基因拷贝数的影响Fig.4 Effect of sulphate on the copy number of arrA gene in the tailings soil sample T1B
由图4可见,添加乳酸盐试验组尾矿土壤中arrA基因拷贝数为4.83×105/g尾矿土,添加乳酸盐和硫酸盐试验组尾矿土壤中arrA基因拷贝数为12.37×105/g尾矿土,同比添加硫酸盐试验组arrA基因丰度增加了156.14%。
由此可见,在T1B点位尾矿土壤中存在大量DARPs,它们可利用乳酸盐作为唯一电子供体生长,活性土添加硫酸盐后,呼吸性砷还原酶的丰度明显增加,表明硫酸盐刺激了DARPs的增殖,促进了呼吸性砷还原酶的活性,这些DARPs通过酶活性增强,加强了砷从不可溶性As(Ⅴ)还原为可溶性As(Ⅲ) 的作用,从而催化了砷从不可溶性转为可溶性释放到地下水中。
2.4 尾矿土壤中微生物群落结构分析
为了更好地理解本研究观察的微生物基础,试验利用高通量配对末端测序技术分析了尾矿土壤样品T1B中微生物群落的结构,其试验结果见图5。
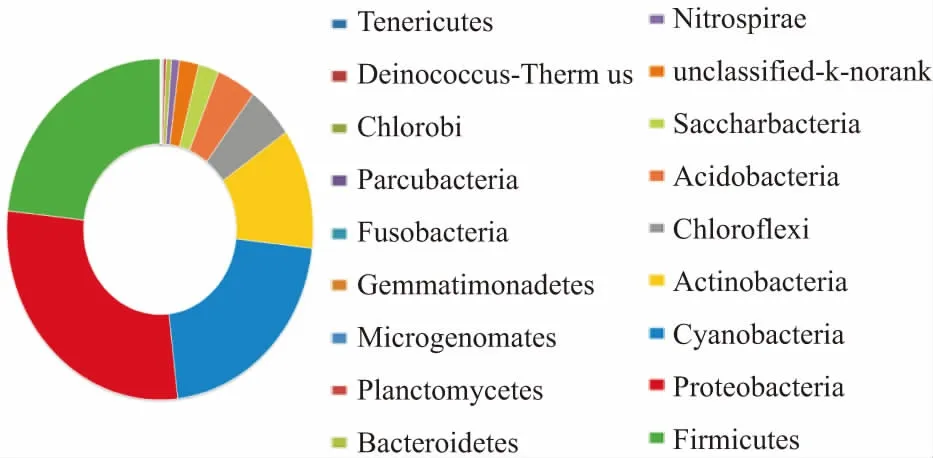
图5 石门雄黄矿区尾矿土壤样品T1B中门分类水平的微生物群落组成分析Fig.5 Analysis of the microbial community compositions in the tailings soil sample T1B in Shimen Realgar Mine at phylum level
由图5可见,在T1B点位尾矿土壤中在门分类水平上主要有18个细菌门,微生物群落主要以Proteobacteria、Firmicutes、Cyanobacteria、Actinobacteria这四个群落为主要门类,其占比分别为28.55%、23.27%、21.35%、11.41%,还有Microgenomates(0.14%)、Planctomycetes(0.28%)、Bacteroidetes(0.54%)、Nitrospirae(0.83%)、unclassified-k-norank(2.05%)、Saccharbacteria(2.15%)、Acidobacteria(4.18%)、Chloroflexi(4.95%)和其他丰富程度较低的微生物,如Tenericutes(0.02%)、Fusobacteria(0.05%)、Chlorobi(0.03%)、Parcubacteria(0.03%)、Tenericutes(0.02%)、Deinococcus-Thermus(0.03%)、Gemmatimonadetes(0.09%);尾矿土壤样品T1B中Proteobacteria和Firmicutes是富砷尾矿土壤中常见的主要的门类,同时也是DARPs主要存在的门类,而Cyanobacteria和Actinobacteria这两个门类在富砷尾矿土壤中作为主要微生物较为少见,由此可见石门雄黄矿区尾矿土壤样品T1B中的微生物多样性较为独特。
3 结论与讨论
石门雄黄矿区及其周边的地下水长期受到砷的污染,研究表明硫酸盐显著地促进了微生物群落催化的砷污染土壤中砷和铁的溶解与释放。此外,研究乳酸盐和硫酸盐的去向表明,在微生物反应过程中,乳酸盐被氧化成乙酸,硫酸盐被还原为硫化物。功能基因丰度的定量PCR分析表明,这种现象归因于硫酸盐引起的呼吸性砷还原酶基因丰度的显著增强。呼吸性砷还原菌(DARPs)将硫酸盐还原成亚硫酸盐再到硫化物,同时显著促进了呼吸性砷还原酶arrA基因的丰度。本研究的发现为尾矿土壤中砷、铁、硫的生物地球化学反应提供了新的见解,这一发现验证了Wang等[9]关于地下水中砷含量动态变化机制的结论。
硫酸盐肥料可为植物生长提供必需的硫营养素。据估计,2015年全球硫酸盐肥料产量为690亿t,到2029年将增加到720亿t[24-25]。这表明农业施肥显著增加了土壤中硫酸盐的含量,且农业残留物的微生物分解也会产生大量的硫酸盐。然而,研究发现硫酸盐可以显著增强DARPs催化的砷还原、溶解与释放,这表明农业活动可能会加剧地下水中砷污染。本研究为将农业活动与地下水中砷污染联系提供了证据,建议在砷污染的土壤和地下水的生物修复中使用硫酸盐须慎重考虑。

