赫赛汀联合DCF方案治疗HER-2阳性晚期胃癌的临床研究*
舒阳春 杨 曙 莫贤毅
广东药科大学附属第一医院肿瘤科,广东 广州 510000
胃癌是高发且恶性程度高的肿瘤之一,其发病率、死亡率占所有恶性肿瘤的第二位,仅次于肺癌[1]。目前,胃癌根治主要靠手术手段,但绝大多数胃癌在明确诊断前已丧失手术根治机会,5年生存率不到40%,因此化疗作为全身治疗方案,是晚期胃癌治疗的基石[2]。其中,DCF方案是晚期胃癌的标准一线治疗,但由于不良反应以及耐药等原因,该药治疗的有效率及患者的生存时间仍不尽人意。近年来,赫赛汀在抗肿瘤转移方面上的应用受到国内外学者关注,该药对Her-2过表达胃癌表现有效的抑制作用,能有效抑制癌细胞增殖及促进细胞凋亡等[3]。此外亦有研究显示,曲妥珠单抗和多西紫杉醇对HER-2转移性乳腺癌患者有生存优势[4]。本研究采用赫赛汀联合DCF方案治疗晚期HER-2阳性胃癌,并与DCF方案组对照,比较两种治疗方案在HER-2阳性胃癌治疗中的疗效、生存分析及不良反应,进行统计分析如下。
1 资料与方法
1.1临床资料
分析2014年6月—2017年6月我院肿瘤科收治的62例经病理学确诊的HER-2阳性晚期胃癌患者,随机分成赫赛汀联合DCF方案实验组(30例)和DCF方案对照组(32例)。所有入组患者均未行放化疗或生物治疗,治疗前血常规,肝、肾功能等指标均处于正常范围,Karnofsky评分≥60分,有可测量病灶,预计生存期>3个月。
1.2治疗方法
对照组(DCF方案): 多西他赛75 mg/m2,每疗程中的第一天使用; 顺铂75mg/m2,每疗程中的第一天使用; 5-Fu为2.4 g/m2,每疗程中的第一至五天(120h)持续静脉滴注;实验组(赫赛汀联合DCF方案): 赫赛汀首个周期为8 mg/kg,后续周期为6 mg/kg 维持,均为每周期的1天用药;DCF方案用量同对照组;两组均21 d为一周期,每例患者至少治疗2个周期。
1.3药物疗效及不良反应评价
按RECIST1.1实体瘤评价标准对上述两种治疗方案进行疗效、生存分析和不良反应评价。其中疗效分为完全缓解(CR),部分缓解(PR),稳定(SD)和进展(PD)。使用生存期(OS)、中位生存时间(MST)、肿瘤进展时间(TTP)进行生存分析。不良反应按WHO急性及亚急性毒性标准分为0~4级。其中,肿瘤进展时间(time to progression,TTP)指从化疔开始到肿瘤出现进展的时间。
1.4统计学方法
采用SPSS 17.0软件进行统计处理,组间差异采用χ2检验,生存分析用 Kaplan-Meier 法检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1疗效对比
治疗后经评价,对照组有效率为37.5%,实验组有效率为53.3%,组间对比差异有统计学意义(P<0.05)。详见表1。
2.2生存分析
两组TTP、MST对比表2。
2.3不良反应
不良反应有骨髓抑制、神经毒性、口腔炎及肝功能异常等,无因不良反应而终止治疗的病例。两组中腹泻、皮疹、肝功损害等不良反应均较轻,两组均无治疗相关性死亡。两组不良反应差异无统计学意义,详见表3。
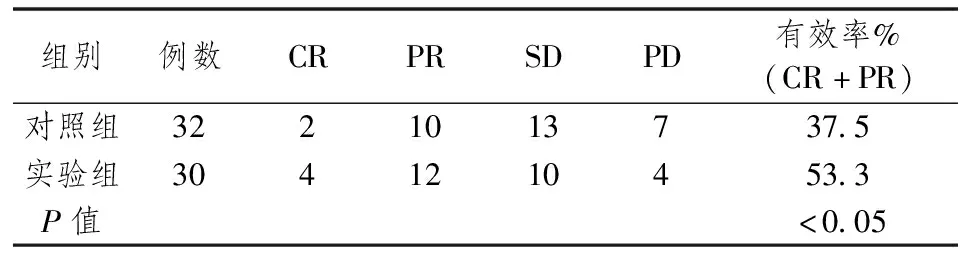
表1 两组疗效对比
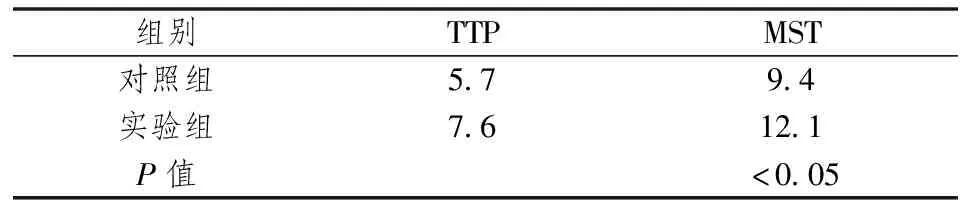
表2 生存分析对比
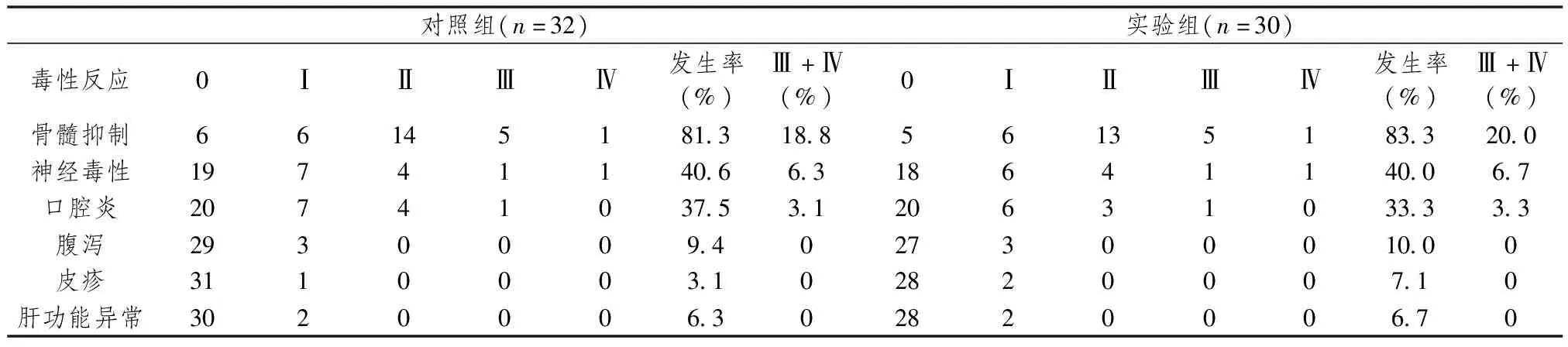
表3 对照组和实验组的不良反应比较
3 讨 论
目前,化疗是治疗晚期胃癌的重要手段。CF方案是美国国立综合癌症网络推荐用于晚期胃癌的化疗方案。研究显示,DCF方案治疗胃癌化疗有效率为38.7%,生存期为10.2个月[5]。近年来Her-2在胃癌中表达受到广泛关注。研究表明,Her-2下游的信号传导途径主要包括Ras-MAPK和PI3K-Akt途径,Ras-MAPK与细胞有丝分裂有关;PI3K-Akt与细胞的存活和凋亡有关。Her-2通过PI3K/AKT转导通路参与胃癌的浸润、转移及预后[6]。赫赛汀是一种人源化单克隆抗体,该药物以Her-2癌基因为靶点,于1998年被美国FDA批准用于晚期乳腺癌治疗。近年来,赫赛汀在Her-2阳性的胃癌中的应用受到广泛关注。赫赛汀能特异性结合Her-2受体结合,下调Her-2蛋白表达,下调PI3K/Akt 信号通路,提高化疗药物敏感性。Kim等研究发现,抑制胃癌细胞增殖是通过诱导G1期停滞,并降低S期细胞比例[7]。Fujimoto-Ouchi等研究也表明,赫赛汀对Her-2阳性胃癌细胞能产生抗体依赖细胞介导的细胞毒性效应[8]。一项国际ToGA试验的显著结果显示联合赫赛汀治疗可显著地延长该侵略性胃癌患者的生存期。基于该项试验,欧盟委员会及美国已批准在治疗HER2阳性胃癌患者化疗时联合使用赫赛汀(曲妥珠单抗)[9]。本实验研究结果表明,实验组总有效率优于对照组。
综上所述,赫赛汀联合DCF方案治疗HER-2阳性晚期胃癌较单一使用DCF方案好,不良反应未见明显增加,安全性较高,有延长生存的优势,值得在临床推广使用。

