ELISA测定中HRP/TMB显色体系的优化及稳定性研究
刘凤银, 卢嘉辉, 巫嘉琦, 黄燕璇, 邹红丽, 梁岳, 穆洪涛
(广东第二师范学院 生物与食品工程学院, 广东 广州 510303)
*通信作者:穆洪涛,男,山东德州人,广东第二师范学院生物与食品工程学院讲师,博士.
0 引言
酶联免疫吸附测定(Enzyme Linked Immunosorbent Assay,ELISA)是将抗原抗体结合的高度特异性及酶的高效催化性相结合的一种免疫分析方法,具有灵敏度高、快速简便、成本低廉等优点,目前已广泛应用于临床医学、食品科学、药物分析、动物检疫、病虫害防治等领域[1-3]. ELISA测定中,最后一步的酶催化显色反应起到信号放大作用,通过测定颜色的深浅来计算待测物的含量. 因此,底物显色液的质量及显色系统的稳定性直接决定了试验的成败[4-6]. 目前,虽已有商品化的显色液产品,但由于涉及商业机密,其配方极少公开,同时存在产品质量参差不齐、价格昂贵等问题,当教学或科研中需使用大量显色液时,将大大增加实验的成本和不稳定性因素[7].
本研究以农药氟乐灵间接ELISA显色系统为例,通过单因素试验,初步探讨各因素对辣根过氧化物酶/3,3′,5,5′-四甲基联苯胺(HRP/TMB)显色体系的影响,通过正交试验确定最佳工作条件,并对显色液的储藏稳定性进行研究,以期提供一种HRP/TMB显色体系的优化方法及一种灵敏度高、性能稳定的显色液配方,为相关领域工作者提供参考.
1 材料与方法
1.1 材料
1.1.1 实验材料与试剂
鼠源抗氟乐灵单克隆抗体、氟乐灵包被原(实验室自制);牛血清白蛋白(BSA)、HRP标记的羊抗鼠IgG抗体(HRP-IgG)(美国sigma公司);TMB、过氧化脲、吐温-20、二甲基亚砜(DMSO)、甘油、蔗糖(上海阿拉丁试剂公司);96孔酶标板(厦门怡佳美实验器材有限公司). 其他试剂均为国产分析纯;实验用水为一级水.
ELISA测定中所用缓冲液. 磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.4);碳酸盐缓冲液(CB,0.05 mol/L,pH 9.6);洗涤缓冲液(PBST,0.01 mol/L,pH 7.4,PBS-0.5 mol/L,吐温-20);封闭液(0.01 mol/L,pH 7.4,PBS-1% BSA,10%蔗糖,现配现用);终止液(10% H2SO4).
1.1.2 实验仪器
SP-Max 2300A2光吸收型全波长酶标仪(上海闪谱生物科技有限公司);Wellwashi MK2洗板机(美国Thermo公司);PHSJ-4F pH计(上海仪电科学仪器股份有限公司);JA2603B(M)分析天平(0.1 mg)(上海精科科学仪器有限公司);微量移液器(德国艾本德股份公司);DK-8D电热恒温水槽(上海医用恒温设备厂);DHG-9140AD 鼓风干燥箱(上海东麓仪器设备有限公司);NC-B型超纯水设备(重庆尼珂).
1.2 方法
1.2.1 间接ELISA的操作步骤
包被:将氟乐灵包被原用CB稀释成1 μg/mL进行包板,100 μL/孔,37 ℃水浴箱中孵育过夜;洗涤:倾去孔内液体,洗涤液洗板2次. 封闭:加封闭液120 μL/孔,37 ℃孵育3 h,甩干孔内液体,倒置于37 ℃烘箱中,烘干1 h备用. 加样及孵育:将抗氟乐灵单克隆抗体用PBST稀释至合适浓度,100 μL/孔,37 ℃孵育40 min,洗板5次. 加酶标二抗:将HRP-IgG用PBST稀释5 000倍,100 μL/孔,37 ℃孵育40 min,洗板5次. 显色:加显色液,100 μL/孔,37 ℃孵育后,每孔加50 μL终止液,终止反应. 测定:采用酶标仪测定各孔在450 nm处的吸光值A450 nm.
1.2.2 显色液的配制
显色液采用双组分形式. 将0.2 mol/L乙酸钠、0.1 mol/L柠檬酸按不同体积比混合,配置成不同pH的缓冲液,加入过氧化脲得组分1;精确称取TMB溶于DMSO中,并加入一定体积的甘油,配置成储备液,用含有EDTA-Na20.1 g、一水合柠檬酸0.42 g的溶液稀释到合适浓度得组分2. 使用时,将组分1、组分2等体积混合,现配现用.
1.2.3 单因素试验
进行ELISA实验,测定各孔A450 nm值. 考察pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5)、TMB质量浓度(0.05、0.1、0.2、0.4、0.8、1.6 g/L)、过氧化脲质量浓度(0.1、0.2、0.4、0.8、1.6、3.2 g/L)、DMSO体积分数(0.5%、1%、2%、4%、8%、16%)、甘油体积分数(0、0.5%、1.0%、2%、4%、8%)、显色时间(5、10、15、20、25、30、35、40 min)对显色效果的影响. 通过调整氟乐灵单克隆抗体的浓度,使最大吸光值在1.0~1.5之间. 同时做空白对照试验,考察显色液的自发显色.
1.2.4 正交试验
以缓冲液pH、TMB质量浓度、过氧化脲质量浓度、显色时间为考察因素,根据单因素试验结果,选取单因素峰值和前后临近两点共计3个水平,进行4因素3水平正交试验. 具体正交试验因素水平设置见表1.

表1 正交试验因素水平
1.2.5 稳定性试验
配制显色液组分1、组分2,4 ℃密封避光储存. 每隔10 d取出与当天新配制组分1、组分2同时用于ELISA试验,分别测定其对应的吸光值,前者记为A,后者记为A0. 以储存时间为横坐标、比吸光值A/A0为纵坐标,绘制曲线,确定本配方显色液的储存稳定性及使用有效期.
1.2.6 自制显色液与市售同类产品对比分析
按照最佳工作条件,配制HRP/TMB双组分显色液. 在氟乐灵ELISA检测体系中,分别采用自制的和三种市售的双组份显色液,进行试验,显色0、3、6、9、12、15、18 min后测定A450 nm. 以显色时间为横坐标、A450 nm为纵坐标,绘制曲线,比较不同显色液的灵敏度、显色时间、本底值及稳定性等性能参数.
1.3 数据处理
实验做3个平行试验. 实验数据采用excel计算数据平均值及标准差;采用spss 19.0进行正交试验设计及数据方差分析;采用origin 8.5对数据进行拟合分析.
2 结果与讨论
2.1 单因素实验

a~j字母不同表示差异显著(p<0.05)图1 pH对显色效果的影响
2.1.1 pH对显色效果的影响
HRP/TMB显色体系中,pH主要通过改变酶和底物的解离状态,影响酶与底物的结合能力以及酶的催化能力,进而影响显色效果[8-9]. 根据采用的供氢体的不同,pH对显色效果的影响亦不同. 通过调整缓冲液两组分的体积比,使显色液的最终pH分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5,考察以TMB作为供氢体时, pH对显色效果的影响. 结果见图1. 可以看出,显色液的pH对显色效果有显著影响. 当pH为4.5~5.5时显色效果最佳,当pH大于5.5或小于4.5时,A450 nm显著降低.

2.1.2 TMB质量浓度对显色效果的影响
可作为HRP供氢体的有邻苯二胺(OPD)、2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)和TMB,前两者由于具有潜在的致癌性而逐渐被TMB所替代[10]. 本研究中,采用TMB作为供氢体. 由图2所示,随着TMB质量浓度的提高,吸光值先增大后降低;TMB质量浓度为0.2 g/L时,吸光值最大,0.4 g/L时吸光值稍降,但两者无显著差异;0.8 g/L时吸光值显著下降,可能原因是组分1、组分2混合后,pH升高,TMB溶解度下降,其在溶液中的分散度下降;配置TMB质量浓度为1.6 g/L显色液时,TMB过饱和析出.
2.1.3 过氧化脲质量浓度对显色效果的影响
HRP对受氢体的专一性很高,仅作用于H2O2、小分醇的过氧化物和尿素过氧化物,其中过氧化脲的稳定性远高于前两者[5,11]. 为了获得稳定性更高的显色液,保证实验的重复性,本研究采用过氧化脲作为受氢体. 由图3所示,随着过氧化脲质量浓度的提高,吸光值先增大后逐渐降低,0.2 g/L时达到最大. 可能原因是HRP以铁卟啉为辅基,分子中含有一个Fe2+,高质量浓度过氧化脲致部分Fe2+氧化为Fe3+,导致酶失活;同时,高质量浓度过氧化脲有一定的漂白作用,导致吸光值降低.
2.1.4 DMSO体积分数对显色效果的影响
在显色剂的配置中,TMB的溶解度是一关键因素,直接影响到检测的敏感性[10]. TMB为脂溶性,性质稳定,但溶解度较低,其中在DMSO中的溶解度最大(20 mg/mL),因此本研究采用DMSO作为TMB的溶剂. DMSO体积分数过低,TMB的分散效果不佳,但有机溶剂体积分数过高会降低酶活性,影响显色效果. 由图4所示,当DMSO体积分数控制在8%之内时,吸光值变化不大,超过16%时,吸光值下降明显;DMSO体积分数为2%时,吸光值达到最大,因此本研究选取2%作为最佳DMSO体积分数. 此体积分数下,TMB的溶解度良好.
2.1.5 甘油体积分数对显色效果的影响
TMB对温度敏感,储备液需4 ℃存放,但由于DMSO在4 ℃呈固态,导致取用不便. 本研究尝试加入一定体积分数的甘油,使储备液保持液体状态. 故考察了不同体积分数甘油对显色效果的影响,见图5. 可以看出,适当加入一定体积分数的甘油,吸光值增大,有助于显色反应的进行;但甘油体积分数过高,吸光值缓慢降低,抑制显色反应的进行. 本着灵敏、节约原则,选取储备液可保持稳定液态时甘油的加入量,即0.5%.

2.1.6 显色时间对显色效果的影响
酶促反应为一可逆过程. 随着反应的进行,底物TMB质量浓度越来越低,产物浓度越来越高,酶促反应速率逐渐降低. 由图6所示,当显色反应进行15 min时,底物TMB已基本消耗完毕,吸光值最大;随着显色时间的延长,吸光值基本保持不变.
2.2 正交实验
影响HRP/TMB显色的因素很多,本研究根据单因素试验结果,选取了对显色影响较大的四个因素:pH、TMB质量浓度、过氧化脲质量浓度和显色时间,进行L9(34)正交试验,考察各因素之间的交互作用. 结果见表2. 由极差分析结果可知,对显色效果影响的主次顺序为 TMB质量浓度>过氧化脲质量浓度>pH>显色时间. HRP/TMB显色体系的最佳反应组合条件为A2B3C3D1. 此组合在表2中未出现,正交实验均值最高组合为A1B3C3D3. 进一步比对两种组合下的显色效果,A2B3C3D1组合显色吸光值为1.501,A1B3C3D3组合显色吸光值为1.392,两者有显著性差异(t=16.700 8,p<0.05),因此确定最佳显色条件为A2B3C3D1,即pH为5.0,TMB质量浓度为0.4 g/L,过氧化脲质量浓度为0.4 g/L,DMSO体积分数为2%,甘油体积分数为0.5%,显色时间为10 min.
2.3 稳定性试验
为提高实验效率,避免每次使用前都需要现配组分1和组分2,本研究测定了其3个月内显色效果的变化情况. 为防止不同批次包被、一抗浓度和酶标抗体稀释度对吸光值的影响,本研究采用比吸光值代替吸光值,以提高数据的可信性. 结果见图7. 可见,90 d后,显色液的显色效果呈缓慢下降趋势;110 d后下降趋势明显. 120 d内,本底值稳定在0.1以下,显色液自发显色不明显. 因此,显色液组分1和组分2,需分别存放在4 ℃冰箱中,3个月内稳定性良好.
2.4 自制显色液与市售同类产品对比分析
为考察本研究制备出的HRP/TMB双组分显色液的质量,本研究选购了3种市售的代表性双组分显色液产品,与本实验自制显色液,同时进行ELISA实验,从灵敏度、显色时间、本底值及稳定性几个方面进行对比分析. 具体结果见图8. 从图中可知,与市售显色液1相比,自制显色液灵敏度较高,显色反应较迅速,时间较短;与市售显色液2相比,自制显色液灵敏度与其相当,但比其显色时间短;与市售显色液3相比,自制显色液灵敏度略低,两者均反应较迅速,在12 min左右,达到了显色平台期. 四种显色液的本底值都比较低,其中市售显色液3的本底值略高,但均保持在0.2以下,在显色时间内,不影响结果. 作为商品化产品,3种市售显色液的有效期均在18个月以上,稳定性远优于本实验自制的显色液.

表2 正交试验结果
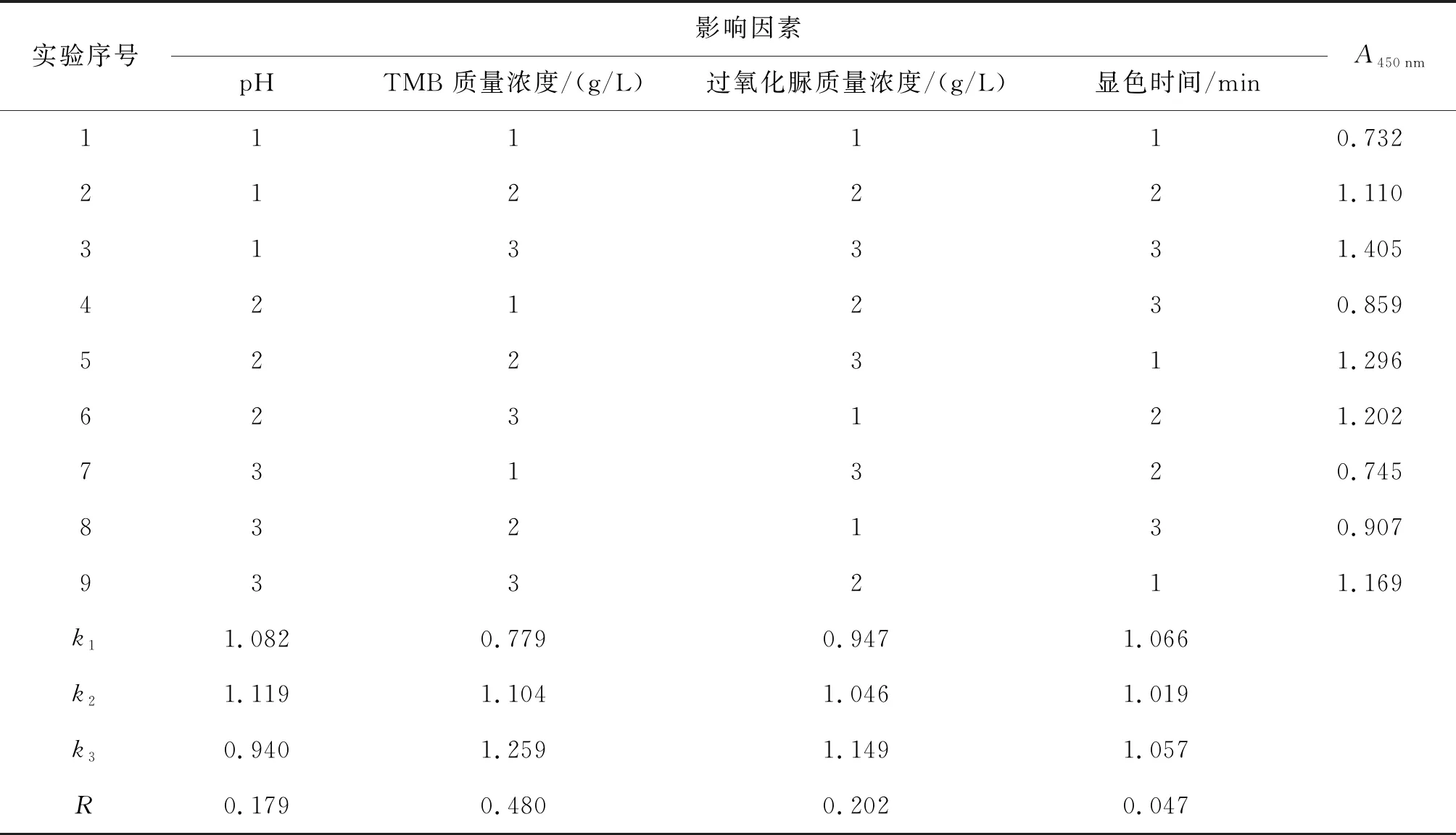
实验序号影响因素pHTMB 质量浓度/(g/L)过氧化脲质量浓度/(g/L)显色时间/minA450nm111110.732212221.110313331.405421230.859522311.296623121.202731320.745832130.907933211.169k11.0820.7790.9471.066k21.1191.1041.0461.019k30.9401.2591.1491.057R0.1790.4800.2020.047
注:k1、k2、k3为各因素同一水平下A450nm的平均值;R为各因素k1、k2、k3的极差.
3 结论与讨论
HRP/TMB显色过程是ELISA试验成败的关键因素. 本研究通过单因素试验探讨了pH、TMB质量浓度、过氧化脲质量浓度、DMSO体积分数、甘油体积分数和显色时间对显色效果的影响,并通过L9(34)正交实验确定了影响显色效果的主次顺序为TMB质量浓度>过氧化脲质量浓度>pH>显色时间,确定了HRP/TMB显色体系最佳工作条件为pH为5.0,TMB质量浓度为0.4 g/L,过氧化脲质量浓度为0.4 g/L,DMSO体积分数为2%,甘油体积分数为0.5%,显色时间为10 min. 在不添加保护剂的情况下,4 ℃储藏,可稳定3个月左右.
与3种市售同类产品对比,自制的显色液在灵敏度、显色时间方面均较好,但稳定性要远低于商品化的产品. 目前,本实验研制的HRP/TMB双组分显色液能够满足绝大多数的实验室ELISA研究,但尚不能满足商品化销售对保质期的要求. 后续,可尝试通过添加聚乙烯吡咯烷酮、曲拉通X-405等稳定剂,进一步延长显色液保质期,扩大其应用范围[12-13].

