凡纳滨对虾工厂化养殖水环境分析
杜秀萍,杨章武,张 哲,吴丽云
(福建省水产研究所,福建 厦门 361013)
凡纳滨对虾(Litopenaeusvannamei)原产于中南美洲太平洋沿岸水域,是我国目前对虾养殖产量最大的种类。凡纳滨对虾养殖模式有土池养殖、高位池养殖、温室大棚养殖和工厂化养殖等。由于凡纳滨对虾适宜高密度养殖,加上工厂化养殖单池水体小、养殖操作便利,近年来类似该模式的工厂化养殖快速发展[1-5]。工厂化养殖密度高,残饵粪便等有机质含量大;而水泥池本身是一个半封闭的相对脆弱的生态系统,小水体水质不稳定、变化快,自我调节能力差,增加了水质管理的难度。因此,水质调控仍是凡纳滨对虾工厂化养殖研究的主要内容之一。本文对凡纳滨对虾工厂化养殖的水环境变化规律进行了分析,以期为工厂化养殖条件下的水质调控和管理提供科学依据。
1 材料与方法
1.1 材料
虾苗来自晋江厦兴龙育苗场试验基地,规格为0.6~0.7 cm/尾。养殖实验在漳浦县佛昙鸿达水产育苗场进行。养殖池为水泥池,虾池规格为6.5 m×3.0 m×1.2 m(长×宽×高),每口放虾苗7 000尾,密度约360尾/m2,共50口池。养殖用水为养殖场近岸天然海水,经沉淀、高效过滤和紫外杀菌后进入养殖池。
1.2 养殖管理
养殖时间为2018年6月1日至2018年10月20日。虾池水深1.0 m,池水pH为7.3~7.9,盐度28~30。前期每天换水10 cm,1个月后换水量增加至20 cm,池底有虹吸排污口,通过换排水清除池底残饵和粪便等污染物。池内铺设增氧系统(每口池6~10个曝气头)全天24 h不间断充气。
每天投喂饲料2~4次,日投喂量约为对虾体质量的3%~5%,根据天气和对虾摄食情况作适当调整。每隔10天投放一次碳源(红糖),用红糖拌入饲料,红糖与饲料比例为0.7∶1.0。养殖全程使用复合芽孢杆菌、粪肠菌、EM制剂(将提前4 h活化后的菌粉均匀泼洒于全池)和藻类营养素等调节水环境,根据对虾活力状态配合使用安宝、虾健宝、五黄精华膏、免疫多糖、护肝素等。
1.3 虾池水质监测

1.4 虾池水体细菌培养检测与计数
总异养菌数、弧菌数采用平板培养计数法。总异养菌培养基采用2216E固体培养基,28℃培养48 h后计数;弧菌培养基采用TCBS固体培养基,28℃培养24 h后计数。监测频率与水质指标同步。
1.5 数据处理
用Excel和SPSS19.0软件对数据进行分析,对部分因子采用Dunnett’s T3进行差异性检验,当P<0.05时表示差异显著。
2 结果与分析
2.1 产量和成活率
养殖结束时,对虾平均收获体重为12.19 g/尾,平均产量为2.28 kg/m2。在整个养殖周期中,对虾生长正常,各池存活率在45%~59%之间(表1)。
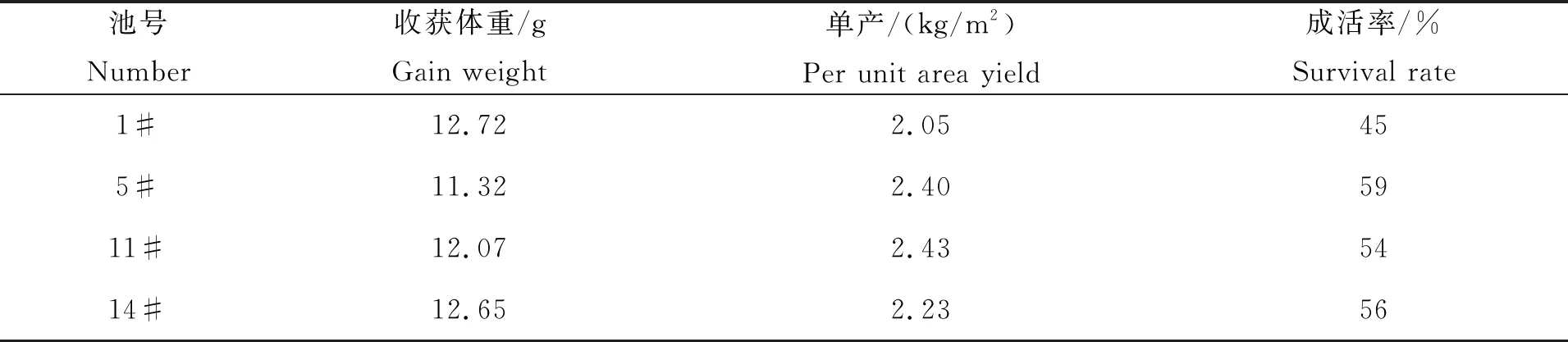
表1 实验池凡纳滨对虾产量和成活率
2.2 水温和DO
养殖实验处于夏季,整体水温较高,水温变化在27.0~31.5℃之间。7—8月水温最高,8月下旬连续多日下雨后,水温有所下降(图1)。虾池中DO变化范围为6.06~7.23 mg/L,DO受天气变化影响较大,由于8月下旬阴雨天气持续较长时间,微藻光合作用减弱,溶氧量相对较低。通过物理增氧方法在虾池中配备气头不间断充气,虾池水体DO一直维持在6 mg/L以上(图2)。
2.3 氨氮、亚硝酸盐、硝酸盐和活性磷酸盐
2.4 虾池水色与叶绿素a(Chl-a)
本次实验用水为过滤海水,在养殖开始前通过添加微生物制剂等措施肥水,形成以绿藻和硅藻为主的浮游植物群落结构;初期水体呈绿色,随着养殖时间延长,水色逐渐加深,且4口虾池水体颜色逐渐出现差异,到养殖末期,11#池、14#池水体呈深褐色,而1#、5#池水体保持偏绿色。
Chl-a广泛存在于浮游植物体内,可在一定程度上代表浮游植物的丰度。养殖期间虾池Chl-a变化范围为58~235 μg/L(图4)。6—9月各池中Chl-a一直呈上升趋势,最高值均出现在9月;之后,所有虾池Chl-a含量突然降低,这可能与天气、水温等变化有关。
2.5 总异养菌和弧菌数量
根据细菌培养计数结果(图5)可知,虾池水体中总异养菌数量为2.80×104~2.40×105CFU/mL。弧菌数量为8.00×102~1.00×104CFU/mL,在总异养菌中所占比例一直在10%以下。
3 讨论
3.1 氨氮、亚硝酸盐、硝酸盐和活性磷酸盐的变化
3.1.1 氨氮
3.1.2 硝酸盐和亚硝酸盐
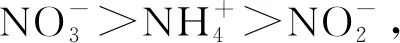
3.1.3 活性磷酸盐
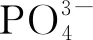
3.2 总异养菌和弧菌
细菌尤其是异养菌是池塘水环境系统中的分解者,在物质和能量循环中起关键作用。不同种类组成和数量的异养菌在养殖环境中扮演有益菌或致病菌等不同的角色。对虾养殖过程中水体总异养菌的数量变动易受人为因素(如使用微生物制剂、换水等)和其他环境因素(悬浮有机物、COD等)的影响[13-14]。在大多数研究中,对虾水泥池中总异养菌数量变动范围约为103~106CFU/mL[15-17]。本研究中,虾池水体中总异养菌数量在2.80×104~2.40×105CFU/mL之间变动,与其他研究结果相近。
虾池中的异养菌在菌属水平上主要有微小杆菌属、柠檬酸杆菌属、不动杆菌属、假单胞菌属、弧菌属等。除弧菌外,这些细菌对于同化无机离子、调控水质具有重要作用[18]。而大部分弧菌被认为是海水养殖的病原菌代表。当养殖动物体弱、抗病力降低、环境条件恶化时,水体中弧菌会乘虚而入,引起对虾败血症、黑鳃病、红体病等细菌性疾病[19-21]。许多学者认为,引起对虾感染发病的弧菌密度阈值为104CFU/mL[22],而本实验中,4口池中弧菌检测数量均未超过上述阈值,各池也无明显发病现象。有研究也发现[23-24],EM制剂能明显抑制和降低虾池中弧菌的数量,预防细菌性疾病的发生,其中起主要作用的是光合细菌,在本实验期间有间歇性添加EM菌,对弧菌产生了一定的抑制作用,弧菌在总异养菌中所占比例一直在10%以下。
3.3 N、P与浮游植物(Chl-a)的关系
同一时期各虾池水体颜色略有差异,这种差异主要由浮游藻类不同造成。水体绿藻较多时多呈鲜绿或墨绿色,硅藻大量繁殖时呈黄褐色,而甲藻大量繁殖时水色较深[25]。绿色水体(1#、5#池)的Chl-a含量显著高于深褐色水体(11#、14#池),说明水体中优势藻的种类对Chl-a含量有较大影响。根据养殖经验,绿藻和硅藻是凡纳滨对虾养殖的优势藻种,以硅藻为主的褐色体系更为稳定。
对藻类生长影响较大的营养因子是N和P。N/P比值直接影响藻类生长、细胞组成及其对营养的摄取能力。根据Darley[26]的研究结果,当N/P>30时,P可能是限制性因子;当N/P<5时,N可能是限制性因子。本研究中,水体N/P值在0.6~24.1之间,N/P<5的时期占整个养殖周期的54.2%,由此认为,本实验浮游植物生长受氮元素制约的可能性大一些。

