GPC3、HSP70、SALL4 和 AFP联合表达对胃肝样腺癌诊断的意义
于丽丽 何向蕾 吴建宇 王伟 张欣 茹国庆
胃肝样腺癌(hepatoid adenocarcinoma of the stom- ach,HAS)是指具有肝细胞分化特征的原发性胃癌。HAS最早在1985年由Ishikura等[1]提出,是胃癌中的一个少见亚型,具有血清甲胎蛋白(AFP)升高、容易发生肝及淋巴结转移、预后较差的特点。但HAS是一类临床症状无特异性的胃癌,以胃镜活检出现肝样分化区为诊断标准。虽然手术治疗及术后化疗是有效的治疗方法,但由于临床上对该病的认识不足,往往因难以明确诊断而错过最佳治疗时机。血清AFP检测可能有助于HAS的早期检出,但不能作为诊断HAS的标准。磷脂酰肌醇蛋白聚糖-3(glypican-3,GPC3)是肝细胞癌(HCC)的特异性标志物;热休克蛋白70(HSP70)在多种肿瘤的发生、发展中起到重要的作用,其在HCC中具有异常表达,可以作为HCC诊断的标志物。人类婆罗双树样基因-4(SALL4)是一种含锌指结构的干细胞因子,其在肝癌组织中表达上调,是肝癌干细胞的分子标志物。目前GPC3、HSP70、SALL4、AFP 联合检测在 HAS 诊断中的应用尚鲜见报道,因此本文探讨上述4种蛋白的联合表达对HAS诊断的意义。
1 资料和方法
1.1 一般资料 选取2009年1月至2018年4月本院经手术及病理诊断确诊的HAS患者10例(同期本院胃癌手术2 493例,HAS仅占0.4%)。回顾性分析10例患者的临床资料,参照WHO(2010)消化系统肿瘤分类及分级标准复习HE染色切片的肿瘤病理学特点,并对患者进行随访。
1.2 免疫组织化学检测 采用En Vision二步法染色。严格按照试剂盒说明书操作,以磷酸缓冲盐溶液(PBS)代替一抗作为阴性对照,用明确阳性组织作为阳性对照。所用一抗 GPC3、HSP70、SALL4、AFP、精氨酸酶-1(Arginase-1)、hepatocyte paraffin1(Hep Par1)、谷氨酰胺合成酶(GS)均购自北京中杉生物技术有限公司;二抗及二氨基联苯胺(DAB)显色剂均购自丹麦DAKO公司。
1.3 纳入标准 组织学具有细胞大、胞质嗜酸、似肝细胞样的形态特征或者原始肠样或卵黄囊样结构;GPC3、HSP70、SALL4、AFP免疫组化检测至少有其中2种抗体阳性表达。
2 结果
2.1 临床病理特征 10例患者中男9例,女1例,年龄58~75(66.0±51.7)岁。临床症状有腹胀、腹痛、贫血等,均无病毒性肝炎病史及肿瘤家族史;术前AFP升高(29.1~3 260.0μg/L)7例。所有患者均行胃癌根治术,其中术前发现肝转移1例,同时行肝肿块切除,术后病理检查肿瘤组织的特征见表1。病理TNM分期[2017,第8版美国癌症联合委员会(AJCC)]:Ⅰ期2例、Ⅱ期3例、Ⅲ期4例、Ⅳ期1例。
2.2 病理形态学特征 6例患者的肿瘤组织形态由肝样分化区和常见的腺癌区两部分组成;4例患者均由肝样分化区组成。肝样分化区与肝癌的典型组织学特征相似,癌细胞排列呈腺样、实性片巢状、梁状结构,肿瘤富于血窦。癌细胞呈卵圆形或多角形,胞质丰富,呈嗜酸性,细胞核不规则,部分有多形性,核仁较明显(图1~3,插页)。见广泛脉管内癌栓(图4,插页)9例,淋巴结转移7例,肝转移1例。
2.3 免疫组化检测结果 10例患者中7例GPC3呈胞质阳性表达(图5,插页),8例SALL4呈胞核阳性表达(图6,插页),9例HSP70呈胞质胞核阳性表达(图7,插页),6例AFP呈胞质阳性表达(图8,插页),与血清AFP升高基本一致(7/10);6例GS呈弥漫胞质阳性表达,3例Hep Par1呈胞质颗粒状阳性表达。Argniase-1全部阴性表达。通过上述指标组合分析发现GPC3、SALL4、HSP70和AFP的联合表达最有意义。2个指标共同表达的有4例,3个指标共同表达的有5例,4个指标共同表达的有1例。而其余指标的组合表达未提示具有相互补充的效应(表2)。笔者也发现SALL4的表达病例中有6例组织学形态以腺管乳头状结构为主;AFP的表达病例中以肝样细胞形态为主。
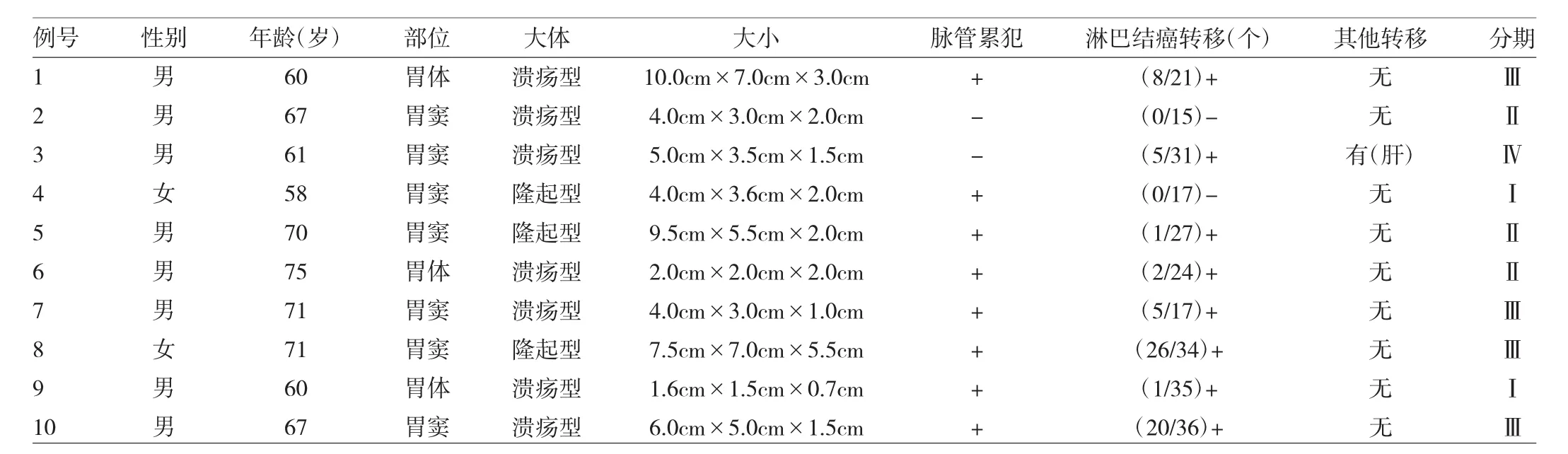
表1 10例HAS的临床病理特征

表2 10例胃肝样腺癌免疫组化表达情况
2.4 随访 10例患者随访6~60个月,4例术后出现肝转移,8例死亡,2例健在。死亡患者平均生存期13个月。
3 讨论
肝样腺癌是一种特殊类型的腺癌,发生于肝外组织,由多角形、嗜酸性、肝细胞样的大肿瘤细胞构成。文献报道全身很多器官如胆囊、胃肠道等[2]都可发生肝样腺癌,其中胃最常见[3]。胃和肝属于胚胎发育过程中的原始前肠衍生物,由于原始潜能干细胞的分化异常,导致胃癌出现了肝癌细胞特征的分化[2]。
Inagawa等[4]研究了85例HAS患者,结果显示HAS好发于中老年男性患者,男女比例约为2∶1,肿瘤多位于胃窦部(60.2%),肿瘤平均直径约6.5cm,患者术前血清AFP检测值 1.0~700 000.0μg/L,55例患者血清 AFP升高。本组患者术前血清AFP检测升高7例,与文献报道基本一致。与普通的胃腺癌相比,HAS侵袭性更强,预后更差[5]。本组7例淋巴结转移,5例肝转移(1例手术前,4例手术后复查发现),与文献报道一致。Lin等[6]报道HAS患者中位生存时间7.2个月,5年总体生存率为20%,与普通型胃腺癌患者5年生存率存在明显差异(20%比44%)。本组HAS患者的术后随访生存中位数13个月,总体生存率较普通型胃癌低,与文献报道类似。
免疫组化检测对HAS的诊断具有明确的指导作用,但尚未有非常明确的标志物。Su等[5]通过对53篇文献荟萃分析发现:不同部位的肝样腺癌中具有阳性表达的标志物可以归纳有GPC3、AFP、Hepatocyte、癌胚抗原(CEA)、各类细胞角蛋白(CK)、α1抗胰蛋白酶(α1-AT)、抗原细胞簇10(CD10)等。但各个蛋白表达的灵敏度及特异度均阐述不一,尚无明确定论。目前普遍认为,GPC3和AFP在鉴定肝细胞分化的标志物方面更具特异性。GPC3是磷脂酰肌醇蛋白聚糖家族(GPC)主要成员之一,GPC蛋白通过糖基-磷脂酰肌醇复合体共同调节部分生长因子(如Wnts)的信号活动,从而对细胞的生长和分化产生重要的作用。文献报道GPC3在HCC中具有较高的灵敏度和特异度[7],目前也已经作为HCC常规诊断中的标志物。HSP70作为HSP家族中的主要成员在肿瘤的发生、发展中起着极其重要作用[8]。有研究认为,HSP70可以通过调节细胞分子信号传导以及作为其他癌基因的分子伴侣促进癌症进展[9]。研究表明HSP70作为HCC的病理诊断标志物,在HCC中的表达会随着肿瘤的分化和病程的进展,从细胞膜表面高表达的同时逐渐在细胞质细胞核中出现表达[10],但尚未有其在HAS中表达情况的报道。SALL4是一种具有含锌指结构的转录因子,特异性表达于原始生殖细胞肿瘤如卵黄囊瘤[11]。SALL4可以促进造血干细胞分化成熟,并随着造血干细胞的分化逐渐消失。SALL4的异常表达上调,使造血干细胞重新获得自我更新能力,持续的改变引发多能性及恶性转化的倾向,导致白血病的发生、发展[12]。Gonzalez-Roibon等[13]研究发现随着肿瘤分化的降低SALL4在肝细胞癌组织中表达上调。本研究团队通过GPC3、HSP70、SALL4、AFP、Argniase-1、Hep Par1、GS 等与肝细胞癌相关的抗体实验以期对HAS的诊断能有提示和帮助,通过对实验结果数据分析,发现GPC3、HSP70、SALL4和AFP在实验组病例中至少会有2个抗体的阳性表达,所以GPC3、HSP70、SALL4和AFP联合表达对HAS的诊断和鉴别诊断很有意义,且尚未见上述组合对肝样腺癌的研究报道。
综上所述。HAS是一种少见的组织学亚型,具有高侵袭性,易血管侵犯、淋巴结、肝转移以及其他远处转移,预后差。本研究通过上述系列肝细胞相关抗原的免疫组化实验,发现GPC3、HSP70、SALL4和AFP 4个抗体的免疫组化联合检测,结合病理形态学特征,对HAS的诊断和鉴别诊断具有重要的意义。

