兰州百合组培快繁体系的构建
柯义强,郭鹏辉,马洪鑫,杨许花,高丹丹,*,刘湘君,马忠仁,丁功涛
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730124; 2.西北民族大学 生物医学研究中心,甘肃 兰州 730030)
兰州百合属球根作物,为多年生单子叶草本植物,是全国唯一能够食用的甜百合[1]。兰州百合色泽洁白如玉、味道甜美、个头大、纤维含量低[2-4],富含秋水仙碱、矿物质、微量元素和氨基酸等多种营养成分,具有清热解毒、润肺美容、止咳化痰、止痛止血、抗癌和增强人体免疫力等作用[5-7]。近年来,随着其市场需求和种植面积增加,兰州百合相关产品的加工也初具规模。但由于传统育种存在耗时长、耗费劳动力、受限当地的气候条件和地理位置等缺点,使得其不能在短时间内大批量生产,这已成为制约兰州百合相关产业持续发展的瓶颈[8]。与传统繁殖方法相比,植物组织培养技术可以突破外界环境与传统繁殖难生根、年龄效应等限制因素[9-10],能够保持品种的优良特性、缩短育种周期、降低生产成本、提高成活率,满足农业生产中大批量、高标准的种苗生产要求[11-12]。
本研究以兰州百合为研究对象,研究基础培养基、不同消毒剂与消毒时间、增殖与生根阶段激素种类和浓度对兰州百合组培快繁体系建立的影响,探索最适合兰州百合的消毒方法,以及愈伤组织诱导、发芽、生根的最佳激素配比,以期为兰州百合组培苗的工厂化发展提供参考。
1 材料与方法
1.1 材料
市售兰州百合,购于兰州市城关区榆中街市场。
1.2 方法
1.2.1 培养基
基本培养基:MS和1/2 MS培养基。根据需要添加不同种类植物生长调节剂,其中MS培养基中蔗糖为30 g·L-1,1/2 MS培养基中蔗糖为50 g·L-1,2种培养基中各添加琼脂15 g·L-1,pH为5.8~6.0,培养基在121 ℃灭菌30 min备用。
1.2.2 外植体消毒
取兰州百合新鲜外植体自来水流水冲洗30 min,再加入洗涤剂冲洗20 min,将外植体切成0.5 cm×0.5 cm的小块,置于超净工作台中。采用L9(33)正交试验设计(试验因子与测试水平见表1),研究3种不同消毒剂[75%乙醇、次氯酸钠溶液(有效氯浓度2%)、0.1% HgCl2溶液]相互组合处理对外植体存活率的影响。所有组合处理过的外植体均接种于含MS培养基的三角瓶中,每个组合10瓶,每瓶外植体3个,7 d转接,转接3次,于28 d后统计外植体存活率。

1.2.3 愈伤组织诱导与丛芽发生
取存活的外植体分别置于添加不同浓度梯度NAA、6-BA和2,4-D的MS培养基上,室温下培养。试验采用L9(33)正交试验设计(试验因子与测试水平见表2),优化激素添加种类和水平。以不加任何激素的MS培养基为对照组。试验共设置9个组合,每个组合10瓶,每瓶外植体3个,于28 d后统计愈伤组织诱导率和发芽率。

1.2.4 不定芽生根
将高2~3 cm,具有3~4片叶的不定芽切下,分别接种到含有不同浓度梯度的NAA、6-BA和活性炭的1/2 MS培养基上,室温培养,采用响应面试验设计(试验因子与测试水平见表3),以生根率为指标,优化植物生长调节剂添加种类和添加量,以不含任何激素的1/2 MS培养基为对照组。试验共设17个组合,每个组合10瓶,每瓶3个外植体,于28 d后统计生根率。
表1 外植体灭菌的因素与水平
Table 1 Factors and levels for explant sterilization
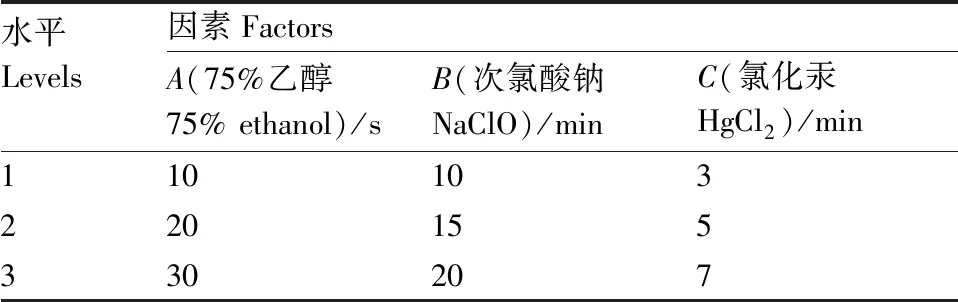
水平Levels因素FactorsA(75%乙醇75% ethanol)/sB(次氯酸钠NaClO)/minC(氯化汞HgCl2)/min110103220155330207
表2 愈伤组织诱导与丛芽发生影响因子和水平
Table 2 Factors and levels for callus induction and clustered shoots induction mg·L-1

水平Levels因素FactorsA(α-萘乙酸NAA)B(6-苄氨基嘌呤6-BA)C(2,4-二氯苯氧乙酸2,4-D)10.310.120.530.230.750.3
表3 不定芽生根的影响因子与水平
Table 3 Factors and levels for rooting mg·L-1

水平Levels因素FactorsA(α-萘乙酸NAA)B(6-苄氨基腺嘌呤6-BA)C(活性炭Activated carbon)10.31120.53230.753

1.3 数据分析
采用Excel 2007进行数据整理,SPSS 20.0进行方差分析,Design-Expert. V8.0.6.1进行响应面处理。
2 结果与分析
2.1 外植体灭菌
如表4和表5所示,3个因素对外植体存活率影响大小依次为75%乙醇>次氯酸钠>HgCl2,对照组R值大于HgCl2,小于75%乙醇和次氯酸钠,说明75%乙醇和次氯酸钠对外植体存活率影响显著。表6显著性分析也表明,75%乙醇和次氯酸钠在兰州百合外植体的灭菌、保证外植体存活方面具有极显著影响(P<0.01),而HgCl2的影响较小(P>0.01)。结果表明,采用75%乙醇和次氯酸钠溶液消毒外植体是防治污染、保证外植体存活的关键因素。通过以上分析可以看出,防止外植体污染,提高存活率的最佳组合为A2B1,即75%乙醇灭菌20 s+次氯酸钠溶液浸泡10 min,外植体存活率可达96.30%。
表4 外植体灭菌存活率正交试验设计方案与结果
Table 4 Orthogonal experiment design and result of explant sterilization survival rate

培养基Medium试验设计方案Experiment designABCD存活率Survival rate/%1111117.30±3.09212229.60±2.12313336.30±0.814213296.30±0.815221379.30±7.076232169.60±0.817312384.30±0.818323181.00±2.059331270.00±2.44
表5 极差分析结果
Table 5 Result of range analysis

因素Factorsk1/%k2/%k3/%R/%最优水平Optimal levelA(75%乙醇11.0681.7378.4370.66275% Ethanol)B(次氯酸钠65.9756.6348.6317.331NaClO)C(氯化汞HgCl2)55.9758.6356.632.662D(对照Control)55.5354.5061.206.70
2.2 植物生长调节剂对愈伤组织诱导与丛芽发生的影响
表7为愈伤组织诱导与丛芽发生正交试验结果。由表8的R值可以看出,NAA(29.68)和6-BA(18.58)为外植体诱导愈伤组织的最主要影响因子,其次是2,4-D(5.9),3个因素的极差值都大于对照组(4.42)。由k值可以看出,因素A(NAA)的最优水平为A1,因素B(6-BA)的最优水平为B2。方差分析(表9)表明NAA和6-BA对诱导兰州百合外植体愈伤组织分化有极显著影响(P<0.01),2,4-D的影响较小(P>0.01)。同时NAA和6-BA的平方和远大于2,4-D,且大于对照组,说明诱导外植体愈伤组织分化的最佳激素组合为A1B2,所以愈伤组织诱导的最佳培养基配方为MS+0.3 mg·L-1NAA+3 mg·L-16-BA,愈伤组织诱导率最高达96.33%。
由表8中k值可以看出,2,4-D对丛芽发生的促进作用较小,NAA和6-BA是主要的影响因子,3个因素对丛芽发生的影响大小依次为NAA>6-BA>2,4-D。方差分析(表10)显示,NAA和6-BA对诱导外植体发芽方面有极显著影响(P<0.01),2,4-D则影响较小(P>0.01)。因此,与诱导外植体愈伤组织分化的最佳激素组合一样,诱导愈伤组织发芽的最佳激素配比也是A1B2,最佳培养基配方为MS+0.3 mg·L-1NAA+3 mg·L-16-BA,发芽率可达98.00%。
表6 外植体灭菌存活率方差分析结果
Table 6 Variance analysis results of explant sterilization survival rate
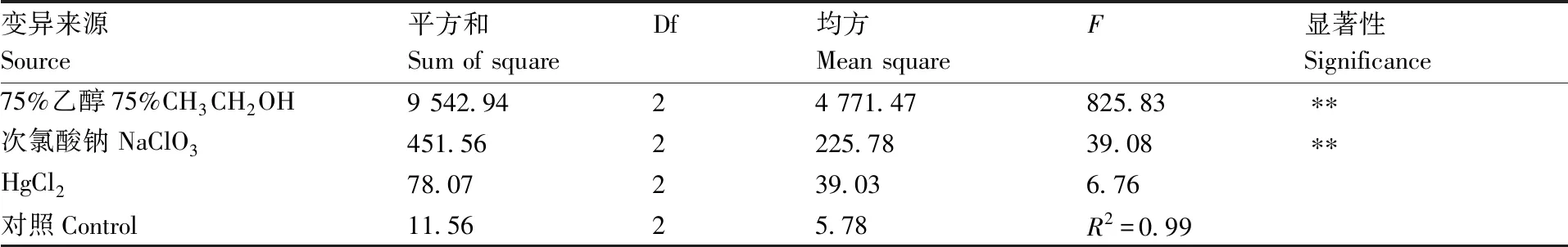
变异来源Source平方和Sum of squareDf均方Mean squareF显著性Significance75%乙醇75%CH3CH2OH9 542.9424 771.47825.83∗∗次氯酸钠 NaClO3451.562225.7839.08∗∗HgCl278.07239.036.76对照Control11.5625.78R2=0.99
Df,自由度。“**”表示在0.01水平上差异显著。下同。
Df, Degree of freedom. “**”indicated the significant difference at 0.01 level. The same as below.
2.3 植物生长调节剂对不定芽生根的影响
2.3.1 多元二次方程模型的建立与检验
选择3个对生根影响显著的因素:NAA、6-BA和活性炭,进行兰州百合不定芽诱导响应面分析试验。根据Box-Beknhen中心组合原理设计
表7 愈伤组织诱导与丛芽发生正交试验设计方案与结果
Table 7 Orthogonal experiment design and result of callus and clustered shoots induction

序号No.试验设计方案Experiment designABCD愈伤组织诱导率Rate of callus induction/%丛芽发生率Rate of clustered shoots induction/%1111185.30±1.6986.30±0.942122296.33±0.8198.00±0.473133384.30±1.2481.60±0.814212374.00±0.4773.00±1.245223182.00±1.6983.00±1.246231256.00±2.4454.33±1.247313260.00±2.4456.00±1.248321367.30±1.2466.00±0.819332149.60±0.8150.00±0.81
表8 极差分析结果
Table 8 Result of range analysis了17组试验,包括5组重复试验,结果如表11所示。
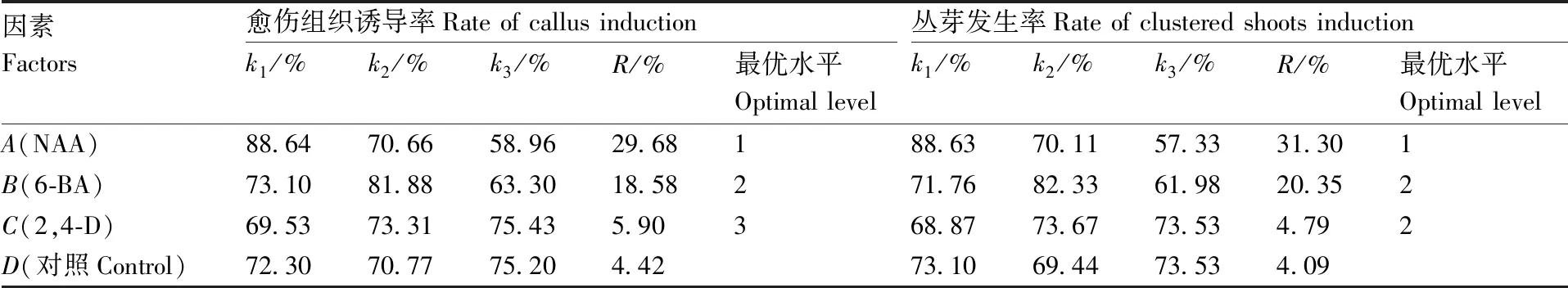
因素Factors愈伤组织诱导率Rate of callus inductionk1/%k2/%k3/%R/%最优水平Optimal level丛芽发生率Rate of clustered shoots inductionk1/%k2/%k3/%R/%最优水平Optimal levelA(NAA)88.6470.6658.9629.68188.6370.1157.3331.301B(6-BA)73.1081.8863.3018.58271.7682.3361.9820.352C(2,4-D)69.5373.3175.435.90368.8773.6773.534.792D(对照Control)72.3070.7775.204.4273.1069.4473.534.09
表9 愈伤组织诱导率方差分析结果
Table 9 Analysis of variance of callus induction rate

变异来源Source平方和Sum of squareDf均方Mean squareF显著性SignificanceA(NAA)1 340.752670.3825.02∗∗B(6-BA)518.162259.089.67∗∗C(2,4-D)30.3215.150.565误差Error53.58226.791
表10 丛芽发生率方差分析结果
Table 10 Analysis of variance of clustered shoots induction rate

变异来源Source平方和Sum of squareDf均方Mean squareF显著性SignificanceA(NAA)1 486.052743.0233.28∗∗B(6-BA)621.902310.9513.929∗∗C(2,4-D)30.29215.140.678误差Error44.65222.32
利用Design-Expert.V8.0.6.1软件对表11中的试验数据进行多元回归拟合,得到生根率(Y)与植物生长调节剂NAA(A)、6-BA(B)和活性炭(C)的实际值全变量二次多元回归方程为:
Y=89.54+4.91B+14.9C-25.28×A2-38.33×B2-21.41×C2。
由表12可以看出,本模型所选用的二次多项模型具有显著性(P<0.01),说明该试验方法是可行的。本模型的二次方程能够模拟真实3因素3水平的试验结果,其决定系数R2=0.925 5,RAdj=0.829 7,说明二次多项模型可解释92.55%的响应值变化,仅有总模型的7.45%不能用该二次多项式解释,表明此模型拟合度好,解释本试验方法是可靠的,适合用于兰州百合的生根优化。
由表13可以看出,模型所选用的二次多项式模型在1%水平内极显著(P<0.01),表明该试验方法是可行的。交互项BC在5%水平内显著(P<0.05),表明6-BA和活性炭两因素交互作用对兰州百合外植体生根有显著的影响,A2和B2都在1%水平内极显著(P<0.01),说明NAA和6-BA对兰州百合生根影响极显著,C2在1%水平内不显著(P>0.05),说明活性炭对兰州百合生根影响较小。
2.3.2 响应面分析和优化
响应曲面图可直观反应出各因素之间交互作用的强弱,响应曲面坡度越陡峭,说明各因素间的交互作用越显著,响应曲面越平缓,说明各因素的交互作用越弱。图1-A为6-BA和NAA之间的交互作用,当6-BA作用浓度一定时,随着NAA浓度的增加,生根率先增加后减小,响应曲面显著,有明显峰值;图1-B为6-BA和活性炭之间的交互作用,当6-BA浓度一定时,随着活性炭浓度的增加,生根率先增加后减小,过高的活性炭浓度会抑制生根率;图1-C为NAA和活性炭之间的交互作用,生根率随着两者浓度的增加先升高后降低,有明显的最大值。
表11 Box-Behnken试验设计与结果
Table 11 Box-Behnken design and the experimental result

培养基Medium植物激素Plant hormoneA(NAA)/(mg·L-1)B(6-BA)/(mg·L-1)C(活性炭Activated carbon)/(mg·L-1)生根率Rooting rate/%C10.53291.00±2.05C20.51173.30±1.24C30.53294.00±0.47C40.53286.33±0.81C50.33369.60±6.53C60.53287.30±2.05C70.51329.60±6.53C80.75223.00±0.81C90.73356.30±6.53C100.53388.60±2.05C110.55155.00±2.05C120.33130.00±2.05C130.55123.30±0.81C140.73123.00±2.16C150.31225.70±1.88C160.35226.40±0.81C170.71228.00±0.81
表12 二次多项模型方差分析结果
Table 12 Variance analysis for the fitted quadratic polynomial model
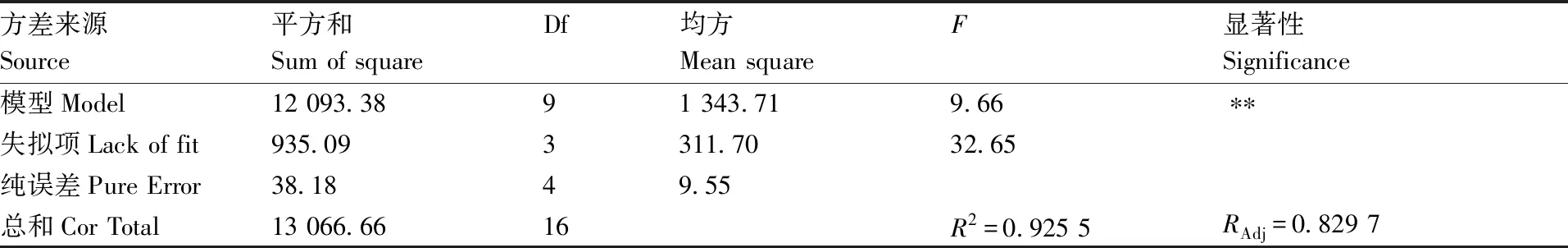
方差来源Source平方和Sum of squareDf均方Mean squareF显著性Significance模型Model12 093.3891 343.719.66∗∗失拟项Lack of fit935.093311.7032.65纯误差Pure Error38.1849.55总和Cor Total13 066.6616R2=0.925 5RAdj=0.829 7
表13 响应面回归方程系数显著性检验结果
Table13Regression coefficients and their significance of the quadratic model

方差来源Sources of variance平方和Sum of squareDf均方Mean squareFP显著性Significance模型Model12 093.3891 343.719.660.003 4∗∗A44.65144.650.320.588 6B104.401104.400.750.414 9C426.321426.323.070.123 4AB8.1218.120.060.815 9AC19.36119.360.140.720 1BC1 421.2911 421.2910.220.015 1∗A24 260.6614 260.6630.640.000 9∗∗B24 274.0714 274.0730.740.000 9∗∗C2635.511635.514.570.069 8
“**”表示在0.01水平上差异显著;“*”表示在0.05水平上差异显著。
“**”indicated the significant difference at 0.01 level; “*”indicated the significant difference at 0.05 level.

图1 各因素响应面3D图Fig.1 3D response surface of each factor
2.3.3 模型验证试验
Design-Expert. V8.0.6.1软件分析结果显示,各因素的最优值为:NAA(A)=0.50 mg·L-1,6-BA(B)=3.13 mg·L-1,活性炭(C)=2.35 mg·L-1,理论生根率为92.29%。但实际操作中C3培养基的生根率达94%,超过预测值,说明用响应面法优化兰州百合外植体生根条件是可行的。
2.4 优化后的兰州百合组培过程
兰州百合组培主要分为外植体灭菌、愈伤组织诱导、发芽和生根4部分,图2是采用本研究优化的最佳消毒方法和培养基进行兰州百合组培的结果。其中,图2-A中外植体经75%乙醇消毒20 s+2%次氯酸钠溶液浸泡10 min,未发生污染;图2-B和图2-C为最佳培养基MS+0.3 mg·L-1NAA+3 mg·L-16-BA中兰州百合外植体的愈伤组织诱导和发芽情况;图2-D为最佳培养基1/2 MS+0.5 mg·L-1NAA+3 mg·L-16-BA+2 mg·L-1活性炭中兰州百合的生根情况。
3 结论与讨论
本试验中,不对外植体做任何消毒处理的对照组存活率几乎为0%,没有样品产生愈伤组织,7 d内无外植体存活,但经过消毒剂处理的样品,存活率最高可达96.30%,这与梁小敏等[13]的研究结果吻合,说明消毒在组培试验中是控制植物组培死亡率的关键。不同消毒剂组合对外植体存活率影响不一[14],常用的消毒剂有乙醇、次氯酸钠溶液、过氧化氢、HgCl2溶液等[15-17]。本研究使用了3种消毒剂相互组合,通过与对照组比较,确定外植体消毒的主要影响因素为乙醇和次氯酸钠溶液,次要影响因素是HgCl2溶液。有报道指出,最适合垂花百合外植体的消毒剂组合是70%乙醇处理30 s+0.1% HgCl2溶液浸泡12 min[18],周非[19]研究发现,药百合的最佳消毒剂为70%乙醇;本研究结果与此一致,但本研究中乙醇浓度为75%,另一消毒剂为消毒效果更强的次氯酸钠溶液,推测可能是本试验在冬季进行,取材不是植物生长的最佳季节,相较于HgCl2溶液,次氯酸钠在溶液中释放出的氯离子可以更有效的杀死菌体,从而提高外植体存活率。

A,消毒后的外植体;B,愈伤组织诱导;C,丛芽发生;D,生根诱导。A, Sterilized explants; B, Callus induction; C, Clustered shoots induction; D, Rooting induction.图2 兰州百合组培过程Fig.2 Tissue culture of Lanzhou lily
百合植物组织培养过程中较常用的植物生长调节剂有NAA、6-BA和2,4-D等[20]。本研究发现,在愈伤组织诱导和不定芽分化的试验中,NAA和6-BA是显著影响因子,2,4-D对愈伤组织诱导和不定芽分化影响较小,这与前人研究结果一致。极低浓度的植物生长调节剂就能够对外植体生长起明显的促进作用[21]。有研究发现,在培养基中添加0.2 mg·L-1的NAA对百合愈伤组织诱导和发芽都有明显的促进作用[22],本试验得出的结果与此一致;但柳玉晶等[23]发现,最适合东方百合的NAA质量体积分数为1 mg·L-1,这与本试验的结果相差较大,分析可能原因为不同品种百合所适用的植物生长调节剂浓度略有不同,也可能是因为本试验是在冬季进行的,外植体尚处在休眠期,需要提高NAA的浓度来促进愈伤组织诱导和不定芽分化。研究发现,普通的植物生长调节剂同样对组培苗根的发育有促进作用[24]。本研究在常规植物生长调节剂的基础上加入活性炭,并用响应面分析的方法探究其对外植体生根的影响。结果表明,适宜浓度的活性炭可显著提高外植体的生根率,这是因为活性炭在提供暗环境的同时可以有效吸附培养基中的抑制物,这与潘得林等[25]的研究结果一致。但是当浓度不合适时,反而会抑制生根率[26-27],本研究中也遇到了类似问题;例如表11中的C7组合,当活性炭浓度最大时生根率仅有27.60%,C8培养基中生根率仅为23.00%,可能是活性炭在吸附培养基中抑制物的同时,也会吸附培养基中的植物生长调节剂,导致根系不能吸收足够的营养成分,从而降低生根率。活性炭对生根培养的具体作用机理,有待今后进一步研究。
综上,获得成活率高的组培苗可以从以下2方面着手:第一,尽量选取当季新鲜的外植体,外植体消毒可选用不同消毒剂组合消毒,但时间不可过长。第二,后续愈伤组织诱导、发芽和生根的过程中,组培苗对激素的反应较灵敏,选择合适的激素浓度配比会显著提高成活率。

