BmNPV对家蚕不同组织ALP活性及其基因表达的影响
高建华,杨大平,杨伟克,丁志伟
(云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661101)
【研究意义】碱性磷酸酶(alkaline phosphatase, ALP)能催化磷酸酯的水解,参与磷酸基团的转移和代谢,几乎存在于昆虫机体的各个组织及器官,不仅参与昆虫机体的能量代谢、生长发育、激素合成及滞育等过程,而且在对杀虫剂解毒代谢及病原微生物免疫防御过程发挥了重要作用[1-2]。ALP酶活力与家蚕的生理状况密切相关,激活ALP酶活性既能增强蚕体的抗逆性,而且有助于提高蚕丝产量和质量[3-4]。研究家蚕遭受家蚕核型多角体病毒(Bombyxmorinuclear poyhedro virus, BmNPV)侵染后机体ALP酶活性及其基因的变化规律,明确碱性磷酸酶在家蚕抗病毒过程中发挥的功能和作用,为阐明BmNPV的侵染机制及培育抗BmNPV蚕品种的选育提供借鉴和思考。【前人研究进展】昆虫遭受病原菌侵染时,机体不仅会通过先天性免疫防御系统产生抗菌肽等免疫活性物质,抵御抑制或杀灭病原微生物[5];而且由于机体的正常生理代谢平衡被打破,水解酶、氧化酶、解毒酶等相关酶的活性均会发生不同程度的变化[6]。碱性磷酸酶被认为是一类与昆虫抗性密切相关的水解酶[7]。Leclair等人用螟硫磷处理云杉色卷蛾,机体ALP基因在处理早期显著上调表达,酶活性也显著高于对照组[8]。对除虫菊酯类杀虫剂具有抗性的棉铃虫幼虫ALP基因的表达量显著高于敏感品系,组织表达谱显示ALP主要在中肠、血淋巴和脂肪体等免疫器官有高表达[9-10]。于欢等研究发现棉铃虫在HearNPV侵染早期,体内ALP酶活性增加,侵染后期ALP酶活性显著减低,ALP活性的下降与病毒抑制其编码基因ALP的表达水平有关[11]。苏云金芽孢杆菌或黑胸败血芽孢杆菌感染家蚕早期,中肠ALP基因上调表达,酶活性被激活,随着感染时间的延长,中肠组织受损,机体免疫防御功能下降,其ALP活性急剧降低[12-13]。低剂量的微孢子虫N.B感染家蚕4龄幼虫,机体ALP酶活性会迅速升高,随后急剧降低;而用致病力弱的SCM6病原感染家蚕,碱性磷酸酶活性会显著增加,暗示碱性磷酸酶在抵御病原微生物侵染过程发挥了一定的功能,但具体作用机制不清楚[14]。【本研究切入点】家蚕核型多角体病毒以家蚕为寄主,诱发蚕体发生血液型浓病,传染性极强,严重制约了蚕桑产业的发展[15]。关于家蚕抗BmNPV的研究虽然已有许多报道,但BmNPV与宿主的相互作用机制至今仍未能解析清楚。碱性磷酸酶作为昆虫机体一类重要的调控酶,既参与机体磷酸基团的转移和水解,还参与机体对外源化合物的解毒代谢及抵御病原微生物的侵染过程[16]。但遭受BmNPV侵染时,蚕体碱性磷酸酶活性及其基因的表达变化规律的研究相对较少。【拟解决的关键问题】以家蚕ALP为研究对象,经口感染BmNPV,探析家蚕机体碱性磷酸酶活性及其基因的表达变化规律,以期为深入研究和阐明BmNPV的致病机制及宿主与病毒之间的互作关系提供新线索。
1 材料与方法
1.1 供试材料
家蚕品种为菁松×皓月,恒温培养箱26 ℃,新鲜桑叶饲育。
主要仪器:Tana 1220 凝胶成像系统,荧光定量PCR仪,BioTek Synergy 2多功能酶标仪。主要试剂:动物组织总RNA抽提试剂盒(OMEGA公司,货号R6834-02),反转录试剂盒(TaKaRa公司,货号RR047A),荧光定量试剂Hieff qPCR SYBR®Green Master Mix(上海翊圣生物科技有限公司,货号11201ES03)。BCA蛋白测定试剂盒(Beyotime公司,货号P0010S)。碱性磷酸酶活性测试盒(南京建成生物有限公司,货号A059-1)。
1.2 试验方法
1.2.1 添食病毒及样品采集 参照唐芬芬等[17]文献报道的方法,选取生长发育良好的家蚕幼虫,在5龄起蚕时进行喂食BmNPV,每头家蚕经口添食10 μl(4.85×108个/mL)病毒悬液,以添食等量的PBS缓冲液为对照组。添食后,相同条件下用新鲜桑叶饲育。取添食后3、6、9、12和24 h家蚕的血淋巴、脂肪体和中肠,对照组同时取材,每次取样均设5次重复,每个重复取6头蚕,样品收集后置于-80 ℃保存备用。
1.2.2 酶活性测定 取家蚕中肠组织和脂肪体,用PBS缓冲液清洗2~3次,置于电动匀浆器中匀浆5 min,4 ℃,3500 r/min,离心15 min,上清液即为待测酶液。家蚕血淋巴直接在4 ℃条件下,4500 r/min,离心20 min,弃沉淀留上清液,即为待测酶液。根据BCA蛋白测定试剂盒和碱性磷酸酶测试盒说明书,分别测定蛋白含量及酶活性。
1.2.3 基因表达分析 按照高纯总RNA快速提取试剂盒操作步骤提取家蚕血淋巴、脂肪体和中肠总RNA。紫外分光光度计测定RNA样品浓度,并反转录为cDNA。以家蚕Ribosomal protein 49(RP49,登录号:NM_001098282)为内参基因,碱性磷酸酶基因(NCBI登录号:NM_001044071.3)为靶标基因,利用Primer Premier 5.0引物设计软件设计定量引物。由生工生物工程(上海)股份有限公司合成引物,序列见表1。
荧光定量PCR方法参照Hieff qPCR SYBR®Green Master Mix试剂盒操作说明进行。反应体系20 μl,设定程序:95 ℃,30 s →(95 ℃,5 s →60 ℃,30 s)40个循环→65 ℃,5 s(然后每次加0.5 ℃,直到95 ℃,5 s)。ABI公司StepOne荧光定量PCR扩增仪记录实验结果,每个样品均设4次重复,根据公式2-△△CT计算基因的相对表达量。

表1 实时荧光定量PCR引物
1.3 数据分析
利用Excel 2019和SPSS 21.0对数据进行处理。
2 结果与分析
2.1 家蚕感染BmNPV后ALP基因的表达变化
实时荧光定量PCR检测了喂食BmNPV后,家蚕血淋巴、脂肪体和中肠碱性磷酸酶基因的相对表达量,将喂食灭菌水的对照组各个基因的相对表达量设定为1,喂食BmNPV组各基因的相对表达量若大于1,表明该基因上调表达,反之则下调表达。如图1所示。在感染BmNPV后3和6 h,血淋巴ALP基因的相对表达量无显著变化,在感染9和12 h时持续上调表达,相对表达量分别是对照组的1.9和2.2倍;而在感染24 h血淋巴ALP基因的表达受到抑制,呈下调表达趋势。脂肪体ALP基因在感染3、6和9 h无明显变化,仅在12 h被上调表达,相对表达量为对照组的2.25倍;在24 h表达量略有降低,为对照组的70 %。中肠ALP在BmNPV感染3 h,相对表达量接近1,无明显变化;在感染6 h时,基因开始上调表达,相对表达量逐渐增加,感染12 h时表达量最高,随后基因表达量急剧减弱,在24 h表达量降至最低,为对照组的55 %。
2.2 BmNPV对家蚕不同组织碱性磷酸酶(ALP)活性的影响
如图2所示,在BmNPV感染3和6 h,血淋巴的ALP活性略高于对照组,但差异未达到显著水平;在9和12 h ALP活性分别是对照组的3.1和3.3倍,差异达到极显著水平(P<0.01);在24 h,ALP活性显著低于对照组(P<0.05)。由图3可知,在BmNPV感染12 h,ALP活性最高为对照组的2.7倍,较对照组差异极显著(P<0.01);在24 h ALP活性低于对照组,但差异不显著。图4结果显示,感染BmNPV,家蚕中ALP的活性在3 h较对照组无显著变化,在6 h ALP活性显著高于对照组(P<0.05),9 h和12 h ALP活性均是持续高于对照组,差异达到及显著水平(P<0.01),而在感染24 h ALP活性极显著低于对照组(P<0.01)。整体呈现一个先逐渐升高,达到一个峰值,随后急剧降低的趋势。

图1 喂食BmNPV后家蚕不同组织ALP基因的表达量变化Fig.1 Expression of ALP in different tissuse of silkworm after infection by feeding BmNPV
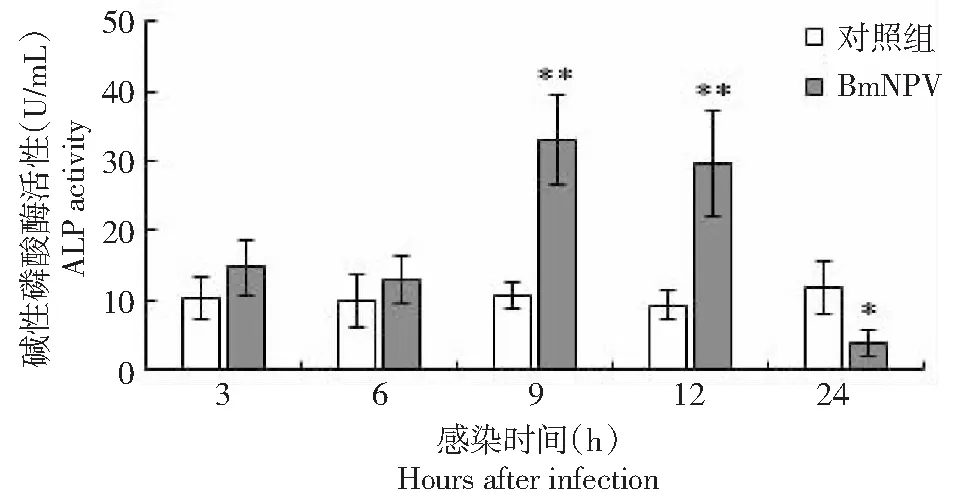
* P <0.05,** P <0.01,表示BmNPV感染与对照组比较,下同*(P <0.05) and **(P <0.01) indicated BmNPV infection compared with the control group, the same as below图2 喂食BmNPV后家蚕血淋巴碱性磷酸酶酶活性变化Fig.2 Changes of ALP activity in hemolymph of silkworm after feeding BmNPV

图3 喂食BmNPV后家蚕脂肪体碱性磷酸酶酶活性变化Fig.3 Changes of ALP activity in fat body of silkworm after feeding BmNPV
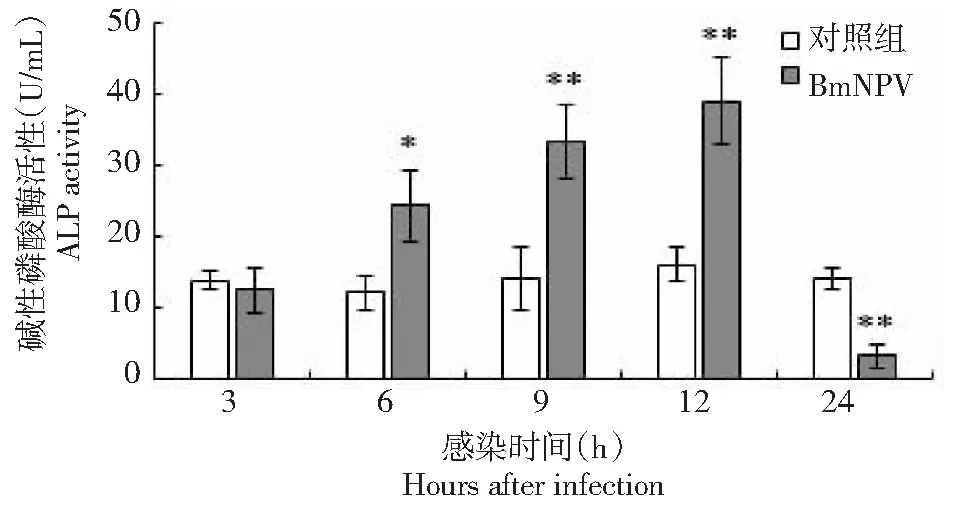
图4 喂食BmNPV后家蚕中肠碱性磷酸酶酶活性变化Fig.4 Changes of ALP activity in midgut of silkworm after feeding BmNPV
3 讨 论
碱性磷酸酶被认为是一类与昆虫抗性密切相关的水解酶,在外源化合物和杀虫剂的解毒代谢及抵御病原微生物的防御过程均发挥了重要作用。用低浓度的螟硫磷处理云杉色卷蛾12 h,虫体碱性磷酸酶活性及其基因表达均会显著增加,机体抗性增强[8]。用菊酯类杀虫剂处理赤拟谷盗,ALP活性在处理24 h后显著增加[18]。对除虫菊酯类杀虫剂具有抗性的棉铃虫品系,其ALP活显著高于敏感品系[9-10]。HearNPV病毒感染棉铃虫,宿主中肠碱性磷酸酶活性与病毒感染剂量及感染时间成正相关。低剂量的HearNPV感染棉铃虫前期,会显著增强碱性磷酸酶活性,而在感染后期ALP活性会显著降低[11]。用质型多角体病毒(Cytoplasmicpolyhedrosisvirus, CPV)和苏云金芽孢杆菌(Bacillusthuringiensis,Bt)感染家蚕,在感染早期,ALP活性会增强,而感染后期,由于中肠组织造受一定的损伤,其ALP活性急剧降低[12-13]。用致病力较强的微孢子虫N.B感染4龄家蚕,其中肠碱性磷酸酶活性显著降低;而用致病力弱的SCM6病原感染家蚕,碱性磷酸酶活性会出现一定程度的升高[14]。
本研究结果表明,在感染BmNPV早期,家蚕不同组织的碱性磷酸酶活性及ALP基因表达量均有一定程度的升高,随着感染时间的延长,ALP基因表达受到抑制,编码的碱性磷酸酶活性也相应的降低。家蚕感染BmNPV后,机体不同组织的碱性磷酸酶基因对病毒响应的时间存在一定差异,经口添食BmNPV,病毒首先侵染中肠,随后进入血淋巴,最后才侵染脂肪体,所以经口感染BmNPV,中肠在侵染6 h时,ALP基因开始显著上调,酶活性随之增高;血淋巴的碱性磷酸酶及其基因在感染9 h才开始增加;而脂肪体仅在感染12 h,ALP基因上调表达,编码的碱性磷酸酶活性也随着增强。另外,经口感染BmNPV,中肠和血淋巴ALP基因在感染早期无显著变化,感染中期开始显著上调表达,后期急剧下调表达,整体呈现出先增加后急剧减弱的趋势,编码的碱性磷酸酶活性变化规律与基因表达变化趋势基本一致。
4 结 论
经口感染BmNPV,家蚕中肠、血淋巴和脂肪碱性磷酸酶活性及其基因的表达量在感染中期增加,感染后期会急剧减弱,暗示ALP与BmNPV对蚕体的侵染存在一定的相关性,推测其可能参与了家蚕抗BmNPV的防御过程,但作用机制有待进一步的研究探索。

