林麝源肺炎克雷伯氏菌新LysR家族转录因子的原核表达
赵位 喻东 程建国

关键词:林麝;肺炎克雷伯氏菌;kp05372基因;原核表达
林麝(Moschus berezoviskii)为《濒危野生动植物种国际贸易公约》附录Ⅱ和国家一级保护动物,其雄性分泌的麝香为名贵的中药材和高级动物香料,具有重要的社会价值和经济价值。人工养殖是林麝资源保护的主要对策之一,我国从1958年开始人工养殖林麝,历经半个多世纪,发展仍较缓慢。影响林麝人工养殖的一个重要原因是林麝化脓性肺炎疾病的发病率和死亡率高[1]。林麝患化脓性肺炎后前期一般不易发现,发现时已经处于较严重阶段,基本上无救治希望[2]。引起圈养林麝化脓性肺炎的病原菌种类繁多,包括大肠杆菌、沙门氏菌、肺炎链球菌、巴氏杆菌、绿脓杆菌、金黄色葡萄球菌和肺炎克雷伯氏菌等多种病原[3-4]。
肺炎克雷伯氏菌(Klebsiella pneumoniae)属于肠杆菌科克雷伯菌属。自Friediander(1882年)首次从病人的肺组织中分离得到该菌后,在大熊猫、疣猴、金丝猴和林麝等多种珍稀动物体内均分离得到该菌[5-8]。该菌为条件性致病菌,在机体免疫力下降或长期使用抗生素导致菌群失调时,可引起人或动物感染肺炎、脑膜炎、肝脓肿、肠炎、腹膜炎等多种疾病[9]。在肺炎克雷伯氏菌基因组中分布着大量转录调节因子,其中LysR家族转录因子是最大的调节蛋白家族[10],其调控的目的基因参与了细菌的毒力、新陈代谢、运动性、抗氧化、黏附和分泌等[11]。前期研究中,课题组在患化脓性肺炎和腹泻林麝的肠道中分离出1株肺炎克雷伯氏菌,该菌株对小鼠具有强致病性,全基因组测序分析发现,该菌株基因组序列中有1段序列大小为909 bp的编码序列(登录号:KX026659),命名kp05372,通过生物信息学方法分析发现,该基因为1个新的LysR家族转录因子,可能具有LysR家族转录因子相似的功能[12]。因此,本研究拟通过对该基因进行原核表达,以期为该基因的功能研究奠定基础。
1 材料与方法
1.1 试验菌株与质粒
林麝源肺炎克雷伯氏菌菌株由笔者所在实验室保存;感受态大肠杆菌DH5α和BL2(DE3),购自天根生化科技有限公司;克隆载体pMD19-T sample载体,购自大连TaKaRa公司;表达载体 pET-32a(+) 为笔者所在实验室保存。
1.2 主要试剂
细菌基因组DNA提取试剂盒及DNA Marker(DL2000)、DNA纯化回收试剂盒、质粒抽提试剂盒、SDS-PAGE凝胶试剂盒、Western Blot试剂盒;限制性内切酶KpnⅠ、EcoRⅠ、D2000 plus DNA ladder、Trans 2K plus ⅡDNA Marker、蛋白质Marker、DNA T4连接酶、PVDF膜、考马斯亮蓝R250、IPTG和2×SDS凝胶上样缓冲液、抗His标签单克隆抗体、二抗(兔抗鼠)等。
1.3 pMD19-T/kp05372重组克隆载体构建与鉴定
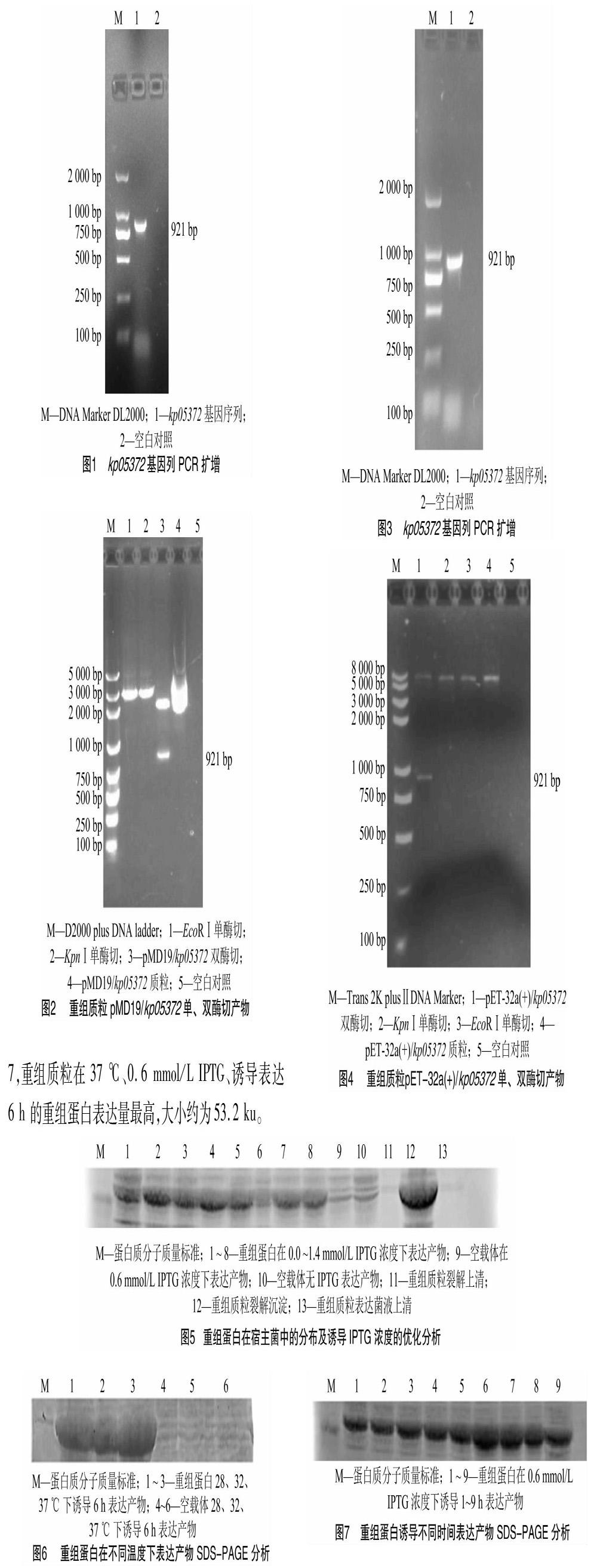
运用Primer 5.0和Oligo 6.0设计扩增kp05372基因的特异性引物(P1:5′-GGTACCATGAACGGGATCAGTTTCAACC-3′,下划线碱基为KpnⅠ酶切位点;P2:5′-GAATTCTTAGCTGCGACGCTCCTG-3′,下划线碱基为EcoRⅠ酶切位点)。以GPKP菌株DNA为模板,进行kp05372基因的PCR扩增。PCR反应体系为:2×Taq PCR Master Mix 12.5 μL,10 mmol/L P1引物1.0μL,10 mmol/L P2引物 1.0 μL,DNA模板 10 μL,ddH2O 9.5 μL。PCR 反应程序为:94 ℃预变性5 min;94 ℃变性30 s,63 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min,4 ℃保存。将扩增产物进行电泳、胶回收和测序,测序结果与目标序列进行比对、验证,然后利用T4连接酶将其与pMD19-T载体16 ℃连接过夜,将连接產物转化至E.coli DH5α感受态细胞中,然后取100 μL涂于含0.1 mg/mL氨苄青霉素(Amp)的LB培养基上,37 ℃恒温培养16 h后,挑取单菌落分别接种于LB液体培养基中,37 ℃恒温振荡16 h。随后分别提取质粒,以P1、P2为引物,进行PCR和用KpnⅠ、EcoRⅠ单、双酶切验证。
1.4 pET-32a(+)/kp05372重组表达质粒构建与鉴定
利用KpnⅠ和EcoRⅠ酶对重组克隆质粒pMD19-T/kp05372和表达质粒pET-32a(+)双酶切。pMD19-T/kp05372质粒37 ℃酶切2 h,pET-32a(+) 质粒37 ℃酶切12 h,电泳分离酶切产物,然后胶回收目的片段,16 ℃连接过夜。连接反应体系如下:目的片段5.0 μL;pET-32a(+)片段1.0 μL;T4 Ligase 0.5 μL;T4 Ligase Buffer 1.0 μL;H2O 2.5 μL。最后将连接产物转入感受态细胞E.coli DH5α,涂布于含0.1 mg/mL Amp的LB固体培养基,于37 ℃培养箱中培养12 h,分别挑取阳性克隆菌株,提取质粒进行PCR和KpnⅠ、EcoRⅠ单、双酶切验证,对鉴定正确的重组表达质粒送公司进行测序。
1.5 重组蛋白的诱导表达及条件优化
将pET-32a(+)/kp05372重组质粒阳性E.coli BL21(DE3)接种于含0.1 mg/mL Amp的LB液体培养基中,37 ℃温度振荡培养至D600 nm约为0.6,分别加入IPTG至终浓度为0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mmol/L,诱导培养4 h,各取菌液 1 mL。同时,取部分IPTG浓度为0.6 mmol/L菌液离心,收集上清,用Tris-HCl(pH值=8.0)洗涤沉淀,超声波裂解菌体,离心,收集沉淀。同时,在IPTG浓度0.6 mmol/L组设置28、30、37 ℃温度梯度及1、2、3、4、5、6、7、8、9 h的诱导时间梯度。最后,分别在0.6 mmol/L菌液上清、裂解上清、裂解沉淀、不同IPTG浓度菌液、不同诱导时间菌液、不同温度梯度菌液沉淀样品中,加入25 μL PBS和 25 μL 2×SDS凝胶上样缓冲液,混匀后沸水煮 5 min,10 000 r/min 离心1 min,取10 μL上层液体SDS-PAGE电泳,经考马斯亮蓝R250染色后脱色,利用凝胶成像系统分析目的蛋白的表达情况。同时,设置诱导的空载体pET-32a(+) BL21(DE3)转化菌作为对照。

