卡络磺钠氯化钠注射液对重症脑血管病合并神经源性肺水肿治疗效果初探
陆晓炯 陈 峰 王 英 马建新 赵素民*
(1. 火箭军特色医学中心呼吸内科,北京 100088;2. 火箭军特色医学中心重症医学科,北京 100088)
神经源性肺水肿(neurogenic pulmonary edema,NPE)是指无原发心、肺、肾等疾病的情况下,由于中枢神经系统(central nerve system,CNS)损伤导致的急性肺水肿,又称“中枢性肺水肿”或“脑源性肺水肿”[1-2]。NPE是重症脑血管病常见的临床综合征,也是严重威胁患者生命的合并症之一。患者通常起病急骤、病情进展速度快,若治疗不及时,短期内可发展为脓毒症及多器官功能障碍综合征[3]。重症脑血管病合并NPE的发病机制尚未完全明确,目前提出的可能机制包括血流动力学学说、肺毛细血管渗透性学说、炎性反应学说、冲击伤理论、血管内血液凝固性增加后毛细血管通透性增加等[1-2,4-5]。目前,尚未有明确有效的药物可以改善重症脑血管病合并NPE的预后,降低患者的病死率。卡络磺钠作为一种毛细血管稳定剂[6],不仅可以降低肺血管通透性、改善低氧血症[7-8],还具有抑制过度炎性反应的作用[9]。本研究拟将卡络磺钠用于重症脑血管病合并NPE患者的治疗,观察对此类患者入住重症监护室(intensive care unit,ICU)情况、血流动力学及炎性反应指标的影响,旨在为临床治疗重症脑血管病合并NPE提供新的治疗策略。
1 对象与方法
1.1 研究对象
选取2016年1月至2019年12月期间火箭军特色医学中心重症医学科确诊的40例重症脑血管病合并NPE的患者为研究对象,采用数字表法将患者随机分为治疗组和对照组,每组各20例。治疗组患者中男性11例,女性9例,年龄35~81岁,平均年龄(58.95±14.05)岁,格拉斯哥昏迷评分量表(Glasgow Coma Scale,GCS)评分3~10分,平均(6±3.06)分,包括脑出血11例,蛛网膜下腔出血6例,脑梗死3例。对照组患者中男性14例,女性6例,年龄47~81岁,平均年龄(63.35±12.03)岁,GCS 评分3~15分,平均(6.25±3.23)分,包括脑出血11例,蛛网膜下腔出血4例,脑梗死5例。本研究经本中心伦理委员会批准,伦理批准文号:KY2016-034-02。所有患者均充分知情,签署知情同意书并自愿参加该研究。
1)纳入标准[10-11]:①经头颅电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)检查后确认存在重症脑血管病(颅内压升高);②无原发心肺疾病;③突然发生的呼吸困难,呼吸频率大于35次/min,出现以上特征及口唇紫绀、口鼻涌出大量粉红色泡沫痰,两肺急剧出现大量湿啰音,消退迅速;④胸片提示间质性改变或肺纹理增粗,肺门蝴蝶状或肺内斑片状阴影等指征;⑤动脉血氧分压<60 mmHg(1 mmHg=0.133 kPa),氧合指数<200。
2)排除标准:①急慢性心力衰竭、心肌梗死、严重肝肾功能不全;②处于休克状态或血流动力学不稳定;③有血液病病史;④过敏体质。
1.2 研究方法
1.2.1 分组方法
将纳入研究的患者按住院顺序抽取号码,采用随机数字表法按1∶1比例分为治疗组和对照组。两组患者入院时的年龄、性别、发病至接受治疗的时间以及急性生理与慢性健康评分(Acute Physiology and Chronic Health Evaluation,APACHE)Ⅱ等基线情况比较差异均无统计学意义,具有可比性。
1.2.2 治疗方法
两组患者按照标准化治疗流程[12-13],给予有创机械通气辅助呼吸、静脉注射呋塞米减轻心脏负荷、静脉注射抗生素预防感染、纠正电解质紊乱和酸碱平衡紊乱状态、镇静镇痛、纤维支气管镜肺泡灌洗、降低颅内压等基础治疗。治疗组患者给予卡络磺钠氯化钠注射液100 mL静脉滴注,每8 h给予1次,连续治疗3 d。
1.2.3 临床疗效
记录两组患者撤机时间、抗生素使用时间、ICU住院时间及病死率、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)发生率等。
1.2.4 检测指标
分别于治疗前、治疗第2、4、8天时抽取患者外周静脉血2 mL,检测血液中C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、白细胞(white blood cell,WBC)、中性粒细胞百分比(neutrophil percent,NEUT%)。采用Seldinger法置入锁骨下中心静脉导管、股动脉导管,温度探头与中心静脉导管连接,将压力传感器与经肺热稀释测定技术(pulse indicator continous cardiac output,PiCCO)机器连接。换能器压力调零,参考点置于腋中线第4肋间心房水平。从中心静脉导管注射8 ℃以下冰0.9%(质量分数)氯化钠注射液15 mL,通过热稀释法测量血管外肺水指数(extravascular lung water index,EVLWI)[14]和肺血管通透性指数(pulmonary vascular permeability index,PVPI)[15],连续测量3次取平均值。分别记录治疗前、治疗第2、4、8天时EVLWI、PVPI水平。
1.3 统计学方法

2 结果
2.1 治疗后临床疗效比较
治疗组患者撤机时间、抗生素使用时间、ICU住院时间均短于对照组,病死率和MODS发生率低于对照组,差异均有统计学意义(P<0.05)。详见表1。
表1 治疗组、对照组临床疗效的比较
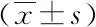

ItemControl groupTreatment groupt/χ2POffline period/d12.90±2.7910.05±3.65-2.775 0.0009Duration of antibiotics/d22.50±10.1514.95±5.46-2.930 0.006Duration of ICU stay/d17.95±8.2012.35±5.06-2.600 0.013Mortality/%3553.906 0.048Incidence of MODS /%4055.161 0.023ICU: intensive care unit; MODS: multiple organ dysfunction syndrome.
2.2 治疗前、后血流动力学指标比较
两组患者治疗前、治疗第2天EVLWI比较,差异无统计学意义(P>0.05);治疗第4、8天时,治疗组患者EVLWI低于对照组,差异有统计学意义(P<0.05)。两组患者治疗前、治疗第2、4天PVPI比较,差异无统计学意义(P>0.05);治疗第8天时,治疗组患者PVPI低于对照组,差异有统计学意义(P<0.05)。详见表2。
表2 两组患者治疗前、治疗第2、4、8天EVLWI及PVPI比较
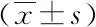
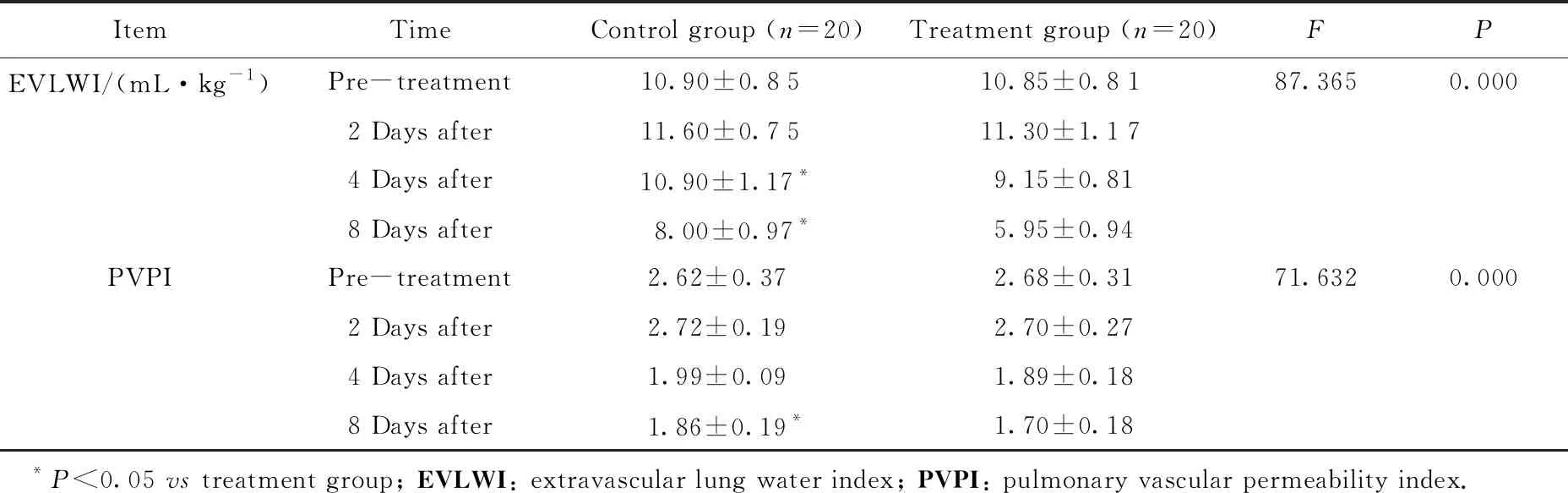
ItemTimeControl group (n=20)Treatment group (n=20)FPEVLWI/(mL·kg-1)Pre-treatment10.90±0.85 10.85±0.8187.3650.0002 Days after11.60±0.75 11.30±1.174 Days after 10.90±1.17*9.15±0.818 Days after8.00±0.97*5.95±0.94PVPIPre-treatment2.62±0.37 2.68±0.3171.6320.0002 Days after2.72±0.19 2.70±0.274 Days after 1.99±0.09 1.89±0.188 Days after1.86±0.19* 1.70±0.18 *P<0.05 vs treatment group; EVLWI: extravascular lung water index; PVPI: pulmonary vascular permeability index.
2.3 治疗前、后炎性反应指标比较
两组患者治疗前CRP、WBC、NEUT%比较,差异无统计学意义(P>0.05);治疗第2、4、8天时,治疗组患者CRP、WBC、NEUT%低于对照组,差异均有统计学意义(P<0.05)。两组患者治疗前、治疗第2、4、8天PCT比较,差异无统计学意义(P>0.05)。详见表3。
3 讨论
近年来,随着脑血管病发病率逐渐上升,其继发的多脏器损害越来越受重视。NPE在脑血管病患者,尤其是重症患者中较为常见。重症脑血管病合并NPE的特点是起病急,进展快,持续时间短,病死率高[3],因此需尽早诊断并治疗,通过及时有效地降低肺水肿程度,缓解氧合障碍,改善预后。重症脑血管病合并NPE的发病机制比较复杂,目前临床上比较认可的主要有循环动力学学说、肺血管通透性学说、炎性反应学说等[1-2,4-5]。重症脑血管病易造成颅内压升高,引起下丘脑功能和交感神经紊乱,合成并释放大量儿茶酚胺,出现体循环阻力增加、血容量增多,使得高阻力的体循环转向低阻力的肺循环,肺循环内血容量增多,肺静水压升高,导致肺毛细血管通透性升高,引发肺水肿[16-17]。支持肺血管通透性学说的研究者[11]认为,NPE发生时,大量儿茶酚胺可直接损伤肺毛细血管床,使肺通气/血流比例失调,引起氧合障碍,同时激活并释放大量细胞因子,肺毛细血管通透性进一步受损,从而出现肺部浸润性水肿。支持炎性反应学说的研究者[18]则认为,重症脑血管病后肺巨噬细胞被激活,释放趋化因子,诱导中性粒细胞在肺内聚集活化,中性粒细胞黏附在肺毛细血管内皮表面,通过释放氧自由基等代谢产物引起肺损伤;肺巨噬细胞被激活后,还释放大量炎性反应因子,直接参与损伤肺组织,从而引起肺水肿。
表3 两组患者治疗前、治疗第2、4、8天CRP、PCT、WBC及NEUT%比较
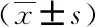

ItemTimeControl group (n=20)Treatment group(n=20)FPCRP/(mg·L-1)Pre-treatment144.33±30.81137.96±48.6156.5080.0002 Days after147.13±33.82* 108.26±22.374 Days after 101.02±39.28* 57.75±14.418 Days after 42.62±14.15* 17.62±10.06 PCT/(ng·mL-1)Pre-treatment4.76±6.794.79±1.3511.4700.0002 Days after4.84±1.463.83±0.894 Days after 2.07±1.121.08±0.608 Days after0.96±1.100.15±0.16 WBC/(×109·L-1)Pre-treatment12.97±1.7612.94±2.9340.8360.0002 Days after14.00±3.34* 11.62±2.574 Days after 9.40±1.21* 7.94±1.078 Days after7.80±1.17* 5.96±0.85NEUT%Pre-treatment85.15±5.01 87.22±3.3055.8670.0002 Days after86.74±5.14*80.04±7.134 Days after 79.55±4.88*65.10±9.618 Days after72.43±2.87*59.78±8.08
*P<0.05vstreatment group;CRP: C-reactive protein;PCT: procalcitonin;WBC: white blood cell;NEUT%: neutrophil percent.
卡络磺钠是一种毛细血管稳定剂,临床上用于治疗毛细血管脆性增加导致的出血。其药理学作用包括[8,19]:①增强毛细血管弹性;②降低毛细血管通透性;③增进毛细血管断裂端的回缩;④稳定毛细血管及周围组织中的酸性黏多糖。研究[7]证实,卡络磺钠可以浓度依赖性的减少由缓激肽和凝血酶刺激产生的三磷酸肌醇,对血管内皮屏障功能起到强力的稳定作用,同时逆转类胰蛋白酶、凝血酶和缓激肽造成的内皮屏障失调,而不影响钙离子载体增强的内皮通透性。卡络磺钠还可以通过抑制内皮细胞磷脂酰肌醇水解,阻断各种血管活性物质引发的血管通透性增高[20]。在急性肺损伤/急性呼吸窘迫综合征的实验模型中,研究者[7-8]发现卡络磺钠可以降低肺血管通透性以及改善低氧血症。最近一项研究[9]显示,卡络磺钠尚有抑制过度炎性反应的作用,主要表现为降低炎性介质水平,减少炎性反应因子产生和分泌,减轻组织肿胀。药效试验[21]也提示卡络磺钠显著减少血管炎性渗出。鉴于肺毛细血管通透性受损、过度炎性反应是重症脑血管病合并NPE发生发展的重要因素以及卡络磺钠降低毛细血管通透性、抑制过度炎性反应的作用[22],本研究拟纳入重症脑血管病合并NPE的患者,在接受规范治疗的同时给予卡络磺钠治疗,以探查卡络磺钠在重症脑血管病合并NPE发生发展中的作用。
本研究结果显示,治疗组临床疗效明显,肺水肿减轻;血流动力学方面,EVLWI、PVPI减少;血清学炎性反应相关标志物表达降低。由此可以推断,卡络磺钠早期治疗重症脑血管病合并NPE可能是通过稳定血管内皮屏障,降低肺毛细血管通透性,使肺内毛细血管渗漏下降,肺内渗出有效减少;另一方面提示,卡络磺钠可以下调炎性反应因子水平,减少白细胞尤其是中性粒细胞聚集,抑制过度炎性反应,最终均表现为临床症状得到改善,机械通气、抗生素使用时间及入住ICU时间缩短,合并症及病死率下降,既提高了临床疗效,也降低了重症监护费用。
综上所述,卡络磺钠应用于重症脑血管病合并NPE的患者效果显著,可以明显降低肺毛细血管通透性损害,抑制过度炎性反应,缓解症状,提高临床疗效。未来在临床中应对本研究结果进一步验证推广,以及在科研中探索卡络磺钠治疗重症脑血管病合并NPE的具体机制。
——过敏性休克和肺水肿的抢救流程

