门诊消化系统疾病患者幽门螺杆菌感染状况分析
董 方 陈 东 商建峰 方 微 滕 飞 张睿祺
(首都医科大学附属北京安贞医院病理科,北京 100029)
幽门螺杆菌(Helicobacterpylori,Hp)是感染率较高的致病菌,与慢性胃炎、胃溃疡及胃癌等消化系统疾病发生和发展均相关,1994年被国际癌症研究中心列为Ⅰ类致癌物,发现并根除Hp可治愈或延缓上述疾病[1-3]。研究[4]显示,全球人群Hp感染率高达50%,防治Hp感染是一个严峻且迫在眉睫的公共卫生问题。研究[5-6]显示Hp的毒力差异因菌株亚型不同而不同,Ⅰ型Hp菌株含有CagA基因,即细胞毒素相关蛋白,表达CagA和VacA,为高毒力菌株;Ⅱ型Hp为不产生细胞毒素菌株,即CagA和VacA阴性株,为低毒力菌株;因此Ⅰ型感染主张根除治疗,部分Ⅱ型感染者可暂不抗菌治疗,随访观察,分子分型同时也与菌株的耐药性相关。目前关于Hp的检测方法有很多种,如13C尿素呼气试验、血清学检测、组织学及免疫组织化学检测、快速尿素酶及细菌培养方法[7],各种检测方法均有其局限性及其优势。TaqMan分子探针法检测作为一种新的检测Hp技术,其特异度及灵敏度均优于其他检测技术,而且可以通过分子检测对Hp分子进行分型[8],对感染程度进行分级,从而可以更好地指导临床治疗。本研究将通过统计接受首都医科大学附属北京安贞医院Hp分子检测的患者,筛选出Hp阳性的人群,鉴别I型和Ⅱ型,并对不同月份、不同季节及不同年龄段的感染率进行对比分析,了解门诊消化道疾病患者人群的Hp感染现状,并对相关影响因素进行分析,为本地区制订有效的Hp防治方案提供科学依据。
1 对象与方法
1.1 研究对象
选取2018年4月至2019年9月于首都医科大学附属北京安贞医院就诊的消化系统疾病患者10 839例为研究对象,年龄15~89岁,入选患者均有明显的胃肠道症状,以胃部不适就诊且接受胃肠镜活检。排除1个月内接受过抗 Hp、抗菌药物及H2 受体拮抗剂治疗者。
1.2 研究方法
1)样本:选取患者胃黏膜活检组织蜡块,组织切片厚度为4~6 μm,数量10片,混合后用于DNA提取。
2)DNA提取:使用德国Qiagen公司的石蜡组织DNA提取试剂盒(货号56404)进行DNA提取。所检测的DNA需要紫外分光光度计测定,浓度大于10 mg/μL,A260 nm/A280 nm应在1.7~2.2。
3)Hp阴阳性及感染强度的判断: Hp核酸检测试剂盒[荧光聚合酶链式反应(polymerase chain reaction,PCR)法]购自北京新基永康生物科技有限公司,该试剂盒针对Hp的UreA基因设计特异引物和Taqman荧光探针进行PCR检测,利用受试者工作特征(receiver operating characteristic,ROC)曲线法确定本试剂盒的阳性判断值为35.00,即待检样本的FAM荧光Ct值≤35.00为阳性,Ct值>35.00或Undetermined为阴性。对于鉴定为阳性的Hp,△Ct>3.00,为轻度感染+,0<△Ct<3.00,中度感染++,△Ct≤0.00,重度感染+++。
4)Hp的分子分型鉴定:使用Ⅰ型幽门螺杆菌核酸检测试剂盒(北京新基永康生物科技有限公司)对分型进行鉴定,该试剂盒针对Hp基因组中是否含有CagA基因将Hp分为两型。Ⅰ型Hp,即CagA(+),PCR结果显示Ct值≤35.00,内标RNP≤35;Ⅱ型Hp,即CagA(-),PCR结果显示Ct值>35.00或Undetermined,内标RNP≤35。
1.3 统计学方法
应用 SPSS 19.0 统计学软件,计数资料计算百分率,组间率的比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 消化系统疾病患者Hp感染的年龄、性别分布
10 839例研究对象中,阳性3 659例,阳性检出率为33.76%,其中男性阳性检出率为34.9%,女性为32.7%,性别间阳性检出率差别有统计学意义(P=0.015)。青少年阳性检出率较低(29.27%),随着年龄的增加阳性检出率增高,31~40岁阳性检出率达到最高(40.76%),后呈逐渐降低的趋势,年龄组间阳性检出率差异有统计学意义(P<0.05),详见表1。
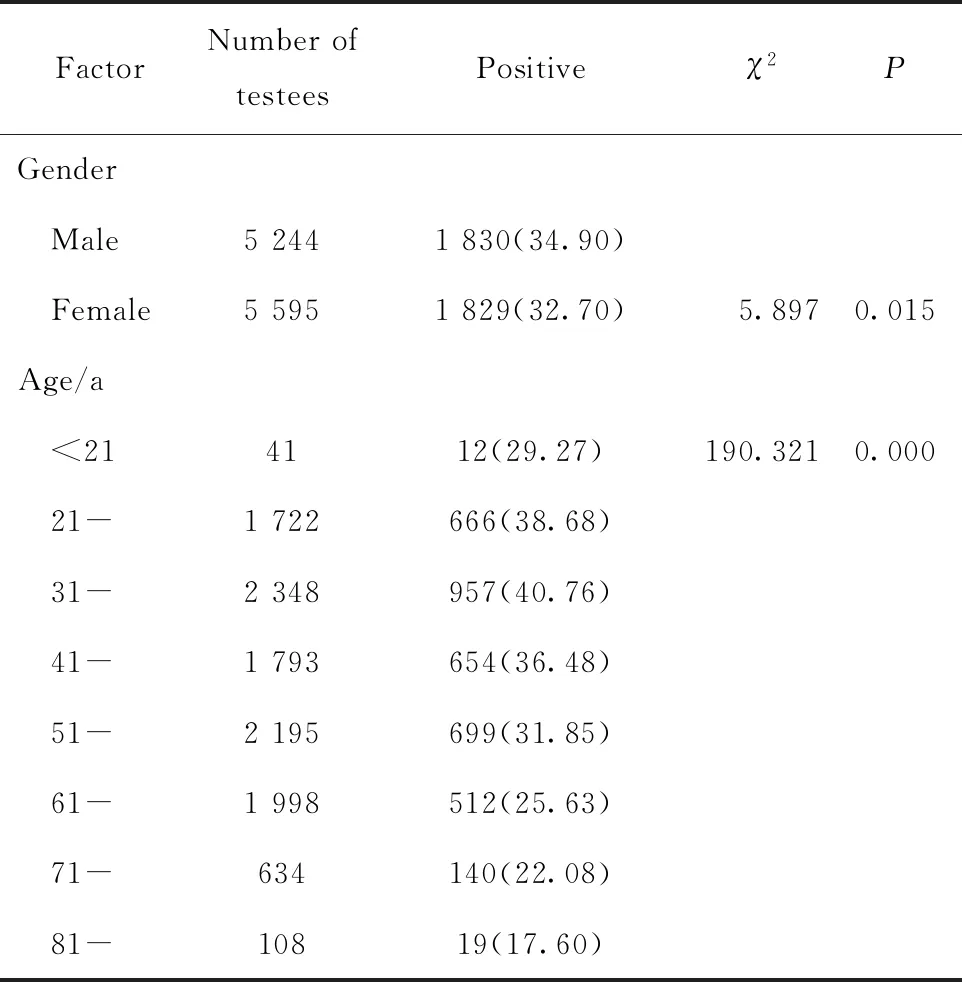
表1 10 839例受检者Hp检出情况分析
Hp:Helicobacterpylori.
2.2 消化系统疾病患者Hp感染的季节及月份分布
图1显示,消化系统疾病患者Hp的阳性检出率在每年夏季(6、7、8月份)最高,检出率为39.02%,明显高出其他季节,差异有统计学意义(P<0.05),详见表2。
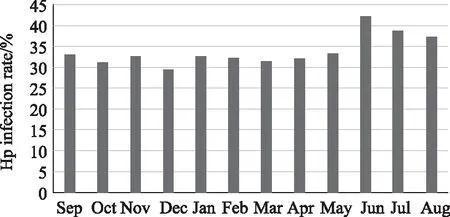
图1 Hp在不同月份的感染率分析
2.3 消化系统疾病患者感染的Hp分子分型分布
分子分型为Ⅰ型的病例共3 285例,占总阳性例数的89.78%,其中男性1 663例,女性1 622例。分子分型Ⅱ型的374例,占总阳性例数的10.22%,远远低于Ⅰ型的检出率。根据严重程度不同,分为轻+,中(++),重(+++)三型,Ⅰ型中度感染程度的人数较多为1 892例;Ⅱ型轻度感染程度的人数较多,为199例。男性I型的检出率较女性高,差异有统计学意义(P<0.05),Ⅱ型检出率差异无统计学意义(P>0.05)。详见表3。
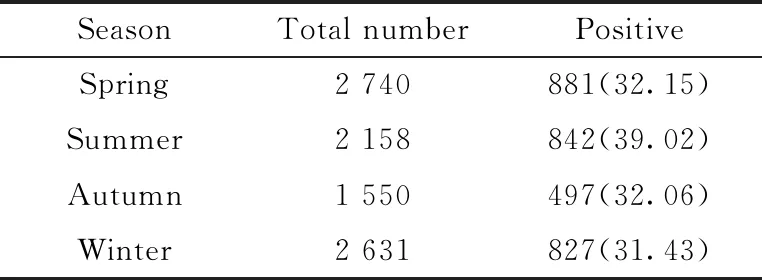
表2 不同季节Hp感染情况比较
χ2=38.152,P=0.000Hp:Helicobacterpylori.

表3 不同性别感染Hp分子分型及严重程度的比较
TypeⅠ:χ2=9.497,P=0.002; type Ⅱ:χ2=2.156,P=0.142;Hp:Helicobacterpylori.
3 讨论
幽门螺杆菌是多种消化系统疾病的致病因素,其引起胃病的发生机制主要包括以下几个方面:① Hp感染后导致胃泌素与生长抑素失衡,引起胃酸分泌异常;其代谢产物NO等诱导胃上皮细胞凋亡的增加可能与胃炎、胃溃疡的发生机制相关[9]。② Hp分泌的毒力因子,毒素相关基因A可导致胃黏膜受损[10];同时Hp会刺激加速肿瘤坏死因子与白介素的释放,加剧炎性反应的发生。③Hp是一种硝酸盐还原剂,能够促进硝酸盐向亚硝酸盐转化,进而引起胃黏膜出现癌变[11];④ Hp感染造成的患者胃黏膜慢性炎使得黏膜上皮细胞增生加快,造成黏膜上皮细胞过度增生,从而引发畸变导致癌症[12]。
影响幽门螺杆菌感染的相关的因素有很多,比如饮食、性别、抽烟、季节等[13-14]。在本文中笔者着重探讨了检出率在不同性别、不同年龄段及不同季节的差别,本文的研究显示男性胃肠道疾病患者的Hp感染率高于女性,这可能与男性嗜好饮酒、抽烟有关,且已有研究[15-16]表明饮酒抽烟可以影响Hp的感染率;其次本研究显示其感染率与患者的年龄及季节有关。患者在30~40岁年龄段检出Hp的数量最多,推测可能与此年龄段的患者由于工作性质在外就餐机会比较多,容易感染Hp。另外Hp的检出率在6、7、8月份较高可能是由于6、7、8月份是每年中最热的季节,人们的饮食习惯发生改变,会较多食用一些生冷食品、烧烤制品、啤酒以及聚餐引起的交叉感染;除此之外,这三个月的温度和湿度使Hp容易在食物中存活,导致Hp通过食物感染患者的概率增大。
目前国内外关于Hp的检测方法有很多种,包括非侵入性检测和侵入性检测,非侵入性检测方法包括13C-尿素呼气实验、血清学方法检测,唾液和粪便的PCR检测;侵入性的检测方法包括快速尿素酶实验,免疫组织化学检测,细菌培养/药敏试验以及本研究所采用的胃镜活检组织DNA探针/PCR检测方法。在非侵入检测方法,13C-尿素呼气实验是其中比较可靠、简便的方法,而且灵敏度高,是大多数检测机构最普遍开展的检测方法,但其检测容易受多种因素影响,特异度较低。免疫组织化学检测作为侵入性检查的一种常用方法,其灵敏度及特异度均较高,但是诊断者之间判断差异较大,而且所需时间较长。本研究所采用的TaqMan探针法分子检测作为一种侵入性检查的新的检测技术,对Hp的UreA基因进行PCR扩增,通过Ct值及△Ct值对Hp是否感染及感染程度进行判断,其特异度及灵敏度均优于其他检测技术,更重要的是可以通过对Hp基因组中是否含有CagA基因将Hp分为高毒力菌株及低毒力菌株两型,从而指导临床医师用药,有效预防耐药对治疗产生的不良影响。
本研究显示个别分子检测Hp的检出结果与13C呼气试验检出结果不同,可能是因为13C呼气试验检测的是整个胃黏膜幽门螺杆菌的感染情况,而胃镜检测的是某一部位Hp的感染情况,取材的局限性可能会造成不能完全反映整个胃黏膜的情况,所以在取材的时候要在病变部位多点取材。另外13C呼气容易受到多种因素的影响,灵敏度高,特异度较低,这也可能是造成其检出结果不同于分子检测的原因[17-18],所以在临床实践中,遇到这种情况,通常可以结合免疫组织化学及组织学检查的方法对患者做出准确的诊断。
综上,针对易导致Hp感染的因素,应积极预防,避免和减少Hp感染的发生;临床上,通过分子分型检测患者 Hp的分型结果,可以指导医生更加有效地用药治疗Hp引起的胃肠道疾病;然而对于一些广泛耐药的Hp,希望将来可以通过基因检测找到治疗的有效靶点。

