结直肠癌中O-型糖基化相关差异基因的筛选及分析
姚健楠 高天博 段 凌 刘 健 蒋玉良 安广宇 葛 洋*
(1.首都医科大学附属北京朝阳医院肿瘤科,北京100020; 2.首都医科大学附属北京朝阳医院医学研究中心,北京 100020)
结直肠癌是全球第3位常见的恶性肿瘤,在肿瘤相关死亡病因中位于第3位[1]。虽然近年来在结直肠癌预防、早期筛查和治疗方面取得了一定进展,但对于病因和发病机制仍然知之甚少[2-3]。多项研究[4-6]显示异常O-型糖基化与结直肠癌有关。笔者前期研究[7-9]表明:结直肠癌中异常O-型糖基化的发生促进肿瘤形成并调节恶性表型,所合成的截短的O-聚糖-Tn抗原,可通过激活上皮-间质转化(epithelial-mesenchymal transition, EMT)促进结直肠癌的转移[9]。前期一系列细胞表型及动物模型实验均证实异常O-型糖基化促进结肠癌发生发展,而修复异常O-型糖基化可明显降低恶性生物学行为能力[7-9]。O-型糖基化是一种常见且重要的翻译后修饰[10-11]。O-聚糖可通过调节蛋白质的结构、稳定性及功能在许多生理和病理过程中发挥不同的作用[11-14]。黏蛋白型O聚糖是O-型糖蛋白的主要亚群,在消化道黏膜上皮中起屏障作用[13, 15-17],研究[18-19]证实,Core 1型O-聚糖表达缺失会导致小鼠自发性结肠炎相关肿瘤发生。异常O-型糖基化表达Tn抗原而非正常合成的T抗原,因此Tn抗原表达是异常O-型糖基化的标志[20]。正常O-型糖基化必需T合酶催化及其特异性分子伴侣Cosmc[14, 20-21],因此T合酶或Cosmc的分子突变、功能异常均会导致O-型糖基化异常并阻碍O-型糖蛋白合成[22]。在结直肠癌中,许多基因mRNA表达有着预测预后及疗效的重要价值[23-25],然而应用现有转录组学数据库却无法得到由O-型糖基化直接调控的基因和通路。
本研究选用人结肠癌LS174T Tn(+)细胞系作为亲本细胞,该细胞T-合酶的分子伴侣Cosmc基因突变导致了异常O-型糖基化发生,以Tn抗原阳性表达为分子标志。此前笔者已通过Cosmc质粒转染技术构建了Cosmc稳定转染细胞系LS174T Tn(+)+wtCosmc,恢复了Cosmc正常表达,原本异常受阻的O-型糖基化过程得到纠正,Tn抗原不表达。与此同时作为对照组,稳定转染空白质粒的细胞系LS174T Tn(+)+Con的Tn抗原仍表达[8]。为探索O-型糖基化这一经典的翻译后修饰过程能否调控相关基因表达,本研究应用Agilent mRNA表达谱基因芯片技术,检测了LS174T Tn(+)+wtCosmc细胞和LS174T Tn(+)+Con细胞基因表达谱。数据经质检及标准化后,针对差异性表达基因(differentially expressed genes,DEGs)进行非监督层次聚类、基因本体(gene ontology,GO)分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集,使之定位在相关生物学过程和细胞通路上,并通过蛋白网络数据库分析其相互作用,探讨结直肠癌进展的分子机制并提供新的治疗靶点。
1 材料与方法
1.1 实验材料
人结直肠癌细胞系LS174T(Tn阳性)由Emory大学Tongzhong Ju教授(美国亚特兰大)赠予。以DEME完全培养基[10%(体积分数)FBS和1%(质量分数)青链霉素]在37 ℃、5%(体积分数) CO2培养箱中进行培养。以人野生型Cosmc基因表达载体(GV367-EGFP-Cosmc,上海吉凯公司)稳定转染LS174 Tn阳性细胞作为实验组[LS174T Tn(+)+wtCosmc],同时用空白载体(GV367-EGFP-Mock,上海吉凯公司)稳定转染细胞作为对照组[LS174T Tn(+)+Con]。
1.2 数据分析流程
基因芯片检测及数据分析流程如图1。
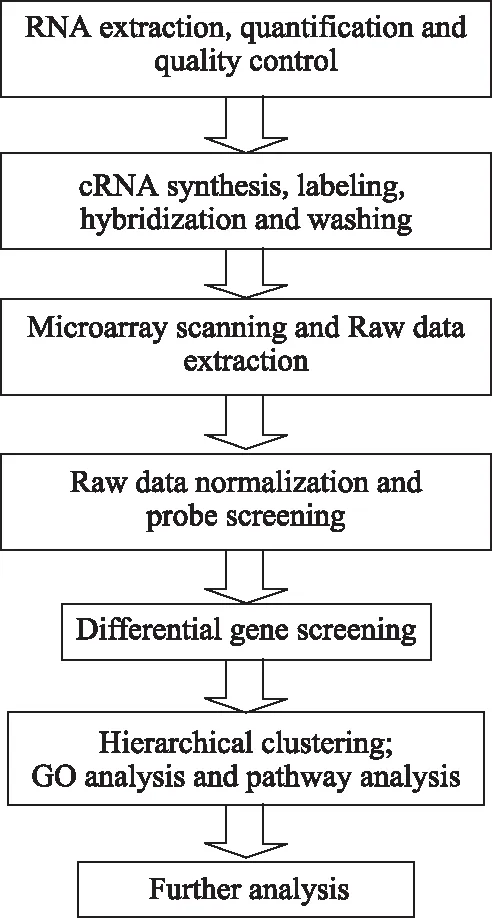
图1 基因芯片检测及数据分析流程图
1.3 总RNA提取及质检
使用TRIzol(Invitrogen公司,美国)提取细胞总RNA,用NanoDrop ND-2000(Thermo Scientific公司,美国)定量,经Agilent Bioanalyzer 2100(Agilent Technologies公司,美国)检测样品总RNA的完整性。
1.4 样本标记及芯片杂交
确认所提取的样本总RNA(每个细胞3组重复,共6个样本)质检合格后,按照Agilent SurePrint G3 Human Gene Expression v2(上海欧易公司)芯片标准流程,将总RNA反转录成双链cDNA,用Cyanine-3-CTP(Cy3)标记碱基合成cRNA,再将cRNA与芯片杂交。洗脱后应用Agilent Scanner G2505C(Agilent Technologies公司,美国)扫描芯片,得到原始图像。
1.5 图像扫描及数据标准化
采用Feature Extraction软件(version 10.7.1.1, Agilent Technologies公司,美国)处理芯片原始图像,提取原始数据,将每个芯片的原始数据导入Genespring软件(version 13.1, Agilent Technologies公司,美国),对原始数据进行标准化(得到原始信号值、标准化信号值、检出情况及详细注释信息)和分析处理。
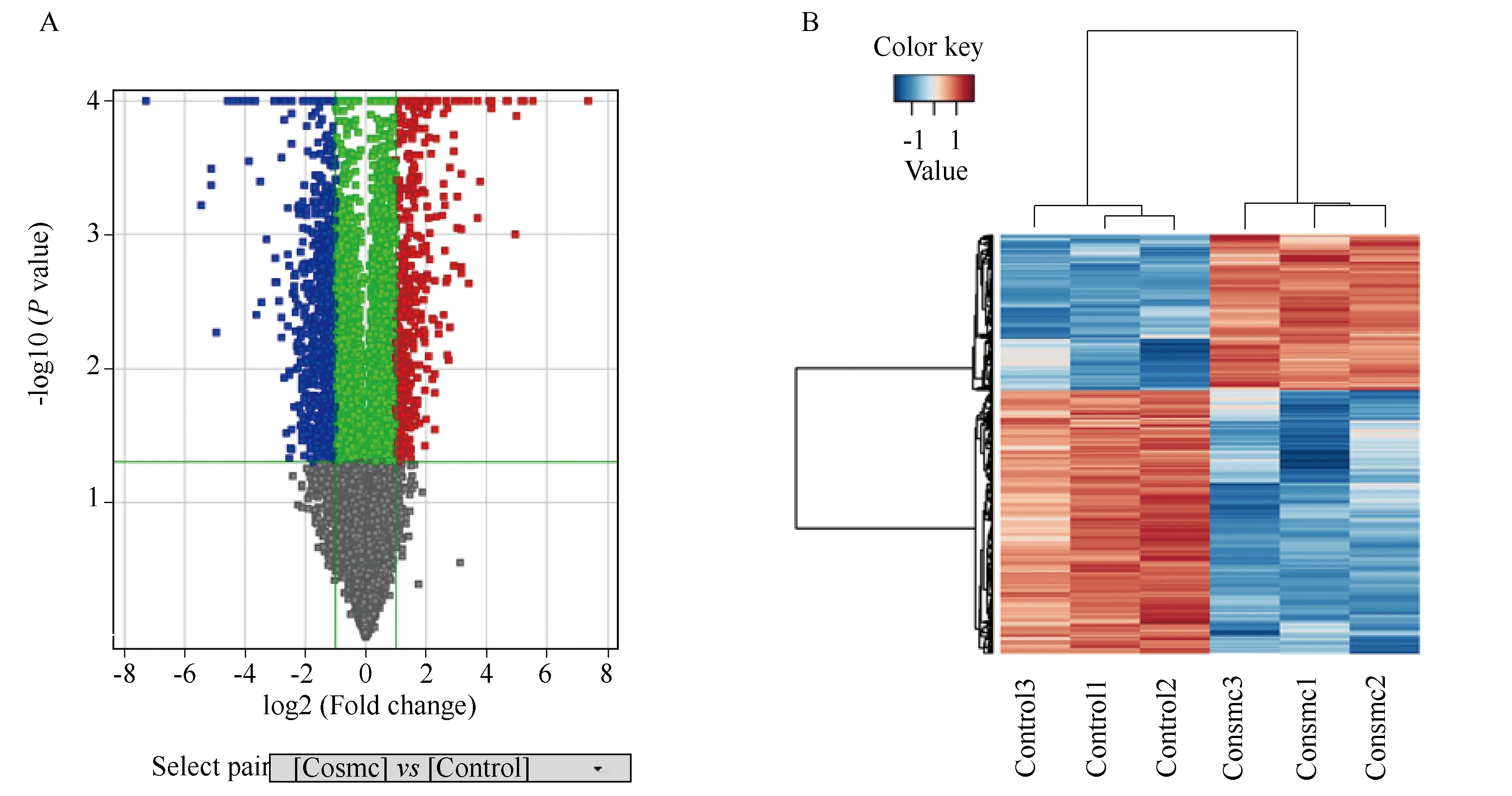
图2 DEGs筛选
1.6 数据处理及鉴定DEGs
应用t检验对实验组LS174T Tn(+)+wtCosmc和对照组LS174T Tn(+)+Con的标准化数据进行两两比较:将过滤得到的具有生物学重复的全部差异基因绘制出火山图(volcano plot)。将P值用错误发现率 (false discovery rate,FDR) 来校正多重测试的差异。筛选标准为上调或下调倍数变化(fold change, FC)绝对值≥ 2.0且FDRP值≤ 0.05。应用R语言对差异基因进行聚类,绘制热图。
1.7 GO分析和KEGG分析
对筛选得到的DEGs通过Wegstalt 在线分析平台(http://www.webgestalt.org/)用基因通路富集(gene set enrichment analysis, GESA)方法进行GO富集分析和KEGG通路分析,分别排列出最密切的正相关和负相关的20条信号通路。
1.8 绘制蛋白-蛋白互作网络示意图
应用在线工具STRING(https://string-db.org/)对差异性表达基因所表达的蛋白之间可能存在的相互作用加以探索,并绘制出蛋白-蛋白互作网络示意图(protein-protein interaction network, PPI)。
2 结果
2.1 DEGs筛选
如前所述,通过Agilent mRNA表达谱基因芯片检测技术得到了实验组及对照组的基因表达谱数据,在两组的表达谱基因芯片标准化数据的差异比较中,将全部有生物学重复数据(即应用t检验得到的)的基因绘制出火山图(图2A),从中筛选出差异性表达基因谱。对于不存在生物学重复样本的数据,则仅利用FC值筛选,标准为FC绝对值≥2.0。本研究得到表达上调基因502个,表达下调基因972个,即差异基因共计1 474个,差异性表达基因谱以热图的形式展示(图2B)。
2.2 DEGs功能富集
为对差异性表达基因所影响的生物学功能进行描述,本研究对上述差异性表达基因谱所包含的1 474个基因进行了GO富集分析,包括所参与的生物学过程(biological process, BP)、在细胞中的定位(cellular component, CC)及分子功能(molecular function, MF)。图3列出正负相关最密切的20个重要结果,为研究重点。在BP中,可富集到:①有丝分裂细胞周期负反馈;②细胞周期G1/S期转变调节;③蛋白质分解代谢、自磷酸化等过程的调控等。在CC中,差异性表达基因主要富集到细胞质膜及胞外基质组分上。MF中:①调节蛋白质酪氨酸激酶活性;②mRNA结合、组蛋白结合;③SMAD蛋白联结;④RNA聚合酶Ⅱ转录因子结合;⑤细胞黏附分子结合、核苷酸结合等功能。
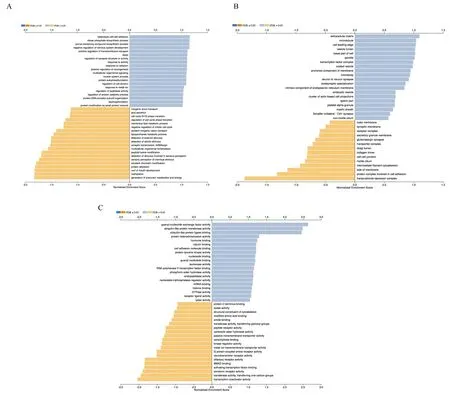
图3 GO富集分析结果
2.3 信号通路富集
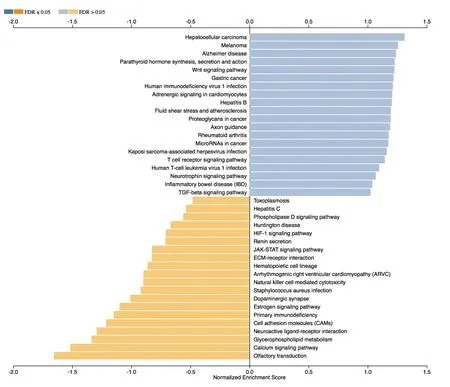
图4 对差异性表达基因进行KEGG Pathway富集结果
应用KEGG数据库对DEGs进行了GESA,根据每个Pathway条目中差异性表达基因富集结果中最密切正负相关的20位Pathway条目绘制出条形图,图4示:DEGs(O-型糖基化相关基因谱)主要被富集在以下相关Pathway上:①肿瘤转录失调;②环磷酸腺苷(cyclic adenosine monophosphate,cAMP)信号通路;③丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路;④转化生长因子-β(transforming growth factor-β, TGF-β)信号通路;⑤T细胞受体信号通路;⑥胞外基质受体相互作用;⑦自然杀伤细胞介导的细胞毒性反应;⑧白细胞穿透内皮细胞发生迁移等。
为进一步探索O-型糖基化相关基因谱与肿瘤发生可能存在的关系及分子机制,笔者又应用R语言heatplot软件包将差异性表达基因富集经典通路结果以热图形式展示(图5)。可见:O-型糖基化与磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)、 TGF-β和Wnt三条肿瘤信号通路密切相关。
2.4 蛋白网络分析
为研究DEGs翻译得到的各种蛋白间的相互作用,笔者应用在线STRING软件(https://string-db.org/,V9.0)对差异性表达基因谱进行了蛋白网络分析。将全部DEGs名称上传至STRING数据库,得到差异性表达基因谱中编码基因可翻译合成的蛋白之间的相互作用关系(图6),可看到黏蛋白家族MUC1、MUC4、MUC17等之间的相互作用关系存在较高的置信度(Confidence≥0.9)。

图6 差异性表达基因合成的蛋白之间的相互关系网络
3 讨论
结直肠癌是一种常见的恶性肿瘤,具有一定的复发风险和转移潜能[26-27]。 尽管近十年来结直肠癌的放射治疗(以下简称放疗)、化学药物治疗(以下简称化疗)和靶向治疗等方面均取得新进展,但发生率和病死率仍居高不下[28-30]。现如今基因组学在结直肠癌的诊断和治疗中发挥着越来越重要的作用[31],但人们对个体遗传改变及其潜在机制仍然知之甚少。因此寻找关键基因和信号通路有助于发现疾病的诊治靶点。O-型糖基化是重要的翻译后修饰过程,已被证实与结直肠癌的发生发展密切相关[7-9, 14, 18]。因此由O-型糖基化引起的分子事件和生物学功能改变值得充分研究。
本研究通过基因表达谱芯片检测技术筛选得到1 474个DEGs,包括502个上调基因和972个下调基因,它们可被视作O-型糖基化直接相关基因。通过GO富集可知,DEGs主要调控细胞外基质组织和生长因子活性等生物过程。KEGG富集显示DEGs主要富集于多种与肿瘤相关的途径,如PI3K、TGF-β和Wnt信号通路。据报道[32-35]这3种经典信号通路在结直肠癌中促进了不同的生理过程。Wnt通路通过影响细胞生长、增生和分化等生命活动参与结直肠癌的发生和发展,该通路的过度激活将导致肠道病变,Wnt通路的异常激活是导致结直肠癌发生、发展的主要原因,且参与了EMT,促进了肿瘤的进展和转移。同样,TGF-β超家族分子通过跨膜受体和胞质内信号转导分子Smad进行信号转导,调节细胞的增生、分化和凋亡。许多生长因子和激素通过其受体激活PI3K,PI3K可以使肌醇环上的3位羟基磷酸化,磷酸化的肌醇脂可招募和激活许多信号通路分子,促进细胞增生、细胞迁移和细胞存活。研究[33]证明 TGF-β 和 PI3K信号通路共同参与调节细胞的增生、凋亡以及迁移等过程,且TGF-β能够诱导EMT表型使得肿瘤更具有侵袭和转移能力。因此抑制上述3个经典通路中的相关成员可为治疗结直肠癌提供新的潜在通路靶点。然而,与其他基因表达谱数据分析共有的瓶颈[36-38]为,关键基因和与O-型糖基化直接密切相关的下游通路无法精确定位,仍需进一步研究探索。在蛋白网络分析结果中,黏蛋白家族MUC1、MUC4、MUC17等之间的相互作用关系存在较高的置信度。其中,MUC4可作用于上皮细胞增生、分化并诱导ERBB2特异性磷酸化[39]。趋化因子受体CXCR4以及其他G蛋白耦联受体家族CXCL1、GPSM1、DRD4、DRD2等同样是介导肿瘤血管形成、转移、活化的关键分子[40]。以上关键基因均可作为后续研究肿瘤O-型糖基化修饰分子机制的重要靶点。
O-型糖基化是一种翻译后修饰过程[14, 41],就基因转录组学水平而言,O-型糖基化并不会直接影响基因转录水平。DEGs的出现可能是由于异常合成O-型糖基化蛋白导致负反馈机制发生,此外,异常O-型糖基化导致关键分子失活,可能干扰其他基因核酸合成过程,但这些假设尚不明确,仍待进一步探讨。
本研究是首次使用转录组学技术预测O-型糖基化相关DEGs的研究,通过对芯片数据的筛选和分析,获得的DEGs为受O-型糖基化调控的下游基因,它们所对应富集的信号通路和生物学功能都是我们后续研究所需密切关注的目标。

