前列腺癌骨转移病人唑来膦酸不同给药间期疗效比较
前列腺癌是男性最常见的非皮肤性恶性肿瘤[1]。骨转移是前列腺癌常见的发病原因。骨转移造成各种骨相关事件(skeletal-related events,SREs),包括骨折、高钙血症、脊髓抑制及严重疼痛[2]。这些骨相关不适增加了姑息性放疗及骨手术的可能,降低了病人生活质量[3-4]。唑来膦酸(zoledronic acid,ZA)为第3 代磷酸盐咪唑衍生物,可抑制破骨细胞活性,阻断破骨细胞介导的骨基质的吸收,同时可以抑制疼痛介质释放,缓解疼痛,降低SREs的发生率[5]。唑来膦酸最佳的给药间隔并不明确。标准给药间隔为每4周1次,来源于经验。本文探讨前列腺癌骨转移病人唑来膦酸每4周1次及每12周1次临床疗效的差异。
对象与方法
一、对象
2016年12月~2018年1月我院收治的前列腺癌骨转移病人52例。纳入标准:(1)病理学诊断为前列腺癌;(2)全身骨扫描诊断为骨转移;(3)血清肌苷<140 μmol/L(即<1.5倍的正常值上限);(4)ECOG评分≤2分;(5)矫正血清钙2.0~2.9 mmol/L;(6)年龄>18岁。排除标准:脑转移;前期(12个月内)接受双磷酸盐、地诺单抗或骨靶向放疗药物治疗;治疗时间未满1年。所有病人均签署知情同意书。52例病人中,唑来膦酸每4周1次组(A组)25例,每12周1次组(B组)27例。两组病人临床基线资料比较,差异无统计学意义。见表1。
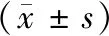
表1 两组病人临床基线资料比较
注:*NRS评分:0无痛,1~3轻度疼痛,4~6中度疼痛;7~10重度疼痛
二、方法
1.治疗方法:在内分泌治疗(皮下注射戈舍瑞林缓释剂 每次3.6 mg,1次/4周;口服比卡鲁胺片每次 50 mg,1次/天)基础上,每100 ml生理盐水加入唑来磷酸(江苏正大天晴药业公司生产)4 mg持续静脉滴注,滴注时间不少于15分钟,分为A组和B组。每个病人加服钙剂(约1200~1500 mg/d)及VitD3(400~800 IU/d)。给药时间1年。
2.随访:随访时间为注射前及治疗0、12、24、36、48、60周。随访指标:SREs(包括病理性骨折、骨放疗或手术治疗、脊髓压迫)发生率;第一次出现SREs时间;骨发病率(skeletal morbidity rate,SMR):任何SRE发生次数除以时间间隔(至少间隔3周);疼痛数字量表(numericalrating,NRS)评价骨痛及镇痛药用量;骨转移标志物(uNTX/Cr ratio);监测和记录所有的副作用:包括严重程度及药物相关性;常规监测血常规、电解质;密切监测颌坏死可能(治疗前行全下颌拍片)、非典型股骨骨折。骨扫描为24周、48周。有效标准:按病人主观痛感改变及镇痛剂用量情况分为4 级。Ⅰ级(无效):疼痛无改变或加重(<25%),镇痛剂用量维持原量或加量。Ⅱ级(好转):疼痛减轻或好转(25%~50%)。镇痛剂用量稍减或维持原量。Ⅲ级(显效):疼痛明显减轻(50%~75%),镇痛剂用量显著减少。Ⅳ级(完全缓解):疼痛基本消失(>75%),停用镇痛剂。Ⅱ+Ⅲ+Ⅳ为有效。治疗后复查骨显像骨转移灶的评价标准分为4级:Ⅰ级(显效):骨显像检查证实所有部位的转移灶出现钙化或消失;Ⅱ级(有效):骨显像显示转移灶数目减少50%以上;Ⅲ级(好转):骨显像显示转移灶数目减少>25%;Ⅳ级(无效):骨显像显示转移灶数目<25%或无变化甚至增多。Ⅰ+Ⅱ+Ⅲ为有效。不良反应按WHO标准分为1~4级。
三、统计学方法

结 果
1.两组临床效果比较:所有病人均完成1年的治疗。A组平均注射唑来膦酸12次,B组为5次。A组中有16例(64.0%)、B组中有9例(33.3%)病人出现治疗拖延,两组间比较差异有统计学意义(P<0.05)。A组中5例(20.0%)、B组中6例(22.2%)出现了至少1个SRE,两组间比较,差异无统计学意义(P>0.05)。两组间首次SRE时间均在30周左右,两组比较,差异无统计学意义(P>0.05)。两组中最常见的SREs为骨放射治疗(A组:B组=2[8.0%]∶2[7.4%],P>0.05),其次为病理性骨折(A组:B组=1[4.0%]∶1[3.7%],P>0.05),差异均无统计学意义,均无明显的颌坏死和确诊的非典型股骨骨折。两组平均SMR值/每年无明显差异(A组∶B组=0.46∶0.50,P>0.05)。NRS评分及及止痛药用量各监测时间点均无明显差异。uNTX/Cr率仅在48周时B组高于A组,其他时间两组无明显差异。骨转移灶缓解:24周及48周时骨扫描显示两组骨转移灶控制情况无明显差异(P>0.05)。见表2。
2.药物相关不良反应:A组7例(28.0%)、B组5例(18.5%)出现药物相关不良反应。最常见的不良反应是发热(A组3例、B组2例),该不良现象常见于施药后12~36 小时, 体温37.0~38.5℃,对症治疗后均缓解。两组均有2例出现血肌酐升高,且均在治疗36周后出现,提示存在剂量累积效应,给予对症处理后均能继续治疗。A组出现1例消化道反应,表现为恶心、食欲下降。B组1例出现低钾血症,但是否与治疗有关很难判定。两组均未出现3级及以上的不良事件。见表3。

表2 两组时间相关的疼痛、uNTX/Cr、骨转移灶缓解情况比较
注:*表示48周时两组,P<0.05

表3 两组不良反应发生率比较[例(%)]
讨 论
晚期前列腺癌骨转移多为姑息性治疗,目的在于缓解骨痛,改善运动机能,预防SREs发生。抗吸收骨靶向治疗药物(bone-targeted agents,BTAs)如唑来膦酸及地诺单抗,均被证实可延缓恶性肿瘤骨转移发生SREs的中位时间及缓解疼痛症状[6]。
针对乳腺癌骨转移的ZOOM试验及OPTIMIZE-2试验中,所有病人预先给予唑来膦酸每4周1次治疗9~15个月后,随机分为每4周1次治疗组及每12周1次治疗组,最终结果显示,两治疗组治疗效果(SRE发生率、SMR、uNTX)及不良反应均无明显差异[7-8]。Andrew等[10]针对1822例未行双磷酸盐治疗的乳腺癌、前列腺癌及骨髓瘤的骨转移病人,给予每1个月1次或每3个月1次唑来膦酸治疗2年,最终结果显示不同恶性肿瘤的骨转移病人,两种不同间期的治疗方式,在SREs、sICTP、分层CMH检验、BPI疼痛评分及不良反应方面,比较发现3个月1次治疗效果不次于1个月1次。本临床研究显示,唑来膦酸每12周1次治疗剂量,对减少前列腺癌骨转移所致SREs发生率不差于每4周1次治疗剂量。两组出现SREs比例无明显差异,SMR两组未有明显差异。
一项针对转移去势抵抗前列腺癌(mCRPC)病人的试验表明,643例病人随机分为唑来膦酸组及安慰剂组,结果表明,唑来膦酸能减少SREs的发生率,缓解骨痛,同时能降低血清BALP水平及减少尿骨吸收标志物(uNTx,吡啶啉、脱氧吡啶啉),对骨转移灶治疗有效,不能改善总生存率[9]。本研究发现,唑来膦酸不论每4周1次还是每12周1次,在标准剂量4 mg下,均能有效缓解骨痛。本研究仍有部分病人疼痛未有缓解,可能与广泛骨转移有关。对于前列腺癌骨转移的病人,建议每天补充钙剂1200~1500 mg和维生素D400~800 IU[11]。
NTX 是1型胶原纤维的分子间交联物质,具有独特的氨基酸序列及交联α2氮端肽,是骨分解破坏特异性最高的指标。uNTX/Cr为肌酐纠正尿N-末端肽为临床检测指标。胡晓晔等[12]针对肺癌为主恶性肿瘤骨转移研究发现,在基线uNTX /Cr水平升高的病人中,唑来膦酸治疗后降至正常者SREs的发病率均低于未降至正常者,基线uNTX /Cr水平与骨转移后生存无显著相关性。ZOOM研究显示,就单独NTX,两治疗组间比较,支持4周/组[7]。本研究显示,两治疗组均能有效控制骨病损进展,在24周及48周时段无明显差异。各时间段uNTX/Cr值,每4周1次组值均低于12周/次组值,但仅48周时差异有统计学意义,仍提示每4周1次组可能优于每12周1次。
唑来膦酸治疗总的耐受性较好,但仍有不良反应。本研究未发现超预期的不良反应,最主要的不良反应为肾毒性,血肌酐的升高。两组各有1例出现了肾损害,其他不良反应均为1~2级,经处理后均能完成治疗周期。有研究显示,尽管12周/次有着更低的积累剂量,但两组不良反应发生率未有明显差异[7,10]。本研究显示,两组不良反应的差异主要表现在消化道及低血钾,但均无统计学差异,且不良反应是否与药物相关不能确定。每12周1次组的依从性高于每4周1次组。每4周1次组病人治疗拖延现象明显,可能与泽泰价格昂贵及病人治疗理念有关。
综上所述,针对前列腺骨转移病人,唑来膦酸治疗每12周1次治疗效果不差于每4周1次。本研究为单中心研究,样本量较小,随访时间不足,不能判断两组生存率及相关时效积累指标,且未行进一步指标分层对照。期待多中心大样本临床研究证实。

