驴源罗伊氏乳杆菌的安全性评价
王卓,冯培祥,李光玉,刘晓颖,郭肖兰,司华哲,姜桂苗,赵付伟,刘晗璐※
(1.中国农业科学院特产研究所,吉林省特种经济动物分子生物学省部共建国家重点实验室,吉林 长春 130112;2.聊城大学驴产业科技协同创新中心,山东 聊城 252000;3.国家胶类中药工程技术研究中心,东阿阿胶股份有限公司,山东 聊城 252201)
关键字:驴源;罗伊氏乳杆菌;安全性
益生菌是指能够产生抗菌物质或者能够产生对生物体有益的活性物质,对于动物健康或提高免疫力有积极作用[1-2]。在无抗饲养的大环境下,畜禽饲用益生菌产品亟待开发。乳酸菌是益生菌中应用最广泛的菌种之一[3-4]。益生菌株发挥益生作用时存在来源特异性、种属特异性和菌株差异性[5],为开发驴源益生菌制剂,本研究从东阿黑毛驴肠道中分离、筛选出一株罗伊氏乳杆菌L2-2。益生菌作为一类活性微生物,必须满足其不具有致病性的前提,特别针对新型的益生菌菌株,安全性评价是一项很重要的基础工作[6-7]。小鼠是药物筛选性试验、毒性试验和安全评价试验最常用的动物,避免了动物数量需求大、宰杀取样困难的限制[8]。本研究以小鼠为研究对象,对驴源罗伊氏乳杆菌L2-2进行小鼠安全性检验,测量小鼠体重和采食量,检测脏器指数、血液学指标、细菌易位情况,以期判断其作为益生菌的可行性,为开发驴源益生菌制剂提供理论依据。
1 材料与方法
1.1 试验菌株
罗伊氏乳杆菌(L2-2),由本研究从健康驴肠道中分离并鉴定。取活化的受试菌株接种到MRS液体培养基中,37 ℃培养18 h,以5 000 r/min,4 ℃离心10 min,用生理盐水调整有效活菌数为5 1010CFU/mL。
1.2 试验动物
健康ICR 小鼠,体重18~22 g,由长春市亿斯实验动物技术有限责任公司提供,动物质量合格证号为SCXK-(吉)2016-0003。
1.3 急性经口毒性试验
参照《食品安全国家标准急性经口毒性试验》(GB 15193.3-2014)[9]要求进行试验。随机选取雄性小鼠24 只,分为2 组,每组各12 只,分别为对照组和罗伊氏乳杆菌组,其中,对照组小鼠灌喂生理盐水,罗伊氏乳杆菌组小鼠灌喂剂量为1 1010CFU/mL 的菌液,每天9:00 经口灌胃1 次,剂量为0.2 mL/只,连续灌胃7 d。每天观察并记录小鼠的行为、中毒表现、腹泻情况和死亡情况。每隔2 d 称体重,饲喂7 d 称重后摘眼球采血1 mL,每组4 个血液样本置于EDTA 抗凝管内,用于血液细胞分析;另外8 个血液样本置于促凝固管中,用于血液生化指标分析。小鼠脱颈椎处死后进行解剖检查,称重肝脏、脾脏、肾脏和胸腺,按照以下公式计算其脏器指数:脏器指数=脏器质量(mg)/体质量(g)100。
1.4 细菌易位试验
经口毒性试验结束后,无菌操作下随机取试验组3 只小鼠的肝脏、脾脏、肾脏,加入适量的无菌生理盐水制成组织匀浆液,涂布于MRS 固体培养基,另取组织匀浆中加入菌液后涂布于MRS 固体培养基作为阳性对照,以生理盐水代替组织匀浆涂布于MRS 固体培养基作为阴性对照,在37℃培养48h,观察菌落生成情况。
1.5 小鼠血液细胞分析
血液样本置于EDTA 抗凝管中后,立即进行红细胞计数、白细胞计数及分类、血红蛋白浓度和血小板计数等血液学指标的测定。
1.6 小鼠血液生化指标测定
将血液样本置于促凝固管中,以4 ℃,3 500 r/min条件下离心5 min,检测血清中的白蛋白(ALB)、总蛋白(TP)、碱性磷酸酶(ALP)、血高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(CHO)、甘油三酯(TG)、血糖(GLU)和乳酸脱氢酶(LDH)含量,测定用试剂盒购自中生北控有限公司。球蛋白(GLOB)为TP和ALB 的差值。
1.7 数据统计与分析
使用SPSS 21.0 统计软件进行数据处理,并采用独立样本t 检验对试验数据进行统计分析及显著性检验。试验数据以“平均数±标准差”表示,P <0.05 表示差异显著,P <0.01 表示差异极显著。
2 结果与分析
2.1 高剂量罗伊氏乳杆菌L2-2 对小鼠体重和采食量的影响
小鼠灌服高剂量罗伊氏乳杆菌后采食、粪便均无异常,体重持续增长,体重和采食量见表1,未出现死亡现象;驴源罗伊氏乳杆菌L2-2 小鼠经口灌服后,未对小鼠采食和生长性能产生异常影响。
表1 高剂量罗伊氏乳酸菌对小鼠体重及采食量的影响Table 1 Effects of large dos the body weight and feed intake of mice

表1 高剂量罗伊氏乳酸菌对小鼠体重及采食量的影响Table 1 Effects of large dos the body weight and feed intake of mice
组别Group初始体重(g)Initial body weight不同天数体重(g)Body weight on different days 体增重(g)Body weight gain日采食量(g)Daily feed intake 3 d 5 d 7 d对照组Control group 21.42±1.12 25.14±1.27 26.89±1.44 28.78±1.71 7.36±1.30 3.97±0.22罗伊氏乳杆菌组Lactobacillus reuteri group 21.22±0.94 24.75±0.90 26.69±0.99 28.55±1.59 7.57±1.25 4.06±0.02 P 值P-value 0.631 0.381 0.696 0.724 0.679 0.652
2.2 高剂量罗伊氏乳酸菌L2-2 对小鼠脏器指数的影响
由表2 可知,灌服罗伊氏乳杆菌L2-2 后,小鼠心、肝、脾、肺、肾和肠道均未出现病变,小鼠胸腺指数明显增加(P <0.05),肝脏指数、脾脏指数和肾脏指数均无显著差异。
表2 高剂量罗伊氏乳酸菌对小鼠脏器指数的影响Table 2 Effects of large index of mice
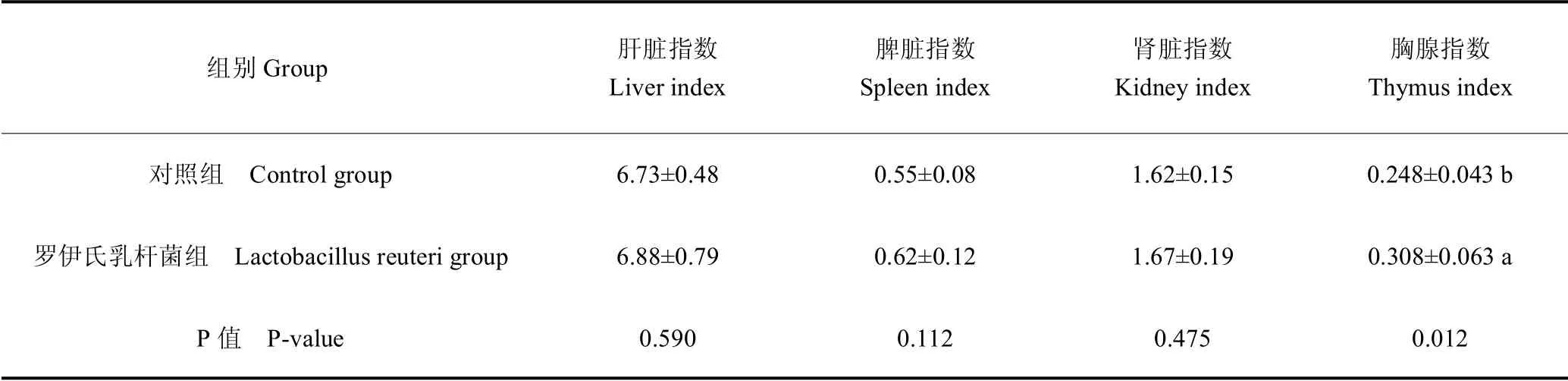
表2 高剂量罗伊氏乳酸菌对小鼠脏器指数的影响Table 2 Effects of large index of mice
注:同列不同小写字母表示差异显著(P <0.05)。Note:Different lowercase letters in the same column indicate significant differences(P <0.05).
组别Group 肝脏指数Liver index脾脏指数Spleen index肾脏指数Kidney index胸腺指数Thymus index对照组 Control group 6.73±0.48 0.55±0.08 1.62±0.15 0.248±0.043 b罗伊氏乳杆菌组 Lactobacillus reuteri group 6.88±0.79 0.62±0.12 1.67±0.19 0.308±0.063 a P 值 P-value 0.590 0.112 0.475 0.012
2.3 高剂量罗伊氏乳酸菌L2-2 对小鼠细菌易位情况
如图1 所示,灌服罗伊氏乳杆菌L2-2 后小鼠肝脏、脾脏及肾脏未见有菌落长出。结果表明,灌服高剂量罗伊氏乳杆菌L2-2 后小鼠肝脏和肾脏、脾脏未发生细菌易位现象。
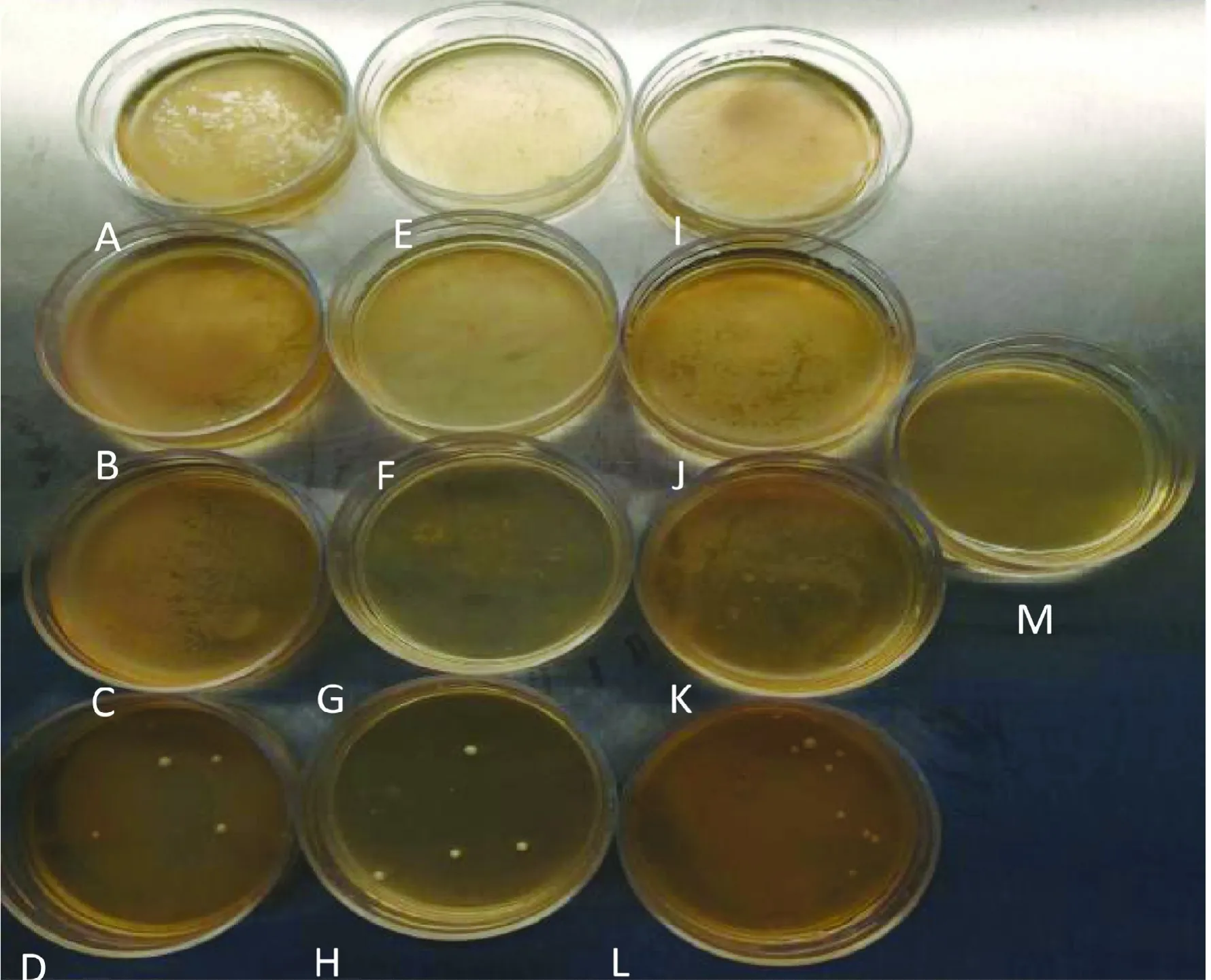
图1 高剂量罗伊氏乳酸菌对小鼠细菌易位情况Fig.1 Bacterial translocation of large dos
2.4 高剂量罗伊氏乳酸菌L2-2 对小鼠血液生化指标的影响
由表3 可知,高剂量罗伊氏乳杆菌可以显著提高小鼠血清中GLOB 含量(P <0.05),同时可以极显著降低血清中TG 含量(P<0.01),对葡萄糖、胆固醇、低密度脂蛋白和高密度脂蛋白均无显著影响(P>0.05)。
表3 高剂量罗伊氏乳酸菌对小鼠血清生化指标的影响Table 3 Effects of large dosees of mice

表3 高剂量罗伊氏乳酸菌对小鼠血清生化指标的影响Table 3 Effects of large dosees of mice
注:同列不同小写字母表示差异显著(P <0.05);同列不同大写字母表示差异极显著(P <0.01)。Note:Different lowercase letters in the same column indicated significant differences(P <0.05);Different capital letters in the same column indicated extremely significant differences(P <0.01).
组别Group ALB(g/L)TP(g/L)GLOB(g/L)Glu(mmol/L)LDH(U/L)ALP(U/L)TG(mmol/L)LDL(mmol/L)CHO(mmol/L)HDL(mmol/L)对照组Control group 20.85±1.21 44.22±1.70 23.37±1.23 b 8.06±0.55 879.66±117.41 135.06±17.85 1.25±0.13 A 0.45±0.03 3.16±0.18 1.87±0.14罗伊氏乳杆菌组Lactobacillus reuteri group 20.19±0.74 46.53±2.22 26.34±1.75 a 8.50±0.73 845.13±83.82 145.84±27.88 0.82±0.12 B 0.46±0.06 3.20±0.48 1.97±0.25 P 值P-value 0.331 0.102 0.015 0.347 0.607 0.487 0.001 0.902 0.865 0.458
2.5 高剂量罗伊氏乳酸菌L2-2 对小鼠血液学指标的影响
由表4 可知,试验组小鼠血液红细胞、白细胞数量、血红蛋白浓度和血小板数量等血液学指标与对照组相比均差异不显著(P >0.05)。
表4 高剂量罗伊氏乳酸菌对小鼠血液学指标的影响Table 4 Effects of large dosehematological indices of mice
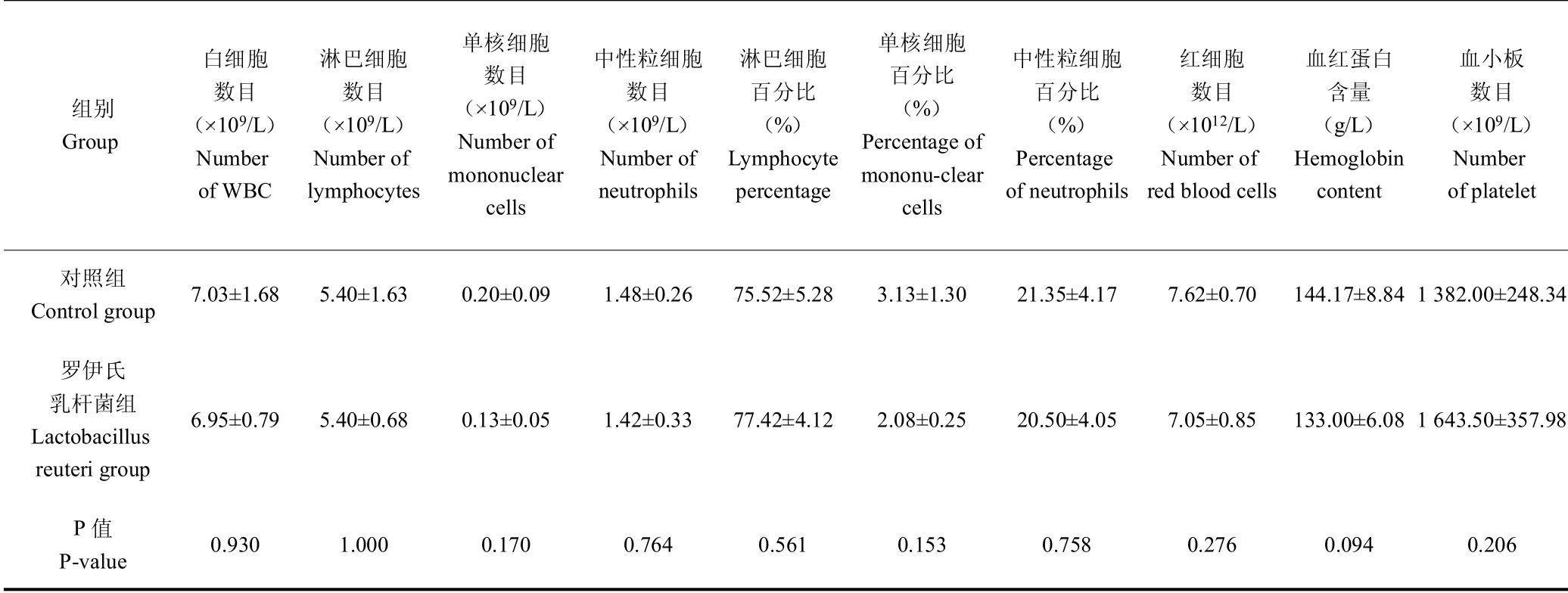
表4 高剂量罗伊氏乳酸菌对小鼠血液学指标的影响Table 4 Effects of large dosehematological indices of mice
组别Group白细胞数目( 109/L)Number of WBC淋巴细胞数目( 109/L)Number of lymphocytes单核细胞数目( 109/L)Number of mononuclear cells中性粒细胞数目( 109/L)Number of neutrophils淋巴细胞百分比(%)Lymphocyte percentage单核细胞百分比(%)Percentage of mononu-clear cells中性粒细胞百分比(%)Percentage of neutrophils红细胞数目( 1012/L)Number of red blood cells血红蛋白含量(g/L)Hemoglobin content血小板数目( 109/L)Number of platelet对照组Control group 7.03±1.68 5.40±1.63 0.20±0.09 1.48±0.26 75.52±5.28 3.13±1.30 21.35±4.17 7.62±0.70 144.17±8.84 1 382.00±248.34罗伊氏乳杆菌组Lactobacillus reuteri group 6.95±0.79 5.40±0.68 0.13±0.05 1.42±0.33 77.42±4.12 2.08±0.25 20.50±4.05 7.05±0.85 133.00±6.08 1 643.50±357.98 P 值P-value 0.930 1.000 0.170 0.764 0.561 0.153 0.758 0.276 0.094 0.206
3 讨论与结论
肠道菌群与动物机体健康息息相关。有益菌群不仅可以促进机体免疫应答,而且能代谢产生多种消化酶从而促进营养物质吸收,抑制肠道有害菌群,以维持肠道菌群平衡,发挥肠道生物屏障作用[10]。宿主动物的胃肠道内微生态系统处于一个动态平衡状态[11]。在正常情况下,胃肠道菌群中共生菌之间相互作用,为宿主胃肠道提供一定的营养及屏障功能,维持胃肠道的稳态[12]。当外源摄入高剂量微生物后,胃肠道内微生物之间会出现相互依赖,相互促进和相互制约,机制极其复杂,其安全性评价是一个必不可少的环节。
正常时各脏器与体重的比值称为脏体比或脏器指数,脏器指数比较稳定,当脏器充血、水肿、增生肥大或者脏器萎缩及其他退行性改变等则会引起脏器指数的变化,是毒理试验常用的指标。本研究结果显示,罗伊氏乳杆菌对小鼠肝脏指数、脾脏指数和肾脏指数均无明显影响,但可以显著提高胸腺指数。胸腺是小鼠体内重要的免疫器官,胸腺指数主要反映机体的非特异免疫能力。胸腺也是机体的一个分泌器官,髓质上皮中的Ⅵ型上皮细胞具有合成、分泌功能,可以分泌胸腺素及胸腺生成素。胸腺素和胸腺生成素分泌能够活化T淋巴细胞参与机体的免疫[13],胸腺指数增加表明罗伊氏乳杆菌L2-2 可以增强小鼠的免疫功能。
血清生化指标检测结果对于动物营养健康状况具有重要参考价值。本研究结果发现,在小鼠灌服高剂量罗伊氏乳杆菌L2-2 后,小鼠血清GLOB 含量增加,同时降低了血清中TG 含量,而其他血清生化指标未受影响。血清GLOB 通常也称为免疫球蛋白,可反映机体一定的免疫水平[14]。血清TG 是临床血脂分析的重要指标,血脂高会导致血小板大量集聚,继而导致心脑血管疾病的发生[15]。因此,罗伊氏乳杆菌L2-2 具有改善小鼠健康状况的潜力。
本研究结果表明,小鼠连续7d 灌服剂量1 1010CFU/d的罗伊氏乳杆菌L2-2,小鼠体征和采食情况未受到不利影响,小鼠血液学检查未见异常。细菌易位是指胃肠道内活菌穿过黏膜防御屏障,进入正常无菌的组织或器官,是评价细菌致病性的一个重要指标[16]。在小鼠灌服7 d 后,罗伊氏乳杆菌并未在原定居点肠道易位入其他组织发生感染。根据前人研究报道可知,半数致死量(LD50)是指导致死亡率50%的剂量,现已成为标志动物急性中毒程度的重要参数,在细菌浓度为5 1010CFU/mL时,对于6~8 周龄、体重20~25 g的雄性小鼠,罗伊氏乳杆菌L2-2 菌株口服LD50将大于10 mL/(kg·d),因此,预测体重100 kg 的驴驹每天服用超过1 L 的细菌是安全的[17],可接受的每日摄入量是通常用在动物试验(1 1010CFU/mL 浓缩饲料)的1 000 倍左右[18]。
本研究对从驴肠道内分离筛选到的罗伊氏乳杆菌在小鼠上进行了安全性评价,通过灌服大剂量罗伊氏乳杆菌研究其对小鼠的采食、生长情况、血清生化指标以及内脏细菌易位情况的影响,结果发现小鼠无中毒迹象,上述结果表明罗伊氏乳杆菌L2-2 菌株对小鼠具有非致病性,并能增加胸腺指数和血清中球蛋白含量,表明罗伊氏乳杆菌L2-2 能增强小鼠的免疫功能,而该菌的其他益生特性则有待进一步研究。

