不同抗性猕猴桃材料接种溃疡病菌后防御酶活性变化研究
温欣,秦红艳,艾军,王月,杨义明,范书田,张宝香,舒楠
(1.中国农业科学院特产研究所,吉林 长春 130112;2.吉林农业大学园艺学院,吉林 长春 130118)
软枣猕猴桃(Actinidia arguta)是猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)的落叶藤本植物,果实形如枣状,表面光滑无毛可直接食用,并富含多种矿质元素和微量元素,尤其维生素C 含量较其他水果高几倍或十几倍,由于在医疗保健等方面的优良特性,成为21 世纪的新型产业之一,发展前景广阔[1-2]。随着软枣猕猴桃从野生资源到大面积人工驯化种植,保证软枣猕猴桃植株健壮生长,减少病虫害侵袭变得尤为重要。猕猴桃溃疡病是猕猴桃种植产业中最严重的病害,其发病迅速,在发病前期难以察觉,无良好的防治效果,严重时可造成全园植株死亡[3-4]。该病是由丁香假单孢杆菌猕猴桃致病变种(Pseuomonas syringae pv.actinidae)引起的,最先在日本发现,随后世界多国均有报道,给世界猕猴桃产业带来了重大损失[5-6]。众多猕猴桃溃疡病抗性资源评价的研究中,评价方法和手段略有不同,学者们一致认为软枣猕猴桃属抗性资源,且至今未有软枣猕猴桃大面积感染溃疡病的报道[7]。笔者前期开展的软枣猕猴桃种质资源溃疡病抗性评价结果显示,中华猕猴桃‘红阳’属于高感品种,美味猕猴桃‘徐香’属于中抗品种,软枣猕猴桃‘魁绿’和‘佳绿’属于高抗品种。了解软枣猕猴桃溃疡病抗性机制,在培育新品种方面可缩短猕猴桃抗溃疡病品种的育种年限,在根源上减少或者避免猕猴桃溃疡病大面积暴发,使猕猴桃产业持续稳定发展。植物的抗病性主要表现在形态结构抗病性和生理生化抗病性两方面。前者通过植株固有或诱导的形态结构等特征抵御病原菌侵入;后者则通过寄主体内的生理生化变化进行防御。在生理生化抗病性研究中,植物体内的许多抗菌物质在抗病中起到了重要作用,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)等[8-9]。Fridovich[10]提出的生物超氧离子自由基学说引起人们对防御酶系与植物抗病性间关系的关注,并对植物感病后防御酶活性的变化进行了深入研究,发现防御酶活性变化与植物抗病性强弱有密切关系,但不同植物表现不同。一般情况下,防御酶活性在植物抗病性中呈现规律性变化,可以作为抗病性鉴别的生化指标[11-12]。本研究以软枣猕猴桃‘魁绿’、‘佳绿’,中华猕猴桃‘红阳’和美味猕猴桃‘徐香’为材料,通过活体接种,测定不同抗性品种叶片接种溃疡病菌后不同时间内防御酶的活性,分析其动态变化与猕猴桃资源抗性的关系,探讨软枣猕猴桃溃疡病抗性的生理机制,以期为开展优异猕猴桃品种选育提供理论基础。
1 材料与方法
1.1 试验材料
供试材料为软枣猕猴桃‘佳绿’、‘魁绿’,中华猕猴桃‘红阳’和美味猕猴桃‘徐香’长势均匀一致的一年生盆栽苗;供试菌株为丁香假单孢杆菌猕猴桃变种PSAM228,为PSA 强致病力菌株,由西北农林科技大学果树病害病原生物学及综合防治研究团队实验室保存,为西北农林科技大学高小宁老师所赠。
1.2 试验方法
选取各品种一年生盆栽苗的健康成熟叶片,将叶片表面擦拭干净,于叶脉基部叶柄处用1 mL的微量注射器缓缓注入浓度为108CFU/mL 的PSAM228 菌液,置于室内培养,温度为18 ℃。分别采取接种0、7、14、21 d和没有接种的21 d 叶片,除去主叶脉,保存于-80 ℃冰箱中待测。
1.3 测定项目与方法
SOD、POD、PAL、CAT 和PPO 测定均采用江苏南京建成生物工程研究所试剂盒,试剂盒编号分别为A001-3-2、A084-3-1、A137-1-1、A007-1-1和A136-1-1。
1.4 数据分析
试验数据利用Excel 2013、SAS 9.2 软件进行分析。
2 结果与分析
2.1 不同猕猴桃品种接种溃疡菌后POD 活性的变化
POD不仅能催化酚类物质氧化,同时也是重要的活性氧清除剂[13]。由表1 可知,接种后,各品种猕猴桃叶片的POD 活性均呈先上升而后下降趋势,且都在接种14 d时达到峰值。不同的是以接种14 d酶活变化看,高抗品种‘魁绿’和‘佳绿’上升幅度较大,POD 活性分别比接种前上升了79.23%和54.32%;中抗品种‘徐香’叶片中POD 活性上升较缓,POD 活性比接种前上升了36.67%;高感品种‘红阳’POD 活性上升幅度较小,POD活性比接种前上升了23.88%。对照21 d 与对照0 d 相比,POD 活性略有升高,但升高幅度明显低于接种处理组。
表1 接种溃疡病菌后不同猕猴桃品种叶片POD 活性的变化Table 1 Changes of POD activity in leaves of different varieties inoculated with

表1 接种溃疡病菌后不同猕猴桃品种叶片POD 活性的变化Table 1 Changes of POD activity in leaves of different varieties inoculated with
注:同列数据后所标字母相异表示差异显著(P <0.05)。下表同。Note:Different letters in the same column means significant difference between the treatments(P <0.05).The same as below.
接种时间(d) Inoculation time CK(0) 7 14 21 CK´(21)魁绿 Kuilv 72.48±1.28 g 78.27±2.76 f 129.91±2.94 a 94.92±4.27 c 78.95±1.02 b佳绿 Jialv 70.60±2.01 f 76.84±3.57 ef 108.98±4.44 b 92.52±0.85 cd 71.74±1.85 f红阳 Hongyang 64.78±0.89 i 69.36±0.08 hj 80.34±1.69 fe 77.31±3.03 f 70.76±4.79 g徐香 Xuxiang 65.55±0.31 hi 83.84±0.13 e 89.59±4.72 d 78.45±0.83 f 60.37±0.79 hi品种 Varieties
2.2 不同猕猴桃品种接种溃疡菌后CAT 活性的变化
过氧化氢酶(CAT)可促使H2O2 的分解反应,清除植物体内多余的过氧化氢,减少H2O2 对植物细胞的毒害[14]。由表2 可知,对照21 d 比对照0 d 相比CAT活性略有升高,但升高幅度明显低于接种处理组。接种前抗病品种CAT 活性低于感病品种。接种后,各猕猴桃品种CAT 活性均呈上升趋势,高抗品种‘魁绿’和‘佳绿’上升幅度显著大于高感品种‘红阳’和中抗品种‘徐香’(P <0.05)。接种21 d 后,‘魁绿’、‘佳绿’、‘红阳’和中抗品种‘徐香’叶片中CAT 活性比接种前分别上升了60.08%、58.66%、16.31%和40.97%。
表2 接种溃疡病菌后不同猕猴桃品种叶片CAT 活性的变化Table 2 Changes of CAT activity in leaves of different varieties inoculated with

表2 接种溃疡病菌后不同猕猴桃品种叶片CAT 活性的变化Table 2 Changes of CAT activity in leaves of different varieties inoculated with
接种时间(d) Inoculation time CK(0) 7 14 21 CK´(21)魁绿 Kuilv 63.39±1.61 h 84.21±3.53 bcd 95.73±0.97 b 101.48±0.22 a 71.51±0.53 fg佳绿 Jialv 66.36±4.10 gh 82.29±0.37 cd 94.74±0.99 b 105.29±3.30 a 67.86±3.63 hi红阳 Hongyang 75.46±0.37 ef 77.74±1.51 def 82.78±2.39 cd 87.77±0.83 bc 81.53±1.67 cde徐香 Xuxiang 68.73±0.33 gh 72.63±3.01 fg 87.85±0.22 bc 96.88±1.04 b 71.51±0.53 fgh品种 Varieties
2.3 不同猕猴桃品种接种溃疡菌后SOD 活性的变化
超氧化物歧化酶(SOD)在生物细胞中广泛存在,是清除活性氧反应时第一个发挥作用的抗氧化酶,可以将超氧化物阴离子自由基转化为分子氧和过氧化氢[15]。由表3 可知,接种溃疡病菌前,高抗品种‘魁绿’和‘佳绿’叶片中SOD 活性低于高感品种‘红阳’和中抗品种‘徐香’。接种溃疡病菌后,各品种猕猴桃叶片的SOD活性均呈先上升后下降的趋势,且在接种14 d时达到峰值。此时叶片中SOD 活性上升幅度最大为高抗品种‘佳绿’(97.31%)和‘魁绿’(88.16%),其次是中抗品种‘徐香’(34.53%),上升幅度最小为高感品种‘红阳’(17.98%)。对照21 d 与对照0 d 相比,SOD 活性略有升高,但升高幅度明显低于接种处理组。
表3 接种溃疡病菌后不同猕猴桃品种叶片SOD 活性的变化Table 3 Changes of SOD activity in leaves of different varieties inoculated with

表3 接种溃疡病菌后不同猕猴桃品种叶片SOD 活性的变化Table 3 Changes of SOD activity in leaves of different varieties inoculated with
接种时间 Inoculation time(d)CK(0) 7 14 21 CK´(21)魁绿 Kuilv 1 005.72±17.29 i 1 239.21±45.37 h 1 892.43±53.22 b 1 429.46±28.85 efg 1 268.38±20.45 h佳绿 Jialv 1 057.61±11.45 i 305.51±12.97 gh 2 086.78±60.53 a 1 432.34±71.10 efg 1 343.67±50.20 fgh红阳 Hongyang 1426.58±54.30 efg 1 547.65±64.85 de 1 683.13±38.91 c 1 614.84±25.94 cd 1 515.94±43.23 de徐香 Xuxiang 1 247.86±43.23 h 1 403.52±8.64 ef 1 732.68±51.86 bc 1 508.41±30.26 ef 1 352.42±25.94 ffg品种 Varieties
2.4 不同猕猴桃品种接种溃疡菌后PPO 活性的变化
PPO 是可以将酚类氧化成醌类的酶,醌类物质对病原菌菌丝的生长具有毒害作用[16]。由表4 可知,接种溃疡病菌前,高抗品种‘魁绿’和‘佳绿’叶片中PPO 活性高于高感品种‘红阳’和中病品种‘徐香’。接种溃疡病菌后,各品种猕猴桃叶片的PPO活性均呈先上升后下降的趋势,高抗品种‘魁绿’和‘佳绿’上升幅度大且在接种7d 时达到峰值,比对照上升了160.50%和188.57%,随后下降;中抗品种‘徐香’叶片的PPO活性也在接种7d时达到峰值,比对照上升了136.96%,随后下降;高感品种‘红阳’在接种14 d 时才达到峰值且上升幅度最小为69.46%。对照21 d 与对照0 d 相比PPO 活性略有升高,但升高幅度明显低于接种处理组。
表4 接种溃疡病菌后不同猕猴桃品种叶片PPO 活性的变化Table 4 Changes of PPO activity in leaves of different varieties inoculated with
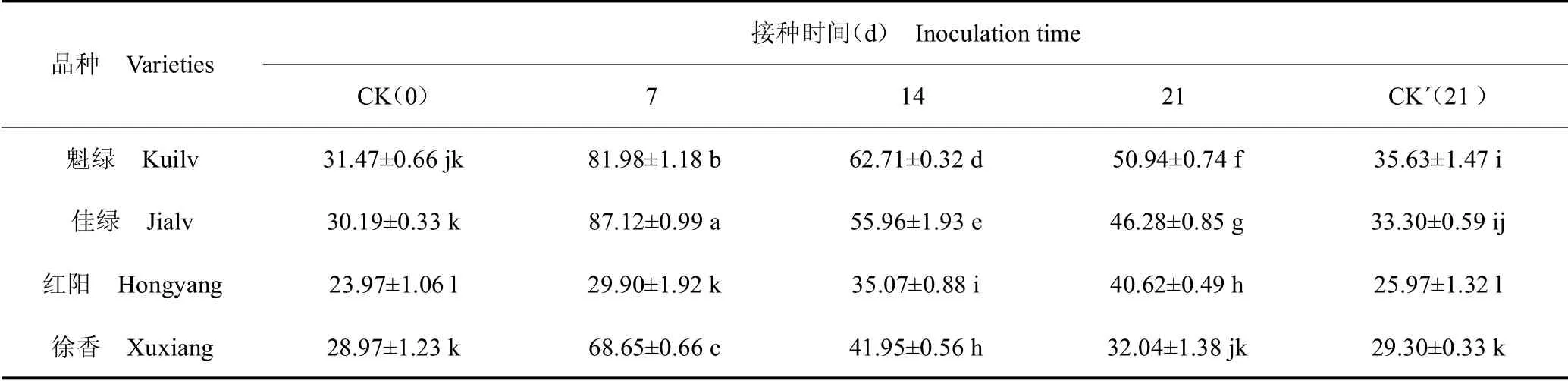
表4 接种溃疡病菌后不同猕猴桃品种叶片PPO 活性的变化Table 4 Changes of PPO activity in leaves of different varieties inoculated with
接种时间(d) Inoculation time CK(0) 7 14 21 CK´(21)魁绿 Kuilv 31.47±0.66 jk 81.98±1.18 b 62.71±0.32 d 50.94±0.74 f 35.63±1.47 i佳绿 Jialv 30.19±0.33 k 87.12±0.99 a 55.96±1.93 e 46.28±0.85 g 33.30±0.59 ij红阳 Hongyang 23.97±1.06 l 29.90±1.92 k 35.07±0.88 i 40.62±0.49 h 25.97±1.32 l徐香 Xuxiang 28.97±1.23 k 68.65±0.66 c 41.95±0.56 h 32.04±1.38 jk 29.30±0.33 k品种 Varieties
2.5 不同猕猴桃品种接种溃疡菌后PAL 活性的变化
PAL 是催化苯丙烷类代谢的关键酶,在此过程中形成一系列的次生代谢产物抑制病原菌的侵入[17]。由表5 可知,未接种溃疡病菌的各品种PAL 活性差异不大。接种溃疡病菌后,各品种的PAL活性均高于对照,高抗品种‘魁绿’和‘佳绿’的酶活及增幅一直显著高于中华猕猴桃‘红阳’和美味猕猴桃‘徐香’(P <0.05)。接种后14 d,高抗品种‘魁绿’和‘佳绿’迅速升高达到峰值,增幅分别为52.65% 和63.33%,随后下降,但仍保持较高的活性水平;中抗品种‘徐香’与其变化趋势相似,在接种14 d时较接种前升高了47.15%;高感品种‘红阳’上升缓慢虽在14 d 达到峰值,增幅为8.19%,但酶活较低,随后下降。对照21 d 与对照0 d 相比PAL活性略有升高,但升高幅度明显低于接种处理组。
表5 接种溃疡病菌后不同猕猴桃品种叶片PAL 活性的变化Table 5 Changes of PAL activity in leaves of different varieties inoculated with

表5 接种溃疡病菌后不同猕猴桃品种叶片PAL 活性的变化Table 5 Changes of PAL activity in leaves of different varieties inoculated with
接种时间(d) Inoculation time CK(0) 7 14 21 CK´(21)魁绿 Kuilv 66.98±2.89 i 86.07±0.58 de 102.25±3.07 a 97.27±0.99 b 68.63±0.09 h佳绿 Jialv 55.27±1.38 i 83.42±3.57 ef 96.81±0.16 bc 90.24±0.66 cd 62.32±3.06 i红阳 Hongyang 77.70±1.22 g 80.84±6.37 f 84.32±3.81 de 83.58±1.41 ef 78.40±1.82 g徐香 Xuxiang 66.17±0.49 i 80.18±2.73 ef 97.39±1.16 b 91.65±0.08 c 69.88±2.32 gh品种 Varieties
3 结论与讨论
植物受到病原菌侵害后,植物的防御酶系会催化产生复杂的新陈代谢活动,以保护其自身。研究表明,SOD、POD、CAT、PPO 和PAL 等与植物抗病性有着密切关系[18-20]。PAL 是连接初级代谢和苯丙烷类代谢、催化苯丙烷类代谢第一步反应的酶,是苯丙烷类代谢途径的关键酶和限速酶,该途径产生的酚类、类黄酮及萜烯类植保素物质能有效抑制病原菌的生长;产生的木质素可增强组织木质化程度,形成机械屏障阻碍病原菌侵入。PPO 在酚类物质氧化为醌类物质中起到了关键作用,醌再与其他物质交联形成新的物质,可作为物理屏障保护植物组织;另一方面PPO 与木质素合成有关,使细胞壁木质化,提高植物抗病性。POD 是木质素合成过程中催化最后一步反应的酶,同时与多酚氧化有着密切关系[21-27]。张宁等[28]研究发现,不同抗性甜瓜品系接种蔓枯病菌后防御酶的活性迅速上升,且PAL、PPO 和POD 活性变化与品系抗性有直接联系。石志军[27]通过测定不同溃疡病抗性猕猴桃品种的酶活发现,抗病品种的PAL、PPO 和POD 活性在接种溃疡病菌后增加幅度大于感病品种,易盼盼[18]和李淼[29]也获得了一致的研究结果,认为PAL、PPO 和POD 活性可作为衡量猕猴桃种质溃疡病抗性的指标。本研究发现,接种后PAL、PPO 和POD 活性都呈升高趋势且在测定时期内均高于接种前,抗病品种的酶活增幅一直高于感病及高感品种,这说明PAL、PPO 和POD 活性变化与抗病性有一定相关性,在猕猴桃受溃疡病菌侵染后植株体内的抗病防御酶发生诱导反应,因此,PAL、PPO 和POD 在抗病品种抗性防御过程中起着重要作用。4 个猕猴桃品种的POD 和PAL 活性在接种14 d 时达到最大值,而抗病品种的PPO 活性则在接种后迅速升高在7 d 时达到最大值,感病和高感品种的PPO 活性在接种14 d 达到最大值。说明PPO 在发病前期起到保护作用。
病原菌侵入后,植物会积累大量的活性氧从而损害植物细胞,为保持自身正常生理代谢,SOD 和CAT 等有活性氧酶促清除机制功能的防御酶在植物体内发挥了重要作用[30-31]。POD 有清除H2O2 和OH 基方面的作用,也是重要的活性氧清除剂[13]。但许多学者在不同病害的研究中,对SOD 和CAT 活性变化的结果不一致。在猕猴桃溃疡病的抗性机制研究中,李淼[29]认为感病后抗病品种叶片及枝条种的SOD 和CAT 活性及增加幅度均高于感病品种,与崔丽红等[32]的研究结果一致;张迪[33]则认为叶片中SOD 和CAT 活性虽在接种后有明显变化但与猕猴桃品种溃疡病抗性的相关性不显著,且CAT活性随接种时间增加呈双峰曲线变化。本研究中不同品种猕猴桃接种溃疡病菌后,叶片中SOD和CAT活性变化与品种溃疡病抗性一致,CAT活性在试验期间呈上升趋势且只有一个峰值出现。该结果可能与接种方式不同和接种材料长势等因素有关,具体原因还有待进一步探索。
本试验通过对不同抗性的猕猴桃种质叶片进行接种后其防御酶系进行测定和分析发现,不同抗性品种防御酶活性变化有所差异,叶片中SOD、POD、CAT、PPO 和PAL 活性变化与猕猴桃溃疡病抗性有密切联系,且无接种的健康叶片21 d后与21 d前相比各防御酶活性无明显变化或略有升高,对试验结果无影响,因此接种溃疡病菌后防御酶活性变化可作为猕猴桃溃疡病抗性评价指标之一。

