全细胞催化甘油生物合成L-果糖体系的构建
陈 洲, 秦 岭, 李 芬, 李子杰, 高晓冬
(江南大学 生物工程学院, 江苏 无锡 214122)
稀少糖是指在自然界中含量极低且具有重要生理功能的一类单糖及其衍生物[1-2]。随着人们生活水平的提高,高糖摄入引起的糖尿病、高血压和心血管病等,严重危害着人类的生命健康[3]。稀少糖在膳食与健康领域具有重要的生理功能,逐渐被人们熟知[4-5]。L-果糖作为稀少糖的一种,是D-果糖的对映异构体,在理化性质方面,L-果糖与D-果糖几乎相同,如外观、甜度、熔沸点以及与氨基酸发生美拉德反应等特性;但在生化性质方面有着较大差异,例如,L-果糖低热量,是一种低能量的甜味剂[6],也是多种糖苷酶的抑制剂[7],是蚂蚁和家蝇的杀虫剂[8]。此外,L-果糖在合成具有生物活性的化合物方面具有潜在应用价值[9-10]。由于这些独特的性质,L-果糖的合成一直都是当今研究的热门领域。目前,L-果糖主要通过化学法和酶法来合成,其中化学合成存在使用有毒物质、收率低等问题,酶法存在酶提纯步骤繁琐,同时需要辅因子等弊端[11-14],制约了其应用和工业化生产。全细胞转化拥有多种优势:能耗低、催化效率高、专一性强、生产操作条件简单以及产物单一易分离等,此方法已被广泛应用于各种糖醇类的合成15-17]。在之前的工作中,本研究室已构建好表达E型马肝乙醇脱氢酶,特异性氧化甘油生成L-甘油醛,并应用于L-果糖的合成[18]。但是,以上方法采用6种纯酶一起反应,需要2种底物(D/L-3磷酸甘油和甘油),同时需要添加辅因子,操作过程繁琐,不利于工业化的应用。本研究采用2种细胞混合催化甘油合成L-果糖,首先,构建表达E型马肝乙醇脱氢酶(EE type horse liver alcohol dehydrogenase,HLADH-EE)和酿脓链球菌来源的NADH氧化酶(NADH oxidase,NOX)的细胞菌株,以甘油为底物生成L-甘油醛,通过偶联NOX,从而实现NAD+的合成与再生,无须额外添加辅因子NAD+;然后与表达大肠杆菌MG1655来源的甘油激酶(glycerol kinase,GK)、肺炎链球菌来源的甘油磷酸氧化酶(L-α-glycerophosphate oxidase,GPO)以及大肠杆菌MG1655来源的L-鼠李树胶糖-1-磷酸醛缩酶(L-rhamnulose-1-phosphate aldolase,RhaD)和磷酸酶(fructose-1-phosphotase,YqaB)的菌株偶联。新生成的L-甘油醛作为受体,在醛缩酶RhaD的作用下与磷酸二羟基丙酮(dihydroxyacetone phosphate,DHAP)发生羟醛缩合生成L-果糖-1-磷酸,最后由磷酸酶脱去磷酸,生成L-果糖。全细胞生产操作条件简单,无须繁琐的酶纯化过程;采用全细胞转化以廉价的甘油为唯一底物,变废为宝;同时不需要添加辅因子,进一步降低生产成本,可为L-果糖产品绿色生产提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1主要试剂和培养基
PCR所需试剂、限制性内切酶以及连接酶Ligation Mix,宝生物(大连)有限公司;质粒提取、纯化试剂盒、抗生素,生工生物工程(上海)股份有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)、L-甘油醛、L-果糖标准品,Sigma-Aldrich公司;甘油等其他试剂,国药化学试剂有限公司。
LB培养基(g/L):酵母粉5,胰蛋白胨10,NaCl 10。
TB培养基(g/L):酵母粉24,胰蛋白胨12,甘油5,KH2PO42.31,K2HPO4·3H2O 16.4。
1.1.2菌种和质粒
大肠杆菌DH5α和BL21(DE3)为本实验室保存;质粒pET28a由本实验保藏;pCDFDuet-1由江南大学邓禹教授馈赠;菌株BL-HN(含有pET28a-HLADH质粒和pCDFDuet-nox质粒)为本研究构建;菌株BL-RB(含有pCDFDuet-rhaD-glpO-glpK质粒和pET28a-yqaB质粒)为本研究室前期构建。
1.2 仪器与设备
PCR仪、SDS-PAGE型电泳仪,伯乐生命医学有限公司;台式水平恒温摇床,江苏太仓强乐实验仪器有限公司;电子天平,上海三发科学仪器有限公司;高效液相色谱仪(HPLC)、自动进样器、示差折光检测器,美国Waters公司。
1.3 实验方法
1.3.1HLADH-EE和NOX的异源表达
质粒pET28-HLADH的构建信息已经报道[18]。NADH氧化酶基因nox以酿脓链球菌(Streptococcuspyogenes)基因组为模板,采用如下引物扩增:NOX-F:TATACATATGATGAGTAAAATCGTTGTTGT;NOX-R:CGCGCTCGAGGTCTTTGGCACCAAGTGCTGC,下划线处为酶切位点,与pCDFDuet-1载体用NdeI和XhoI双酶切,然后胶回收,连接,转化DH5α感受态细胞,挑取阳性克隆,测序正确后与pET28-HLADH同时转入BL21(DE3)感受态细胞,挑取阳性克隆接入5 mL含有50 mg/L的卡那霉素和链霉素的LB培养基中,37 ℃、220 r/min过夜培养。次日,将上述培养基以体积分数1%的接种量转接含有相应抗性的TB培养基中,37 ℃、220 r/min培养至OD600约0.8,加入一定量的IPTG,同时,转移至适当温度的恒温摇床中进行诱导表达,诱导表达后的菌体通过SDS-PAGE进行验证。
1.3.2全细胞催化剂的制备
经SDS-PAGE验证后的菌液,于4 ℃、5 000 r/min离心10 min,收集菌体。用预冷的生理盐水洗涤菌体3次,然后将收集的菌体放置4 ℃保存备用。
1.3.3HLADH-EE活性检测
将甘油(10 mmol/L)和BL-HN重组细胞(终质量浓度100 g/L),加入到50 mmol/L Tris-HCl(pH值为8.5)中,于35 ℃、180 r/min摇床反应12 h。反应结束后,离心,收集上清;经过0.22 μm滤膜除杂后,通过HPLC进行测定。
1.3.4BL-HN菌株诱导条件优化
目的蛋白的表达受诸多因素的影响,分别选取诱导温度、诱导时间以及IPTG的浓度进行研究,通过HPLC测定L-甘油醛的生成量,确定最适条件。
诱导温度优化:以16、20、30、37 ℃为温度梯度,将培养的种子以体积分数1%接种到50 mL的TB培养基中,37 ℃、220 r/min培养至OD600约0.8,加入终浓度0.1 mmol/L的IPTG诱导,20 h后,取等量的细胞,测定35 ℃下全细胞转化10 mmol/L甘油生成L-甘油醛的量。
诱导时间优化:将培养的种子以体积分数1%接种到50 mL的TB培养基中,37 ℃、220 r/min培养至OD600约0.8,加入终浓度0.1 mmol/L的IPTG诱导,在20 ℃下分别诱导16、20、24、28 h。取等量的细胞,测定35 ℃下全细胞转化10 mmol/L甘油生成L-甘油醛的量。
IPTG浓度优化:设定IPTG的浓度为0.01、0.05、0.1、0.2 mmol/L 4个梯度。将培养的种子以体积分数1%接种到50 mL的TB培养基中,37 ℃、220 r/min培养至OD600约0.8,加入不同浓度的IPTG诱导,在20 ℃下分别诱导16 h。取等量的细胞,测定35 ℃下全细胞转化10 mmol/L甘油生成L-甘油醛的量。
条件优化实验采用相对活性进行表征,其中相对活性的定义为:相同细胞量的情况下,以L-甘油醛的生成量最高的条件为100%,其他条件下L-甘油醛的生成量与之相比较,所得的比值称为相对活性,用以表征BL-HN菌株活性。
1.3.5全细胞转化甘油合成L-果糖的条件优化
为了探究反应条件对全细胞合成L-果糖的影响,选取温度、pH值、湿细胞质量浓度、甘油浓度进行研究。因菌株BL-RB在外加L-甘油醛的条件下拥有很好地生产L-果糖的能力[19],首先,在菌株BL-RB湿细胞质量浓度为150 g/L保持不变时,对BL-HN的湿细胞浓度进行优化。选取BL-HN的湿细胞质量浓度为10、25、50、100和200 g/L进行研究,测定35 ℃,pH值8.5下全细胞转化200 mmol/L甘油生成L-果糖的量。在2种细胞优化比例的条件下,又分别考察了温度、pH值以及甘油浓度等因素对全细胞转化合成L-果糖的影响。对温度设置25、30、35、40、45 ℃等5个梯度,对pH值设置7.5、8.0、8.5、9.0、9.5等5个梯度,对甘油的浓度设置100、200、300、400、500、600 mmol/L等6个梯度,通过HPLC测定L-果糖的生成量,确定较适转化条件。
湿细胞质量浓度、反应温度以及pH值的优化采用相对活性进行实验结果表征,其中相对活性的定义为:以L-果糖生成量最高的条件为100%,其他条件下L-果糖的生成量与之相比较,所得的比值称为相对活性,用以表征BL-HN菌株活性。
1.3.6甘油合成L-果糖的测定
在优化反应条件下,将反应体系扩大为10 mL,甘油(500 mmol/L),重组细胞BL-HN(25 g/L),重组细胞BL-RB(150 g/L),加入50 mmol/L Tris-HCl (pH值9.0) 的缓冲液中,于30 ℃、180 r/min摇床反应36 h。通过HPLC测定L-果糖的生成量。
1.4 色谱条件
全细胞转化生成的L-甘油醛和L-果糖通过HPLC进行检测。HPLC条件色谱柱:伯乐有机酸柱(Aminex HPX-87H, 300 mm×7.8 mm);流动相:5 mmol/L稀硫酸;流速:0.5 mL/min;检测器:示差折光检测器;柱温:60 ℃;进样量:20 μL[20]。
2 结果与分析
2.1 HLADH-EE和NOX的蛋白表达及活性分析
BL-HN菌株经过IPTG诱导表达后,通过SDS-PAGE进行验证(见图1)。由图1可知,通过诱导前后菌体对比发现,约在43 kDa和50 kDa处明显出现特征蛋白条带,这与HLADH-EE(43 kDa)和NOX(49.6 kDa)相符,说明HLADH-EE和NOX均成功表达。通过诱导后的菌体与诱导后的上清液相比,HLADH-EE和NOX的蛋白表达量没有明显减少,说明HLADH-EE和NOX均是可溶性蛋白。当重组蛋白发生错误折叠时,往往会形成沉淀,影响酶活力,这间接地说明以上2种蛋白折叠正确。
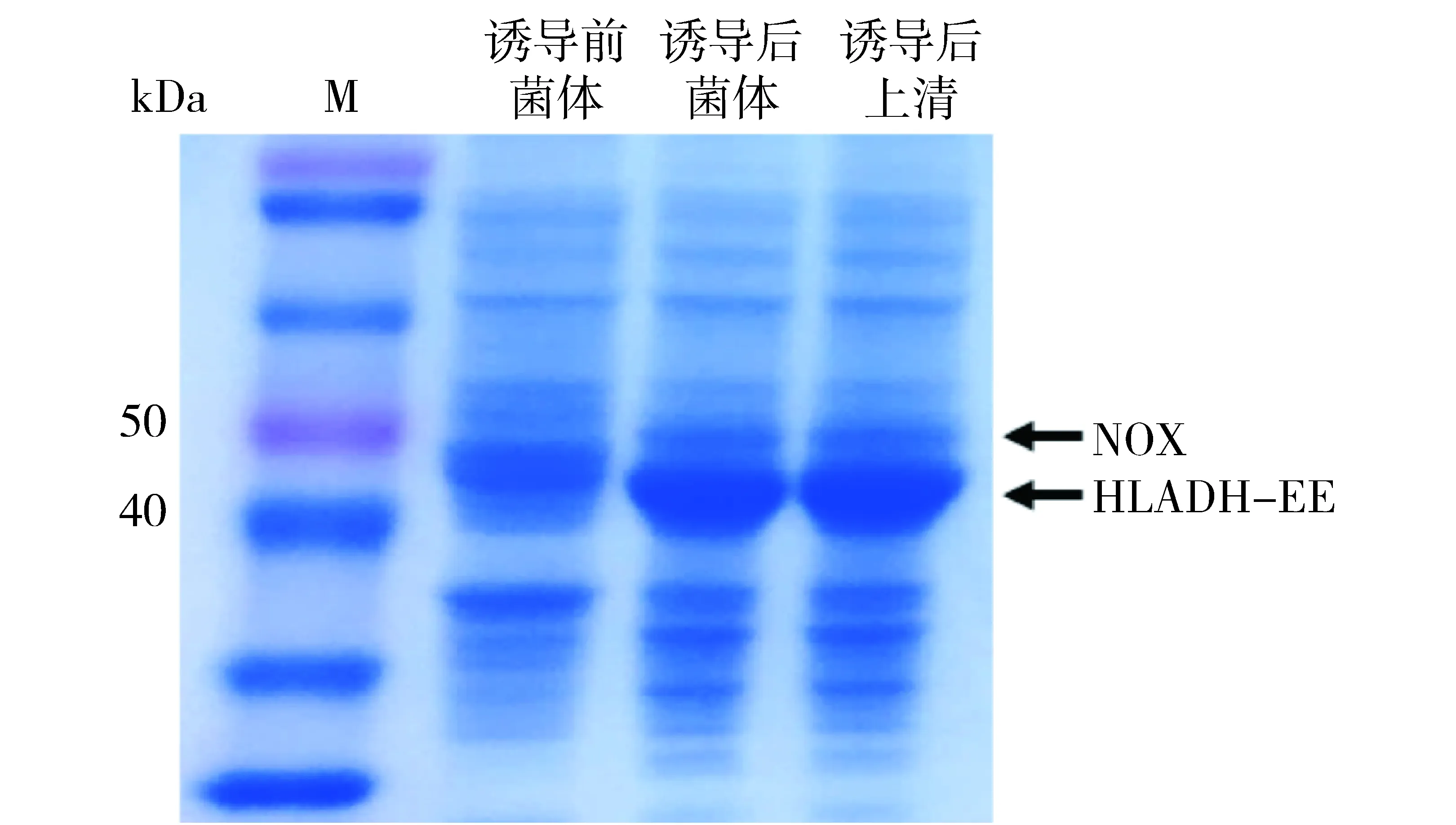
图1 HLADH-EE和NOX的SDS-PAGE分析Fig.1 SDS-PAGE analysis of HLADH-EE and NOX
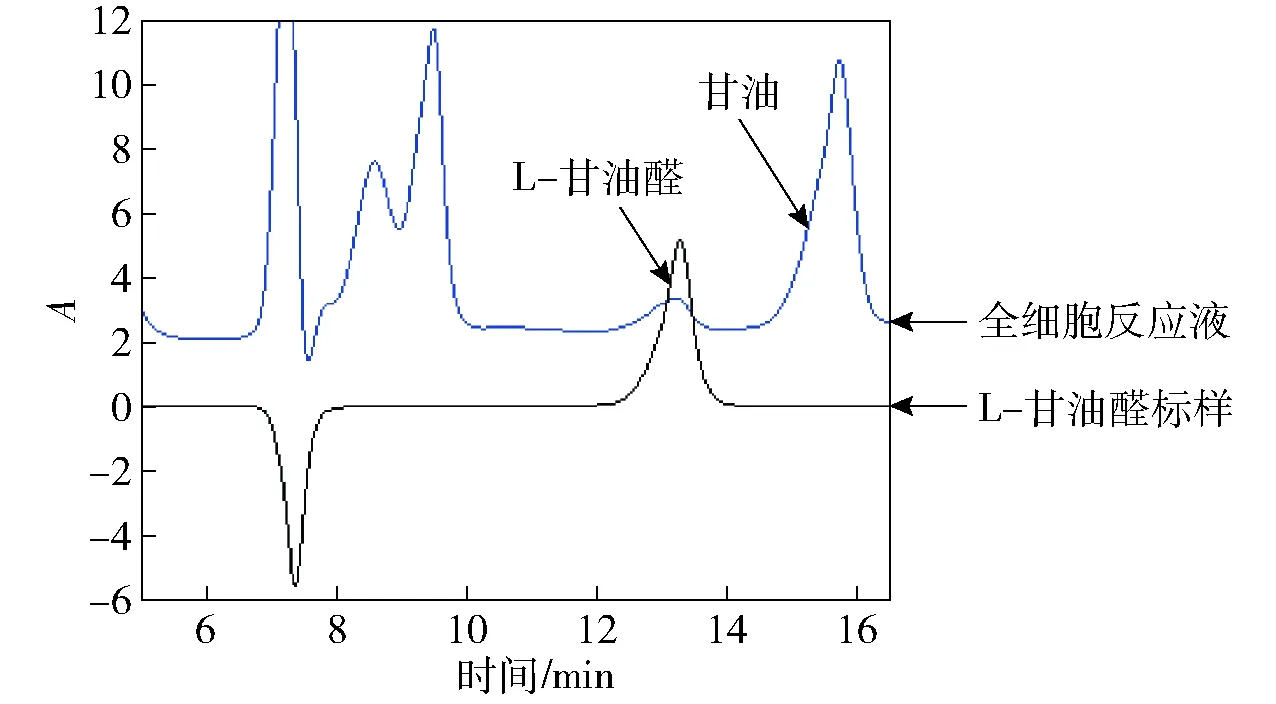
图2 全细胞反应液中L-甘油醛的HPLC分析Fig.2 HPLC detection of L-glyceraldehyde in whole-cell reaction mixture
采用全细胞以甘油为底物进行活性验证,经过12 h的反应,离心,收集上清;过膜除杂后,通过HPLC进行测定(见图2)。由图2可知,与L-甘油醛标样相比,此菌株成功催化甘油合成L-甘油醛。HLADH-EE是NAD+依赖型脱氢酶,纯酶反应中,辅因子NAD+是必需的。因细胞内部含有少量辅因子NAD+,所以采用全细胞转化无须额外添加NAD+即可成功得到L-甘油醛。这说明此菌株可实现辅因子的再生, 节约生产成本。
2.2 L-果糖合成路径的构建
菌株BL-HN催化甘油生成L-甘油醛,新生成的L-甘油醛进入BL-RB细胞内。BL-RB细胞催化甘油生成DHAP,在RhaD的作用下,L-甘油醛与DHAP发生羟醛缩合生成L-果糖-1-磷酸,经YqaB脱磷酸作用,生成L-果糖(见图3)。
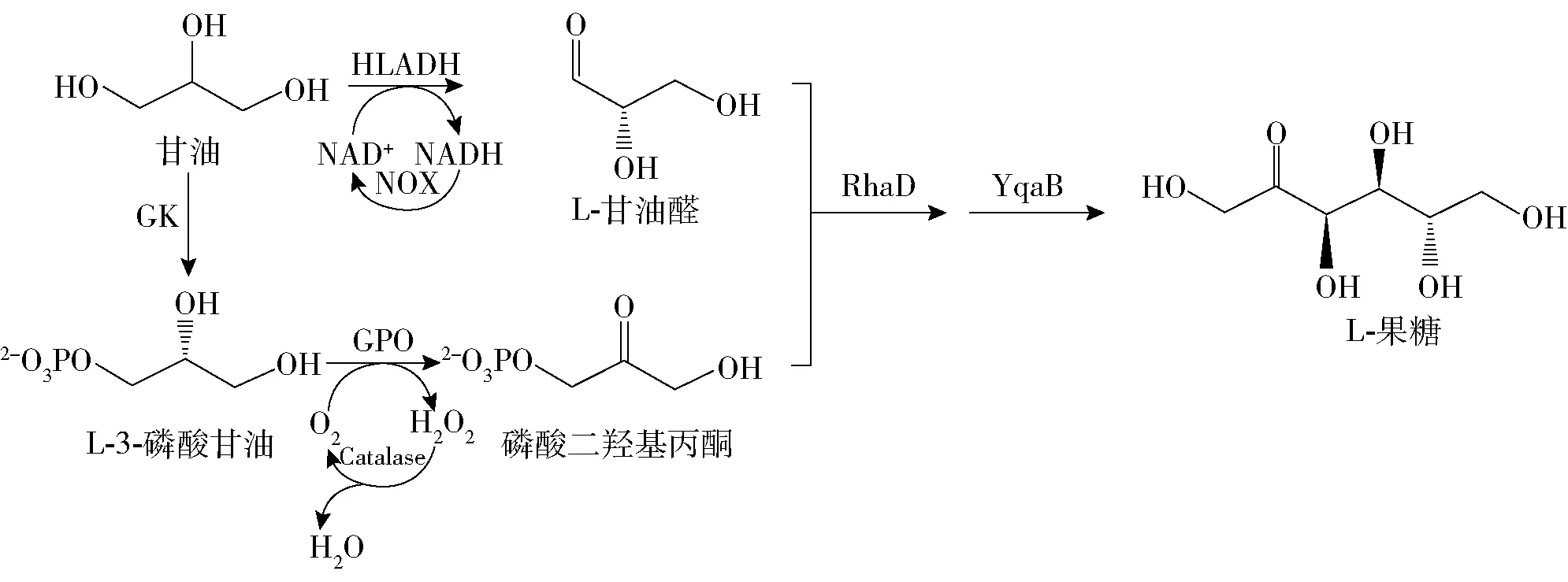
HLADH:马肝乙醇脱氢酶;NOX:NADH氧化酶;GK:甘油激酶;GPO:甘油磷酸氧化酶;catalase:过氧化氢酶;RhaD:L-鼠李树胶糖-1-磷酸醛缩酶;YqaB:磷酸酶。图3 全细胞催化甘油合成L-果糖路径Fig.3 Synthesis of L-fructose by whole-cell biocatalysis from glycerol
BL-HN细胞和BL-RB细胞1∶1混合以甘油为底物,进行全细胞反应合成L-果糖。在前期工作中,已经对BL-RB菌株中各种酶(GK, GPO, RhaD和YqaB)的表达和活性进行验证[19](见图4)。由图4可知,与L-果糖标样相比,全细胞反应液中有L-果糖的生成。说明利用2种细胞共同催化甘油合成L-果糖的方法是可行的。与纯酶体系相比,全细胞转化优势明显,无须添加辅因子NAD+,仅要一种底物甘油即可合成L-果糖,并且在降低生产成本的同时也为甘油的变废为宝提供了一个方向。

图4 全细胞反应液中L-果糖的HPLC分析Fig.4 HPLC detection of L-fructose in whole-cell reaction mixture
2.3 BL-HN菌株诱导条件优化结果
真核来源的E型马肝乙醇脱氢酶HLADH-EE对诱导条件要求相对较高,通过大肠杆菌异源表达具有挑战性,菌体生长过快、蛋白表达量过多等因素均可导致HLADH-EE失活。如温度过高,菌体生长快,蛋白的表达量增多,增多的蛋白来不及正确折叠,进而影响酶活,因此对诱导条件进行优化很有必要。
2.3.1诱导温度的优化
将培养的种子液以体积分数1%接种到50 mL的TB培养基中,37 ℃、220 r/min培养至OD600约0.8,加入终浓度0.1 mmol/L的IPTG,以16、20、30、37 ℃为温度梯度进行诱导,20 h后,取等量的细胞转化10 mmol/L甘油,对L-甘油醛的生成量进行测定(见图5)。由图5可知,低温有利于酶的表达,这与较低温度时菌体对比生长速率较低、质粒稳定性好、外源蛋白的稳定性和可溶性提高等有着密切关系。但是,当温度过低时,营养物的摄入和生长速率降低,菌体营养不良,不利于外源蛋白的形成。诱导温度为20 ℃,此时相对活性最高,故选取20 ℃为下一次优化实验的较适温度。

图5 诱导温度对全细胞合成L-甘油醛的影响Fig.5 Effect of induced temperature on whole-cell biocatalysis of L-glyceraldehyde
2.3.2诱导时间的优化
当OD600约0.8,加入终浓度0.1 mmol/L的IPTG在20 ℃下分别诱导16、20、24、28 h。取等量的细胞转化10 mmol/L甘油,对L-甘油醛的生成量进行测定(见图6)。由图6可知,诱导时间对合成L-甘油醛的影响相对较小;但是,诱导时间过久,菌体老化、次级代谢产物增多等均会对外源蛋白的表达及活性造成影响。最适诱导时间为16 h,此时相对活性最高,故选取16 h为下一次优化实验的较适时间。
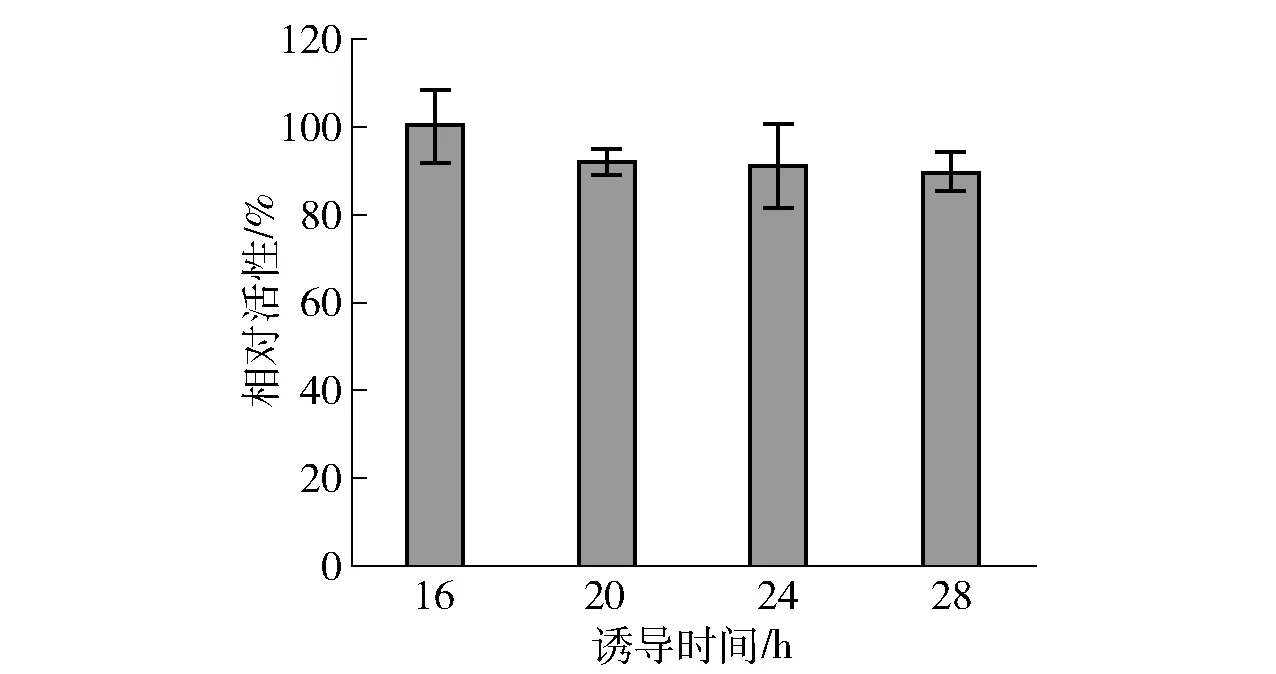
图6 诱导时间对全细胞合成L-甘油醛的影响Fig.6 Effect of induction time on whole-cell biocatalysis of L-glyceraldehyde
2.3.3诱导剂浓度的优化
当OD600约0.8,在20 ℃下分别加入不同浓度的IPTG诱导,在20 ℃下分别诱导16 h。取等量的细胞转化10 mmol/L甘油,对L-甘油醛的生成量进行测定。诱导剂的量往往与诱导蛋白的量呈现正相关,若外源蛋白对菌体本身有毒性,大量的外源蛋白表达会抑制菌体的生长,因此对诱导剂进行优化很有必要(见图7)。由图7可知,高浓度的诱导剂不利于外源蛋白的表达,原因可能是过量表达的外源蛋白影响了菌体的正常生长。较适诱导剂浓度为0.05 mmol/L IPTG,此时相对活性最高,故选取0.05 mmol/L IPTG为较适添加量。
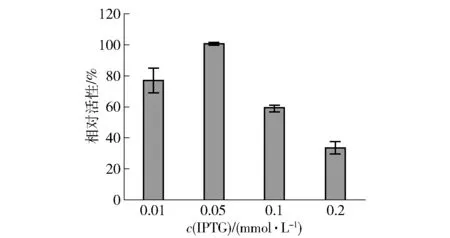
图7 诱导剂浓度对全细胞合成L-甘油醛的影响Fig.7 Effect of IPTG concentration on whole-cell biocatalysis of L-glyceraldehyde
综上所述,BL-HN菌株诱导条件优化结果如下:诱导温度为20 ℃,诱导时间为16 h,诱导剂浓度为0.05 mmol/L IPTG。探究诱导条件对重组酶的影响,将有助于提高外源蛋白的稳定性与可溶性。
2.4 全细胞转化条件优化结果
2.4.1菌株BL-HN的湿细胞质量浓度的优化
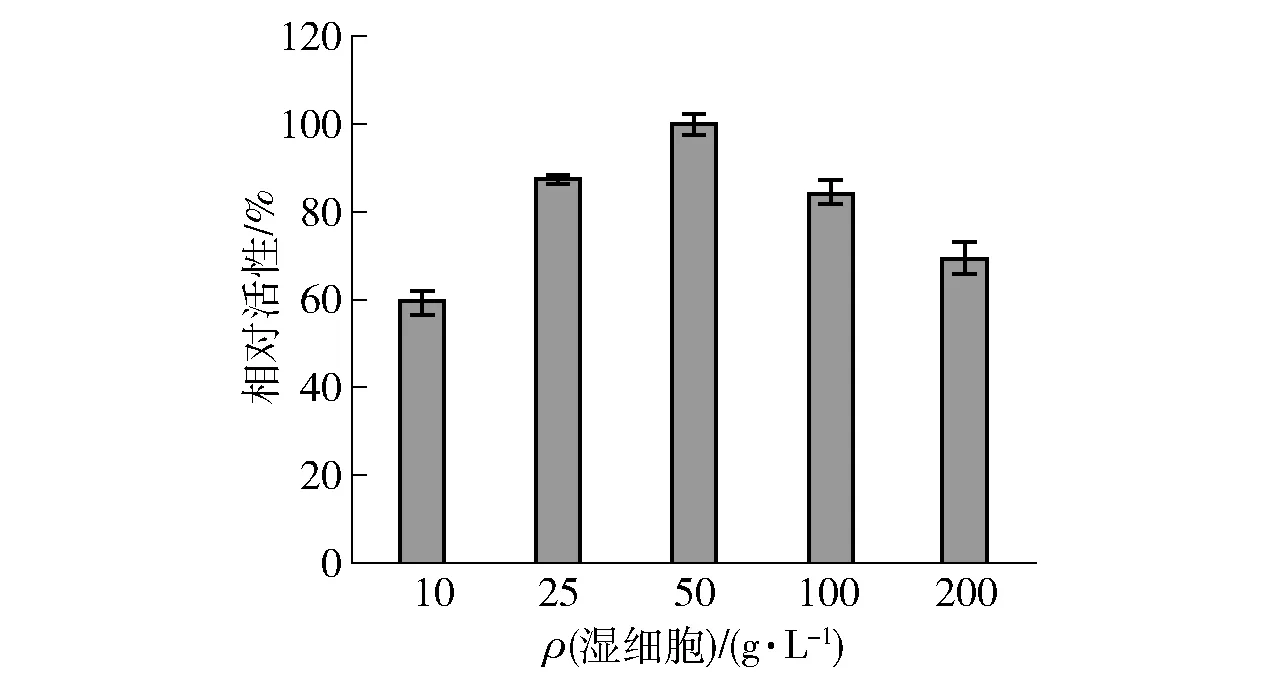
图8 BL-HN细胞量对L-果糖生成的影响Fig.8 Effect of wet cell amounts on formation of L-fructose
L-果糖的合成体系分2步进行:第一步,HLADH-EE转化甘油生成L-甘油醛;第二步,醛缩酶(RhaD)接受L-甘油醛为受体合成L-果糖。因此,优化2种细胞的比例,对协同合成L-果糖是必要的。菌株BL-RB湿细胞质量浓度为150 g/L保持不变,我们对BL-HN的湿细胞质量浓度进行优化,选取BL-HN的湿细胞质量浓度为10、25、50、100和200 g/L进行研究,在35 ℃,pH值为8.0下全细胞转化200 mmol/L甘油,对L-果糖的生成量进行测定(见图8)。由图8可知,随着细胞质量浓度的提高,相对活性呈现先升后降的趋势,当BL-HN的细胞质量浓度较低时,产生的L-甘油醛较少,因此L-果糖的产量低,导致相对活性低;但是,当BL-HN的细胞质量浓度≥50 g/L时,产生的L-甘油醛过多,高浓度的L-甘油醛会抑制醛缩酶RhaD的活性,导致L-果糖的产量下降,相对活性降低。BL-HN最适细胞质量浓度为50 g/L,此时L-果糖产量最高,故选取50 g/L为下一次优化实验的较适细胞质量浓度。
2.4.2温度优化
全细胞反应,归根结底是酶的反应,通常酶的催化作用随温度升高而加速,但温度升高到一定限度后,酶的活性就要钝化,直至完全失活,因此对温度进行优化是必要的。温度设置25、30、35、40、45 ℃ 5个梯度,在pH值为8.0的50 mmol/L Tris-HCl缓冲液中,添加200 mmol/L甘油为底物和50 g/L的BL-HN湿细胞以及150 g/L的BL-RB湿细胞进行全细胞转化反应。12 h后测定不同温度下产物L-果糖的生成量(见图9)。由图9可知,全细胞转化对温度的适应性较好,当反应温度为45 ℃时,其相对活性仍有70%左右,说明细胞膜对酶有很好的保护作用;在35 ℃的条件下,L-果糖相对活性最高,故选取35 ℃为下一次优化实验的较适温度。
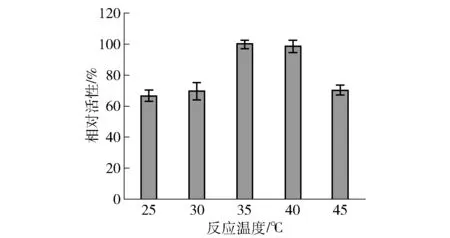
图9 反应温度对L-果糖生成的影响Fig.9 Effect of temperature on formation of L-fructose
2.4.3pH值优化
pH值可以改变底物分子和酶分子的带电状态,从而影响酶和底物的结合,过高或过低的pH值都会影响酶的稳定性,进而使酶遭受不可逆破坏。因此,对pH值进行优化也是必要的。配置pH值为7.5~9.5的50 mmol/L Tris-HCl缓冲液,在35 ℃,200 mmol/L甘油为底物,50 g/L的BL-HN湿细胞和150 g/L的BL-RB湿细胞进行全细胞转化反应。12 h后测定不同pH值下的L-果糖的生成量(见图10)。由图10可知,碱性条件更适合此全细胞转化体系,但是高pH值对L-果糖的产量影响很大。当pH值过高时,大肠杆菌的细胞膜容易裂解,导致胞内酶直接暴露在高pH值的缓冲液中,而醛缩酶RhaD在高pH值的条件下,酶活力低,从而引起L-果糖产量下降。在pH=9.0的条件下,L-果糖相对活性最高,故选取pH=9.0为较适反应的pH值。
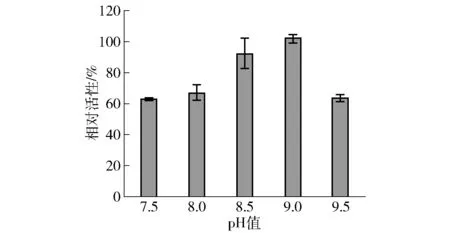
图10 pH值对L-果糖生成的影响Fig.10 Effect of pH on formation of L-fructose
2.4.4甘油的浓度对全细胞转化的影响
底物浓度对酶的活性不产生影响,对酶促反应速率产生影响。随着底物浓度增加,酶促反应速率逐渐加快,单位时间产物的产量提高。设置甘油的浓度为100、200、300、400、500、600 mmol/L 6个梯度,在pH=9.0的50 mmol/L Tris-HCl缓冲液中,添加不同浓度的甘油为底物和50 g/L的BL-HN湿细胞以及150 g/L的BL-RB湿细胞,在35 ℃条件下进行全细胞转化反应。12 h后测定L-果糖的生成量(见图11)。由图11可知,在35 ℃的条件下,L-果糖产量最高,为2.52 g/L。与100 mmol/L甘油底物相比,当甘油浓度提高到400、500和600 mmol/L时,L-果糖的产量分别提高至9.8、10.7和10.9倍;当甘油浓度≤500 mmol/L时,提升甘油浓度对L-果糖的产量影响显著。但是,继续提高甘油浓度到600 mmol/L时,L-果糖的产量仅为2.52 g/L,相较500 mmol/L甘油,产量提升并不明显,因此推测底物甘油已经饱和,产物L-果糖不再随着甘油浓度的增加而明显提高。
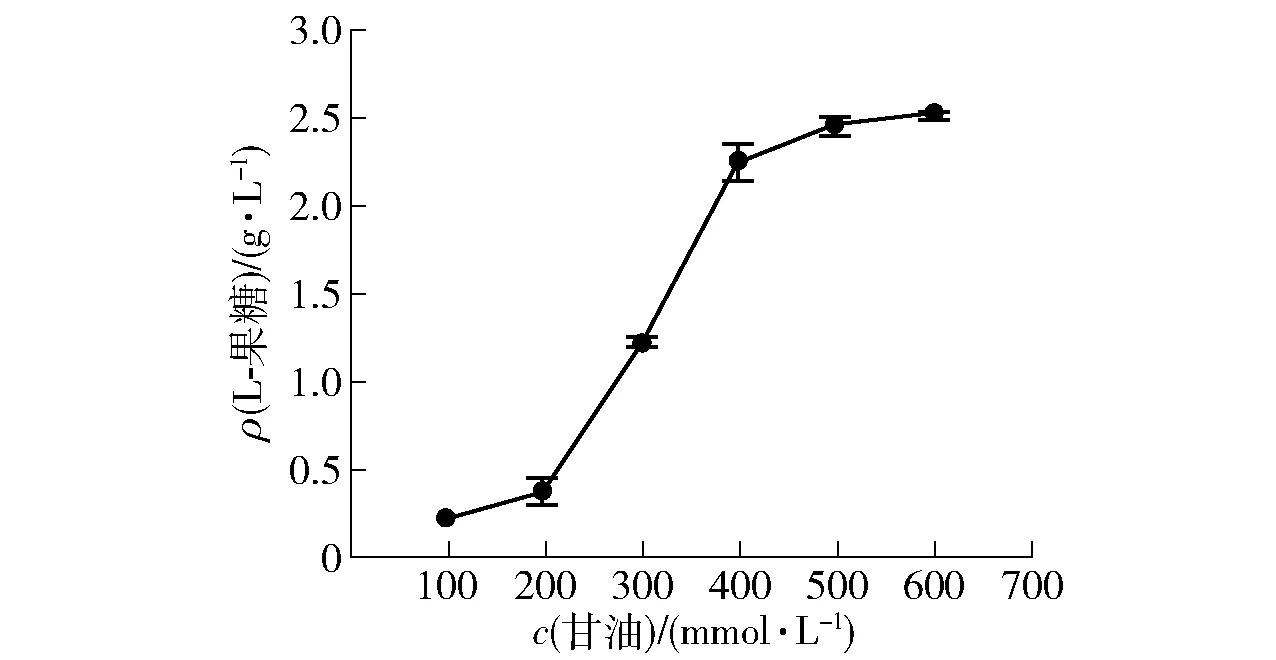
图11 甘油浓度对L-果糖生成的影响Fig.11 Effect of glycerol concentration on formation of L-fructose
综上所述,全细胞转化较适反应细胞质量浓度50 g/L的BL-HN湿细胞以及150 g/L的BL-RB湿细胞,较适反应温度为35 ℃,较适反应pH值为9.0,较适甘油浓度为500 mmol/L。
2.5 正交试验结果
根据单因素实验的结果,选取影响L-果糖产量的各因素中有意义的水平做正交试验,对结果进行极差分析,以确定最佳的反应条件。采用L9(34)正交表,以温度(A)、pH(B)、BL-HN湿细胞质量浓度(C)、甘油浓度(D)作为4个考察因素,选取3个水平进行试验(见表1)。
按表1的正交因素水平设计L9(34)正交试验,结果见表2。
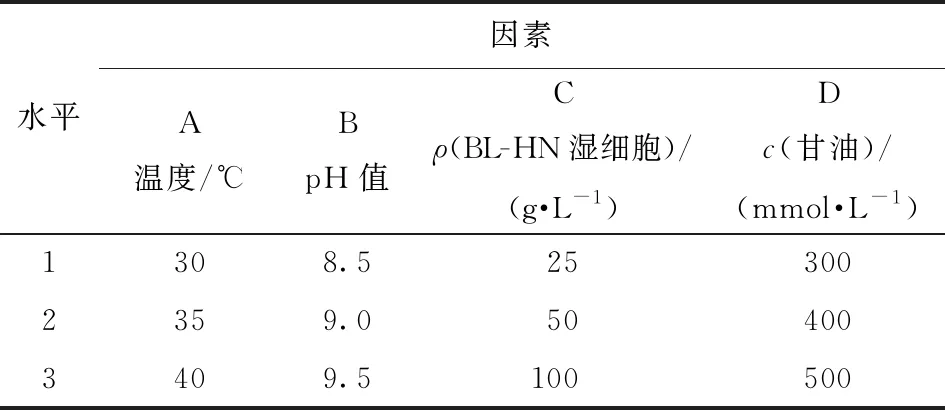
表1 全细胞合成L-果糖正交试验因素水平表
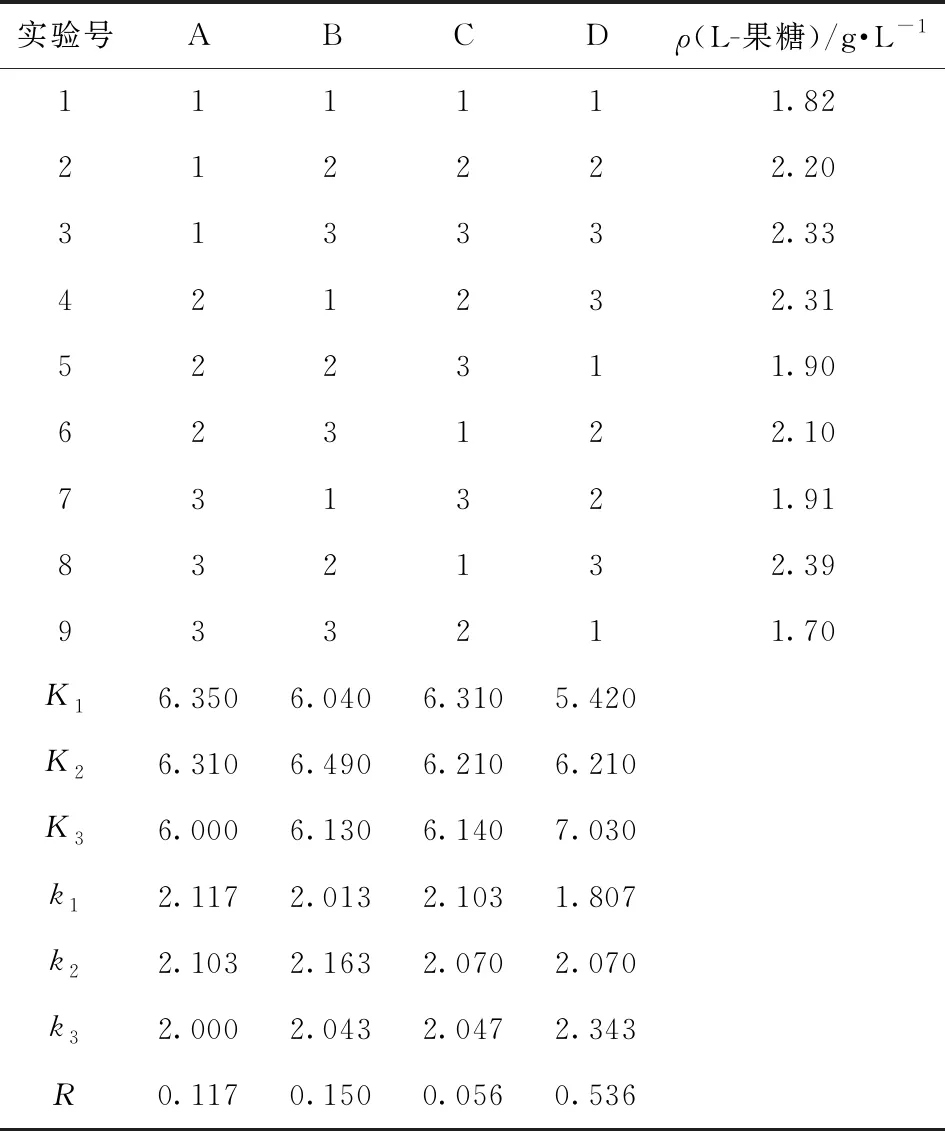
表2 全细胞合成L-果糖正交试验设计及结果
由表2的极差分析结果可以看出,RD>RB>RA>RC,4个因素对合成L-果糖的影响大小依次为:甘油浓度(D)>pH(B)>湿细胞质量浓度(C)>温度(A)。4个因素中,甘油浓度和pH值的影响较为显著,其中,甘油浓度对合成L-果糖的影响最为显著。在试验设计范围内,优化得到全细胞合成L-果糖的优化条件为A3B2C1D3,即温度40 ℃、pH值为9.0、湿细胞质量浓度25 g/L、甘油浓度500 mmol/L。
2.6 验证实验
按照优化条件,进行3次平行实验,L-果糖的生成量分别为2.19、2.34、2.41 g/L,说明该优化可行。
根据正交试验结果可知,温度对全细胞合成L-果糖的影响最小,故可考虑采用30 ℃进行反应。采用此条件,L-果糖的生成量分别为2.15、2.13、2.38 g/L。与正交试验优选出的较佳条件相比,L-果糖的生成量并没有明显降低,且反应需求的温度更低,进一步降低生产成本。
2.7 全细胞转化甘油合成L-果糖产量分析
在温度30 ℃、pH值为9.0、湿细胞质量浓度25 g/L、甘油浓度500 mmol/L条件下进行全细胞转化,连续反应36 h,每隔12 h进行取样,然后测定L-果糖的生成量(见图12)。由图12可知,在反应36 h时,L-果糖产量最高为2.67 g/L。延长转化时间,产量增长缓慢,可能原因是随着产物生成,细胞活性降低,细胞转化生成产物速率下降,从而导致L-果糖产量增长缓慢。在反应的过程中,12 h的样品经离心加热后依然澄清,而36 h的样品经离心加热后有絮状沉淀出现。因此,推断细胞膜在反应的过程中发生了破损,细胞的内容物流出,导致絮状沉淀形成;失去了细胞膜的保护作用,胞内酶活性受到影响,进而影响L-果糖的产率。
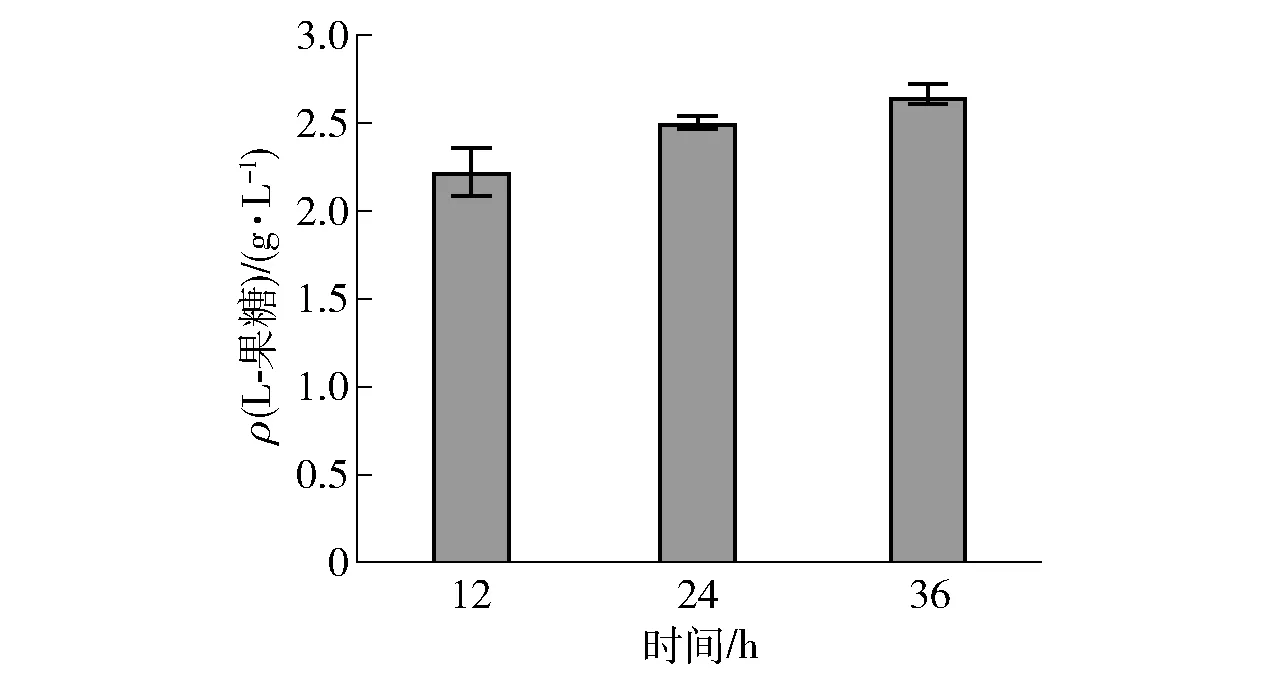
图12 全细胞催化甘油合成L-果糖的产量Fig.12 L-fructose yield from glycerol by whole-cell biocatalysis
3 结 论
本研究建立了全细胞催化甘油合成L-果糖生物转化方法。构建E型马肝乙醇脱氢酶和NADH氧化酶的基因工程菌株,实现从甘油到L-甘油醛的合成,以全细胞作为催化剂催化该反应,偶联NOX,实现NAD+/NADH的合成与再生,解决添加辅因子的问题;并且对表达E型马肝乙醇脱氢酶和NADH氧化酶的菌株进行诱导条件的优化,确认优化诱导条件。通过单因素实验研究温度、pH值、湿细胞质量浓度、甘油浓度对全细胞转化甘油合成L-果糖的影响,利用正交试验得到优化反应条件。在优化反应条件下利用全细胞转化技术连续转化36 h,最终获得L-果糖2.67 g/L。本研究采用全细胞转化方法以廉价的甘油为原料生产L-果糖,不仅省去了繁琐的酶纯化步骤、无须添加辅因子,而且生产成本低廉。希望研究对L-果糖产品绿色生产及现有技术改造提供理论参考。

