扳倒井酒用微生物的分离鉴定及功能性、抗逆性研究
董乔娟,于文娟,许 玲,姜明慧,于盼盼,杨庆振,白秀彬,赵纪文
(山东扳倒井股份有限公司,山东高青 256300)
传统大曲生产与白酒酿造为开放性的固态发酵方式,从而形成了“多微共酵”的发酵体系,是影响白酒风格和品质的重要基础。对于白酒酿造微生物的研究,多集中于功能微生物的分离、筛选、鉴定及应用。在白酒酿造中大量宝贵的微生物资源,对后期应用生产实验,稳定并提高白酒的风格和品质提供基础与保障[1-2]。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 供试材料
扳倒井高温大曲、扳倒井发酵酒醅、扳倒井窖泥。
1.1.2 培养基
细菌分离培养基:营养琼脂;酵母菌、霉菌分离培养基:孟加拉红培养基;细菌保藏培养基:同细菌分离培养基;酵母菌保藏培养基:麦芽汁琼脂培养基;霉菌保存培养基:察氏培养基;细菌种子培养基:葡萄糖1%,牛肉膏1%,氯化钠0.5%;酵母菌种子培养基:玉米糖化液;麸皮固体培养基;细菌液体培养基:同细菌种子培养基;酵母菌液体培养基:麦芽浸粉肉汤;霉菌液体培养基:蛋白胨1%,葡萄糖1%,磷酸氢二钾0.1%,七水硫酸镁0.05%。
1.1.3 仪器设备
HIRAYAMA HVE-50 立式自动灭菌器、ESCO CLASSII BSC AC2-6S1 生物安全柜、Bio-Cinerator红外接种环灭菌器、QL-901 振荡器、江苏太仓DHZ-CA大容量振荡器、上海一恒GPH-9160"隔水式恒温培养箱、上海卉绿DHG-9145A 电热恒温鼓风干燥箱、上海博迅HHS-21-8 数显恒温水浴锅、普析通用T6 新世纪紫外可见分光光度计、OLYMPUSCX41 光学显微镜、德国Eppendorf 5424R 型高速冷冻离心机、德国Biometra Tone 96 型台式PCR扩增仪、君意东方JY330C 琼脂糖凝胶电泳仪、君意东方JY04S-3C凝胶成像分析系统等。
1.2 试验方法
1.2.1 菌种的分离、纯化
微生物的分离培养采用稀释平板涂布法。准确称取25 g 样品,置入装有225 mL 无菌生理盐水和玻璃珠的三角瓶中,振荡10 min,放入30 ℃培养箱中静置30 min。
用移液枪吸取1 mL 震荡均匀的菌悬液,置入装有9 mL 无菌水的试管中,振荡均匀,进行系列稀释,依次稀释到10-6。选取10-3、10-4、10-5、10-64 个稀释梯度分别在营养琼脂和孟加拉红平板上进行涂布,营养琼脂平板于37 ℃下倒置培养24 h;孟加拉红平板于28 ℃下倒置培养2~3 d。
培养结束后,挑取平板上生长出的单菌落,继续进行多次划线等纯培养操作,直至平板上菌落形态单一为止。编号,接种于斜面试管中保藏[3]。
1.2.2 菌株的形态特征观察
宏观形态观察:将细菌接种到营养琼脂培养基上,35 ℃恒温培养2 d,观察菌落特征;将酵母菌接种到麦芽汁琼脂培养基上,28 ℃恒温培养2~3 d,观察菌落特征;将霉菌接种到察氏培养基上,28 ℃恒温培养5~7 d,观察菌落特征。
微观形态观察:将细菌接种到营养琼脂培养基上,35 ℃恒温培养2 d,用接种环挑取少许菌落,制成水浸片,置于10×100 倍油镜下进行观察;将酵母菌接种到麦芽汁琼脂培养基上,28 ℃恒温培养2~3 d,用接种环挑取少许菌落,制成水浸片,置于10×40 倍显微镜下进行观察;将霉菌接种到察氏培养基上,28 ℃恒温培养5~7 d,取1 滴棉兰染色液置于载玻片中央,用透明胶带在菌落边缘粘取少量菌体,覆于染色液上,置于10×40 倍显微镜下进行观察。
1.2.3 菌株的分子生物学鉴定
DNA 的提取使用天根基因组DNA 提取试剂盒。细菌采用16S rDNA 分子生物学鉴定,引物设计为27F:5'-AGAGTTTGATCCTGGCTCAG-3'和5'-GGTTACCTTGTTACGACTT-3';酵母菌采用ITS 分子生物学鉴定,引物设计为ITS5:5'-GGAAGTAAAAGTCGTAACAAGG-3' 和ITS4:5'-TCCTCCGCTTATTGATATGC-3';霉 菌 采用BT 分子生物学鉴定,引物设计为Bt2a:5'-GGTAACCAAATCGGTGCTGCTTTC-3'和Bt2b:5'-ACCCTCAGTGTAGTGACCCTTGGC-3'。利用PCR 扩增技术分别对16S rDNA、ITS 和BT 进行扩增后送样测序,测序工作由上海生工完成。
1.2.4 菌株的冻干管制备及入库保藏
以脱脂牛奶为保护剂,将筛选得到的高酶活菌株和抗逆菌株进行冻干管制备,保存至扳倒井微生物菌种资源库,相关菌种信息录入扳倒井微生物菌种信息管理系统。
1.2.5 高酶活菌株的筛选
取新鲜活化细菌,接种于细菌种子培养基中,以37 ℃、180 r/min 摇床培养过夜,制备成菌悬液。将悬液接种于麸皮固态培养基,接种量为5%,于37 ℃培养箱中培养72 h。40 ℃烘干备用。
取新鲜活化酵母菌,接种于酵母菌种子培养基中,于28 ℃、140 r/min 摇床培养过夜,制备成菌悬液。将悬液接种于麸皮固态培养基,接种量为10%,于28 ℃培养箱培养72 h,40 ℃烘干备用。
霉菌直接挑取菌体接种于麸皮固态培养基,25 ℃培养5~7 d,40 ℃烘干备用。
淀粉酶活力测定方法:称取10 g 麸曲置于250 mL 烧杯中,加入180 mL 蒸馏水和20 mL 的pH5.5 磷酸缓冲液,搅拌均匀,35 ℃水浴锅中浸提1 h,滤纸过滤。取9 mL 1.0%淀粉缓冲液(50 ℃,预热5 min)→加1 mL酶液(立即计时,50 ℃恒温水浴准确反应30 min)→迅速吸取0.5 mL 反应液于装有1.5 mL DNS 溶液中(采用25 mL 具塞比色管)→煮沸15 min,冷却,加10.5 mL 蒸馏水(摇匀)在550 nm波长比色。
蛋白酶活力测定方法:按照SB/T 10317—1999方法进行测定。
脂肪酶活力测定方法:按照GB/T 23535—2009方法进行测定。
1.2.6 耐高温菌株的筛选
将活化后的细菌,划线接种于营养琼脂平板上,分别置于35 ℃、40 ℃、45 ℃、50 ℃、55 ℃静置培养48 h,观察细菌生长情况。
将活化后的酵母菌,划线接种于麦芽汁琼脂平板上,分别置于30 ℃、40 ℃、45 ℃、50 ℃、55 ℃静置培养48 h,观察酵母菌生长情况。
将活化后的霉菌,三点接种法接种于察氏培养基平板上,分别置于30 ℃、40 ℃、45 ℃、50 ℃、55 ℃静置培养5~7 d,观察霉菌生长情况。
1.2.7 耐酸菌株的筛选
分别用pH3.0、pH4.0 和pH5.0 缓冲液代替细菌、酵母菌和霉菌液体种子培养基中的蒸馏水,制成pH3、pH4、pH5、pH 自然的细菌、酵母菌、霉菌液体培养基。
将细菌分别接种于pH3、pH4、pH5、pH 自然的细菌液体培养基中,以35℃、180 r/min 摇床培养48 h;将酵母菌分别接种于pH3、pH4、pH5、pH 自然的酵母菌液体培养基中,以28 ℃、180 r/min 摇床培养48 h;将霉菌分别接种于pH3、pH4、pH5、pH 自然的霉菌液体培养基中,以28 ℃、180 r/min 摇床培养7 d。
生长量测定:细菌、酵母菌不同pH 值下生长量测定采用比浊法,以各自对应pH 值的空白培养基为对照,在波长600 nm 下用比色管测定培养液的吸光度值OD600;霉菌不同pH 值下生长量测定采用称干重法:将培养液用滤纸过滤,少量水洗涤,烘箱80 ℃下烘干,称菌丝干重。
2 结果与分析
2.1 扳倒井酿酒微生物的分离筛选及鉴定结果
通过分离和多次分纯对比,结合菌落外观和镜检观察,从扳倒井大曲、酒醅及窖泥中初步分离得到61 株细菌、19 株酵母菌和32 株霉菌,其中83 株分离自大曲、14株分离自酒醅、15株分离自窖泥。
细菌主要为地衣芽孢杆菌、贝莱斯芽孢杆菌、暹罗芽孢杆菌、普通高温放线菌、枯草芽孢杆菌、特基拉芽孢杆菌、黄海芽孢杆菌、淤泥大洋芽孢杆菌、韩国芽孢八叠球菌、沙福芽孢杆菌、泛菌属、短杆菌属等;酵母菌主要为扣囊复膜孢酵母、异常威克汉姆酵母、伯顿丝孢毕赤酵母、库德毕赤酵母、戴尔凯氏有孢圆酵母、奇异酿酒酵母;霉菌主要为谢瓦散囊菌、黑曲霉、米根霉、绳状青霉、产黄青霉、金灰青霉、烟曲霉、溜曲霉、聚多曲霉、宛氏拟青霉、泡盛曲霉、雪白丝衣霉等。
2.2 高酶活菌株的筛选
将初筛得到的112 株菌种接种至麸皮固体培养基中,培养结束后40 ℃烘干,分别测定其蛋白酶、脂肪酶和淀粉酶活力,筛选出酶活力较高的菌株,结果见表1—表4。
2.3 耐高温菌株的筛选
将初筛得到的112 株菌种接种至平板上,分别置于不同温度下静置培养,筛选出耐高温(55 ℃)菌株15株,结果见表5。
2.4 耐酸菌株的筛选
将112 株菌种分别接种至不同pH 值的液体培养基中,培养结束后测定其生长量,筛选出1 株耐酸(pH3)细菌琥珀葡萄球菌(保藏编号BDJ20103),其余19株酵母菌和32株霉菌均耐pH3.0。
3 结论
本试验利用梯度稀释法和划线纯化法,对扳倒井大曲、酒醅及窖泥中的微生物进行全面的分离纯化,共得到112 株菌种,包括61 株细菌、19 株酵母菌和32株霉菌,其中83株分离自大曲、14株分离自酒醅、15株分离自窖泥。

表1 高产中性蛋白酶菌株筛选结果

表2 高产脂肪酶菌株筛选结果
通过形态观察和16S rDNA、ITS 及BT 序列测定,对112 株菌种进行鉴定。并对其进行冻干管制作,保藏至扳倒井微生物菌种资源库。
对112 株菌种麸皮培养物的淀粉酶、蛋白酶和脂肪酶活力进行测定,筛选出高产淀粉酶菌株21株、高产中性蛋白酶菌株16 株、高产酸性蛋白酶菌株6株、高产脂肪酶菌株20株。
对112 株菌种在不同温度下的生长情况进行测定,筛选出耐55 ℃的菌株15株。

表4 高产酸性蛋白酶菌株筛选结果
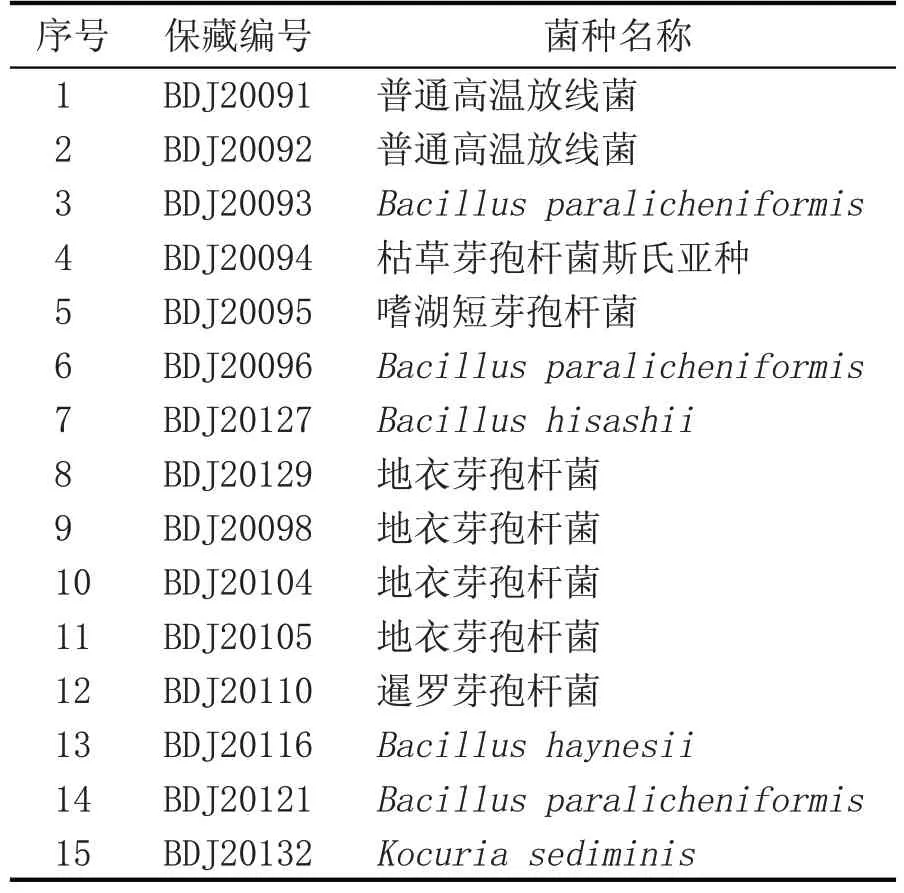
表5 耐高温(55 ℃)菌株筛选结果
对112 株菌种在不同pH 值液体培养基中的生长情况进行测定,筛选出耐pH3 的细菌1 株、酵母菌19株、霉菌32株。
在后续试验中,将进行耐稀氧、耐酒精等抗逆性能的筛选;并进一步对筛选出的菌株进行单菌株和复合菌株的小型发酵试验,以筛选出适合大曲生产和白酒酿造的优良功能微生物菌株和复合菌剂。

