HtrA2/Omi差异化调控年轻细胞及衰老细胞的应激敏感性*
杨 婵,太颢然,李小双,苏炳银,李淑蓉△
1.成都医学院 发育与再生重点实验室(成都 610500);2.成都医学院 病理学与病理生理学教研室(成都 610500);3.成都医学院 人体解剖与组织胚胎学教研室(成都 610500)
细胞衰老是指细胞在经历了多次有丝分裂之后,进入一种持续性细胞周期阻滞状态,该过程可发生在细胞受到某些特定的刺激后,如DNA损伤、氧化应激、癌基因表达等。1961年,Hayflick等[1]发现,体外培养的纤维细胞增殖是有限的,不会无限增殖下去。随后,这种现象在动物体内也被发现[2]。细胞衰老后,复制能力下降,但是仍然具有活跃的代谢能力[3],例如它们能够特异性地分泌衰老相关分泌表型(senescence-associated secretory phenotype,SASP)因子[4],其中包括白介素、趋化因子、生长因子、蛋白酶等。衰老细胞其它的改变还包括:体积变大,形态变扁平,衰老相关异染色质位点增加,端粒长度缩短,衰老相关β半乳糖苷酶活性升高,核纤层蛋白B1减少以及NF-κB信号通路激活等[5]。衰老细胞存在于生物体的各个部位,并且它的产生贯穿生物体的整个生命过程。
HtrA2/Omi是一种非ATP依赖的线粒体丝氨酸蛋白酶。研究[6-7]表明,HtrA2/Omi在心脏和肾脏的损伤模型如缺血再灌注模型中主要发挥促进细胞凋亡的作用,而在神经系统中主要起神经保护作用[8-9]。HtrA2/Omi在不同生理病理情况下表现出不同特质,具有抗凋亡和促凋亡的双重性。本研究希望通过探讨HtrA2/Omi调控年轻细胞及衰老细胞应激敏感性的差异,从而解释HtrA2/Omi在不同生理病理情况下所表现的功能差异以及探讨其可能原因,为清除衰老细胞提供一个新思路。
1 材料与方法
1.1 材料
人脐静脉内皮细胞HUVEC由美国ATCC细胞库提供,高糖DMEM培养基、胎牛血清、双抗(青霉素+链霉素)、0.25%胰酶均购自美国Gibco公司,Blasticidin S HCL购自美国Selleck公司,LV-HtrA2、pTetOn-HtrA2购自上海吉凯基因,β-半乳糖苷酶染色试剂盒、TUNEL试剂盒购自江苏碧云天公司,HtrA2/Omi单克隆抗体(ab75982)和GAPDH多克隆抗体购自英国Abcam公司。
1.2 细胞培养
HUVEC细胞,用DMEM完全培养基(含10%胎牛血清),置于37 ℃、5% CO2、95%湿度的恒温细胞培养箱中静置培养,待细胞融合度达到80%~90%时传代。
1.3 细胞衰老模型建立和SA-β-gal染色
当HUVEC进入对数期时,将其均匀铺于6孔板中,分别用浓度梯度为0、50、100、150、200、250 μmol/L的H2O2在5%CO2培养箱里处理1 h,PBS漂洗2遍,孵育3~5 d,用倒置显微镜观察细胞形态并拍照计数。吸除培养基,PBS洗1次,每个孔内加入1 mL β-半乳糖苷酶染色固定液,室温固定15 min,PBS洗涤3次,每孔加入1 mL按说明书已配好的衰老染色液,置于37 ℃普通培养箱孵育过夜。倒置显微镜白光观察细胞染色情况,拍照计数。选取一个细胞衰老数量相对较多,而凋亡数量较少的H2O2处理浓度作为细胞衰老模型处理条件用于后续实验。
1.4 建立过表达HtrA2/Omi的稳转株
用能诱导HtrA2/Omi表达的质粒pTetOn-HtrA2与线性选择标记物Bla®一起转染HUVEC细胞,并用含转染试剂的培养基培养48 h,然后将培养基换为含10 μmol/L Blasticidin的培养基,筛选带有目的基因的细胞,5% CO2培养箱中培养4 d,然后将培养基换为新鲜培养基,最终得到能用DOX诱导HtrA2/Omi稳定表达的HUVEC细胞株。实验分为3组:1)对照组为转染空载体(Ctrl)组;2)过表达野生型HtrA2/Omi组为转染HtrA2过表达序列HtrA2(WT)组;3)过表达酶活性失活突变型HtrA2/Omi组为转染HtrA2突变序列HtrA2(S306A)组。
1.5 细胞凋亡模型建立
当HUVEC进入对数期时,将其均匀铺于6孔板中,分别用浓度梯度为0、100、200、300 μmol/L的H2O2处理1 h,PBS漂洗2遍,加入含有DOX的工作培养基,置于5% CO2培养箱内孵育,12 h后倒置显微镜下观察细胞形态及数量,同时拍照计数。
1.6 免疫印迹实验
用RIPA裂解液裂解细胞后收集到的蛋白样品进行BCA法测定蛋白浓度,定量后加入等量2×SDS-PAGE蛋白上样缓冲液,混匀,加入到12%的丙烯酰胺凝胶凹槽内进行电泳。然后恒压50V转膜2 h,用5%脱脂牛奶室温封闭膜1 h,TBST漂洗1遍,浸入Anti-HtrA2的一抗工作液内,4 ℃孵育过夜,TBST洗3次,每次10 min,选择Anti-rabbit IgG-HRP摇床上室温孵育2 h,TBST洗3次,每次10 min。最后ECL发光显影液按照A液∶B液=1∶1配制,均匀滴加在PVDF膜上,用Bio-Rad凝胶成像仪曝光显影。显影后继续敷另一抗体GAPDH,其对应的HRP为Anti-mouse,步骤参照同前。
1.7 TUNEL检测细胞凋亡
将HUVEC的Ctrl、HtrA2(WT)、HtrA2(S306A)3种细胞株种于铺有爬片的24孔板内,分别用不同浓度的DOX处理,24 h后吸除含DOX的工作培养基,PBS洗1次,4% PFA固定细胞30 min,PBS洗1次,用0.3% TritonX-100室温孵育5 min,PBS洗2次,在样品上加50 μL TUNEL检测液,然后置于不含CO2的37 ℃孵箱中避光孵育60 min,PBS洗3次,加入DAPI 100 μL避光孵育15 min,PBS洗3次,取出爬片,用抗荧光淬灭封片液封片,FV-1000激光共聚焦显微镜下观察。
1.8 统计学方法
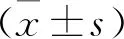
2 结果
2.1 衰老细胞内HtrA2/Omi的表达多于年轻细胞
本研究用不同浓度梯度H2O2处理HUVEC细胞,37 ℃、5%CO2培养箱内孵育3~5 d,然后进行SA-β-gal衰老染色,染色24 h后在倒置显微镜下观察到衰老细胞分泌到胞质的β半乳糖苷酶被染成绿色,H2O2浓度为100 μmol/L这组大部分细胞体积变大、形态变扁平及SA-β-gal染色阳性,提示该组大部分细胞发生了衰老,同时对SA-β-gal染色阳性细胞和剩余细胞进行数量统计,结果显示100 μmol/L这组细胞衰老率相对较高,同时剩余细胞的数量也相对于150、200、250 μmol/L组较多,即凋亡数量相对较少。因此,后续实验用100 μmol/L的H2O2处理贴壁HUVEC细胞1 h,培养5 d作为衰老模型。WB检测细胞中HtrA2/Omi蛋白表达水平,结果显示,HUVEC发生衰老后,其细胞内HtrA2/Omi的蛋白表达水平高于年轻细胞,同时qRT-PCR结果显示,HtrA2/Omi的mRNA水平在衰老细胞内也升高(图1)。
注:A:SA-β-gal染色检测不同浓度H2O2处理细胞后的衰老程度;B:图A中衰老细胞和剩余细胞数量的统计结果;C:WB检测衰老细胞和年轻细胞内HtrA2/Omi的蛋白表达量;D:qRT-PCR检测衰老细胞和年轻细胞内HtrA2/Omi的mRNA水平;***P<0.001
2.2 构建可用Doxycycline诱导HtrA2/Omi表达的稳转株
构建过表达HtrA2/Omi的稳转株后,首先检测其有效性,结果显示50 μmol/L的DOX即可明显诱导HtrA2/Omi过表达,5 μmol/L DOX诱导效果不明显,而500 μmol/L和5 000 μmol/L DOX诱导的表达量远远多于本底表达。有研究[10]证明,大量过表达HtrA2/Omi会直接诱导细胞凋亡发生,因此后续实验采用浓度为50 μmol/L的DOX诱导HtrA2/Omi适量过表达。该结果证明了过表达HtrA2/Omi的稳转株构建成功(图2)。
注:WB检测HtrA2/Omi的蛋白表达,HtrA2有两条明显的条带,上方为加了3个标签的外源性HtrA2,下方为细胞本身表达的内源性HtrA2
2.3 HtrA2/Omi增强年轻细胞抗氧化应激能力
分别用浓度为100、200、300 μmol/L的H2O2处理HUVEC 3种细胞株[对照Ctrl组/过表达HtrA2(WT)组/突变HtrA2(S306A)组]1 h,以未用H2O2处理的这3种细胞株作为对照。在未用H2O2处理的对照组内,HUVEC的3种细胞株数量无明显差异;而在用不同浓度H2O2处理的3种凋亡模型中,加DOX诱导HtrA2(WT)组过表达HtrA2/Omi后细胞的凋亡数量明显少于Ctrl组和HtrA2(S306A)组。然后对H2O2浓度为100、200、300 μmol/L 3个组别的细胞剩余数量进行统计分析,结果显示,随着H2O2浓度的增加,3种细胞的剩余数量逐渐减少,并且在这3个浓度组别内,过表达野生型HtrA2/Omi的细胞剩余数量远多于Ctrl组和HtrA2(S306A)组(P<0.001),同时Ctrl组和HtrA2(S306A)组之间差异无统计学意义(P>0.05)(图3)。
取上面浓度为100 μmol/L的H2O2组别的3种细胞株分为两个实验组,一组加DOX诱导HtrA2/Omi过表达,另外一组不加DOX,5% CO2培养箱内孵育24 h后TUNEL检测细胞凋亡情况,结果显示诱导HtrA2/Omi过表达的HtrA2(WT)组(6.91±1.26)%细胞其凋亡率明显低于未加DOX实验组的3种细胞[Ctrl(28.30±1.59)%、WT(29.70±3.27)%和S306A(30.37±2.74)%]以及加DOX实验组的Ctrl组(25.16±1.87)%细胞和S306A(HtrA2)组(33.80±1.83)%细胞,并且未加DOX诱导HtrA2/Omi过表达的3种细胞之间无明显差异,说明DOX不会对细胞凋亡产生影响。以上结果证明当细胞受到的应激刺激在线粒体可修复范围内时,HtrA2/Omi能够通过提高细胞对氧化应激的抗性来维持细胞的内稳态,达到年轻细胞抗凋亡的效果(图4)。
2.4 HtrA2/Omi促进应激下衰老细胞凋亡
100 μmol/L H2O2处理HUVEC 3种细胞株[对照Ctrl组/过表达HtrA2(WT)组/突变HtrA2(S306A)组]1 h,5% CO2培养箱内孵育5 d,构建细胞衰老模型,倒置显微镜下可见细胞体积变大、形态变扁平。然后用含DOX的工作培养基培养3种衰老细胞24 h,并用50 μmol/L H2O2处理20 min,换成新鲜培养基培养12 h后观察到HtrA2(WT)组(41.09±0.25)%衰老细胞的凋亡数量多于对照Ctrl组(18.88±1.52)%和突变HtrA2(S306A)组(20.77±0.55)%,并且差异有统计学意义(P<0.05)。说明对于已经处于衰老状态的细胞,HtrA2/Omi会增加细胞对于应激刺激的敏感性,导致衰老细胞更容易发生凋亡(图5)。
3 讨论
衰老细胞是一把双刃剑,它对于人体生理必不可少,有颇多益处,如衰老细胞在胚胎早期可诱导胚胎发育成型[11],明显降低癌症发病率[12]以及促进伤口愈合[13]。然而,从某些方面来看,衰老细胞对人体也有不同程度的损害,比如一方面衰老细胞分泌的SASP通过旁分泌和内分泌攻击和损害附近和远处的正常细胞和组织[14];另一方面随着年龄增大,当衰老细胞的产生速度快于清除速度时,它在机体里面就会积累起来,引起一系列的不良反应,导致机体对年龄相关性疾病更加易感,如动脉粥样硬化[15]、2型糖尿病[16]、疲乏[17]、骨关节炎[18]、慢性阻塞性肺疾病[19]及神经退行性疾病[20]等。研究[24]表明,通过药物或者基因P16INK4a等方法清除衰老细胞后,能够延缓人类年龄相关性疾病的发生发展[21-23],并且能够一定程度的延长小鼠寿命。因此寻找更有效的清除衰老细胞的方法能为临床延缓和治疗衰老相关性疾病提供新思路。
在具体的生理病理模型中研究HtrA2/Omi时发现它不仅具有促凋亡的作用,同时还能发挥抑制细胞凋亡的作用,比如HtrA2/Omi在前列腺癌、乳腺癌、喉癌、胃腺癌[25]等肿瘤组织中高表达,并且具有防止癌细胞转移的作用[26]。目前对于HtrA2/Omi表现为抗凋亡和抑凋亡双重性的原因和机制仍不清楚。本研究发现当细胞发生衰老后,HtrA2/Omi的表达明显增加,猜测HtrA2/Omi在年轻细胞和衰老细胞中可能发挥了不同作用。已有研究[27-28]证明,HtrA2/Omi在细胞内所处的位置不同,它所呈现的功能也不尽相同:正常情况下,49 KD的含有线粒体定位序列(mitochondrial targeting sequence,MTS)的HtrA2/Omi酶原被运输到线粒体膜间隙,并剪切掉MTS成36 KD的成熟型蛋白酶,通过降解错误折叠、损坏和氧化的蛋白质来维持线粒体内稳态,发挥线粒体质量控制作用。受到的损伤大于其修复能力时,大量凋亡蛋白聚集到线粒体上影响其膜完整性,导致线粒体膜通透性增加,这时HtrA2/Omi被释放到胞质,可通过caspase依赖和非依赖途径诱导细胞凋亡[29]。因此,从细胞层面来看,HtrA2/Omi在细胞不同生命阶段(能正常增殖的分化分裂阶段和生长阻滞的衰老阶段)发挥不同作用具有可能。因此,本研究对HtrA2/Omi在具体细胞状态下发挥的作用进行了探讨。为了使HtrA2/Omi发挥的功能更加明显,本研究通过构建可诱导表达HtrA2/Omi的稳转细胞株,观察HtrA2/Omi表达对年轻细胞和衰老细胞对氧化应激响应的影响。结果发现过表达HtrA2/Omi对年轻细胞和衰老细胞的命运都产生了影响。对于年轻细胞,过表达HtrA2/Omi增加了细胞对氧化应激的抗性,表现为细胞受到氧化应激刺激时凋亡数量减少,即细胞不易发生凋亡;然而直接在衰老细胞内过表达HtrA2/Omi后,细胞凋亡数量增多,说明HtrA2/Omi通过使衰老细胞对氧化应激更加敏感来减弱衰老状态的稳定性,即更易发生凋亡。
综上所述,HtrA2/Omi无论是抑制年轻细胞凋亡或者促进衰老细胞凋亡,都呈保护机制,猜想如果能通过增加机体内HtrA2/Omi的表达从而提高年轻细胞对氧化应激的抗性及降低衰老细胞对氧化应激的抗性,也许能增加体内有正常复制能力的年轻细胞,而减少生长阻滞的衰老细胞,最终达到减缓年龄相关性疾病的发生发展的目的。要验证这一猜想还需要对HtrA2/Omi进行机制研究和大量的动物实验,从而解决一系列问题,比如HtrA2/Omi的表达量精确到多少时对年轻细胞衰老的抑制作用和衰老细胞凋亡的促进作用效果明显,如何在人体内过表达HtrA2/Omi,以及HtrA2/Omi增加后对人体是否有副作用等。

