新型植入式脊髓电刺激系统在羊的生物安全性和组织相容性研究*
毛 鹏 李怡帆 李春蕊 王志燕 化 朋 王新星 王泊宁 樊碧发 李路明
(1 中日友好医院疼痛科,北京 100029;2 北京中医药大学研究生院,北京 100029;3 中日友好医院日间手术中心,北京 100029;4 清华大学神经调控技术国家工程实验室,北京 100084;5 河北省定州市人民医院疼痛科,定州 073009)
脊髓电刺激 (spinal cord stimulation, SCS) 是一种集电子和生物材料于一体的神经调控疗法,广泛用于慢性顽固性疼痛的治疗[1]。我国自2003 年中日友好医院开展这项技术以来,适应证不断扩展,例数也不断增加,广受病人好评。由于SCS 系统依赖进口,价格高昂,限制了其临床应用,无法满足我国大量慢性疼痛病人治疗的需要[2~4]。为打破国外对SCS 系统的技术垄断,促进我国神经调控技术的发展,中日友好医院与清华大学神经调控技术国家工程实验室合作,开发研制具有完全自主知识产权的植入式脊髓电刺激系统。由于羊的脊柱结构与人相似,因此本研究选取小尾寒羊对其生物安全性和组织相容性进行评价。
方 法
1.实验动物和仪器
选取健康成年雄性小尾寒羊3 只(编号羊1~3),体重25~35 kg,由中国医学科学院心血管疾病国家重点实验室动物实验中心提供并进行饲养。实验用植入式脊髓刺激电极(型号:L3211、L3212、L3213、L3214、L3252-65、L3253-65)和脉冲发生器 (Implantable pulse generator,IPG) 由北京品驰医疗设备有限公司提供。
2.手术方法
实验羊术前禁食12 h,静脉注射舒芬太尼(宜昌人福制药有限公司,2 ml:0.1 mg,H20054172)1 μg·kg-1、丙泊酚乳状注射液(江苏恩华药业有限公司,20 ml:0.2 g,H20123138)4 mg·kg-1麻醉。取俯卧位,常规消毒铺巾。在X 线透视引导下,择L6-7棘突间隙行硬膜外腔穿刺(穿刺电极,羊1 和3,见图1A)或用咬骨钳咬除L6和L7部分椎板,暴露硬膜外腔(外科电极,羊2,见图1B)。成功后,根据评价需要,分别将穿刺电极和外科电极置入相应椎体水平,并采用穿刺套装中的固定“锚”妥善固定于棘上韧带;再于羊臀部外上区皮下作囊袋,植入IPG并与电极相连接。阻抗测试无误后,缝合切口,以无菌敷料包扎。
3.术后处理
术后定期肌肉注射青霉素(2 万IU·kg-1)预防感染并开机刺激,采用同一参数刺激,持续4 周。观察并记录术后羊的一般情况、行为学反应、血WBC 水平、电阻抗值,持续4 周(见表1)。
4.取材
术后4 周,在X 线透视下观察电极位置,并与术后即刻电极位置相比较;静脉推注氯化钾注射液(大冢制药,10 ml:1.5 g,H20053711)2 支处死动物,切开囊袋,取出IPG;依次切开脊柱区皮肤筋膜,分离椎旁肌肉,用咬骨钳咬除椎板,暴露脊髓和刺激电极,观察电极周围组织增生情况,截取受刺激和未受刺激的脊髓节段各少许,分别浸泡于10%甲醛溶液(南昌雨露实验器材有限公司)中。
5.观察指标
观察术后羊的一般情况(生命体征、四肢活动情况等),观察有无出血、血肿、局部感染、脑脊液漏等并发症,记录术前、术后3 天、7 天和10 天的血WBC 水平,记录术中、术后1 天、3 天、1 周、2 周、3 周和4 周的设备阻抗值,制作并观察脊髓标本的HE 染色病理切片。
6.统计学分析
结 果
1.术后一般情况
术后羊的切口愈合良好,未见出血、血肿、局部感染、脑脊液漏等并发症,生命体征平稳。羊1在术后第1 天时右后肢轻微运动不协调,调整刺激电压后恢复正常。其余羊四肢活动正常,未见异常步态、肌肉萎缩和痉挛等。
2.血WBC 水平
所有羊在术后第3 天时WBC 水平均稍升高,在术后第7天左右恢复正常,总体波动不大(P > 0.05,见表2)。
3.阻抗值测定
触点13 在术后3 周时与基线相比有统计学差异(Huynh-Feldt: P = 0.011),但仍处于生物组织正常阻抗范围(300 Ω~1 500 Ω);其余触点在术后各时间点,特别是第4 周时的电阻抗值与术后即刻相比未见明显改变(见表3)。
4.电极位置和组织增生情况
术后4 周时,经X 线透视确定,所有羊的植入电极的位置较术后即刻无明显改变。取材时,电极周围未见明显组织增生、包裹。

表1 实验羊的术后刺激模式Table 1 Postoperative Stimulation Mode of Sheep
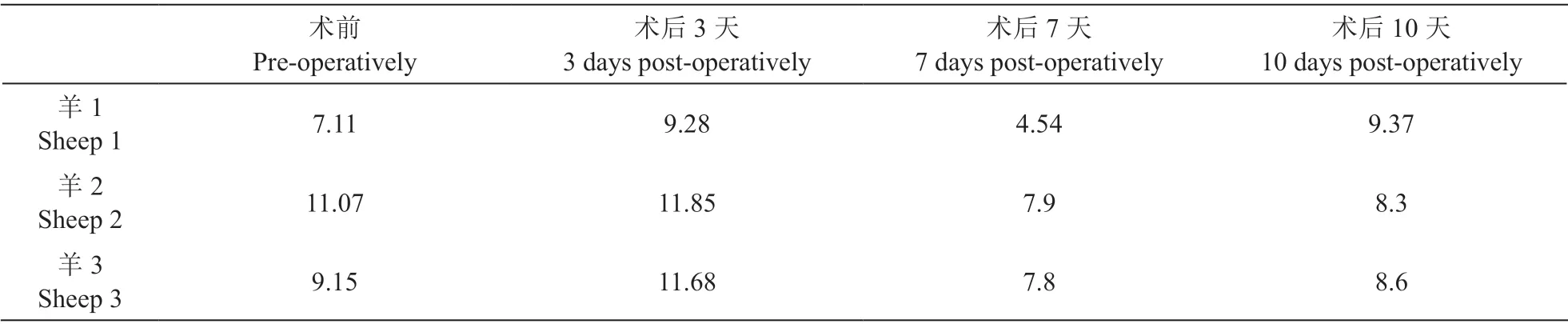
表2 手术前后实验羊的白细胞计数(109·L-1)Table 2 Changes of white cell counts of sheep after implantation (109·L-1)
表3 术中及术后4 周内实验羊体内电极阻抗值测试结果(Ω, ±SD)Table 3 Intraoperative and postoperative impedances of contacts in sheep (Ω, ±SD)
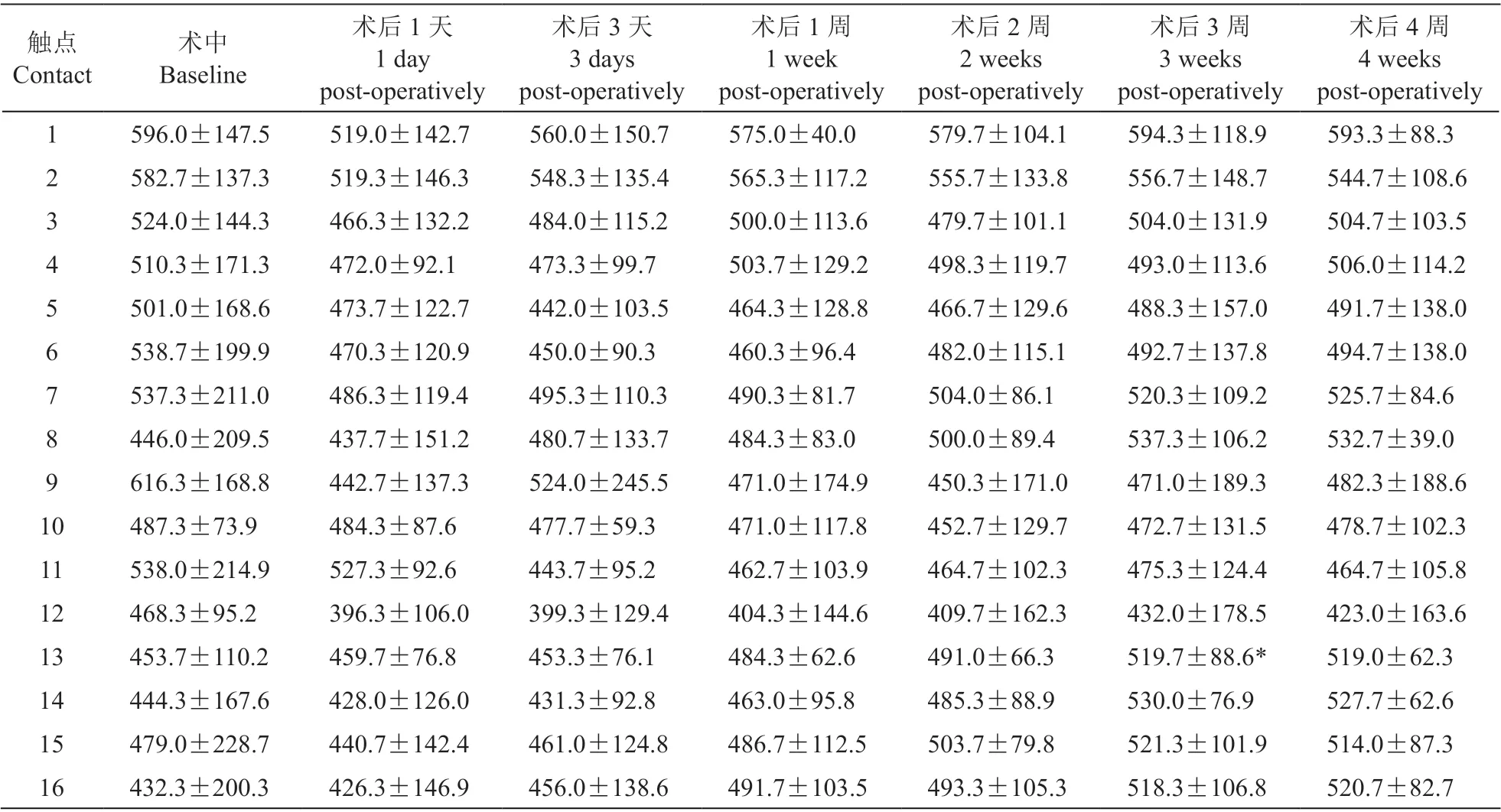
表3 术中及术后4 周内实验羊体内电极阻抗值测试结果(Ω, ±SD)Table 3 Intraoperative and postoperative impedances of contacts in sheep (Ω, ±SD)
*P < 0.05,与基线相比;compared with baseline.
术后4 周4 weeks post-operatively 1 596.0±147.5 519.0±142.7 560.0±150.7 575.0±40.0 579.7±104.1 594.3±118.9 593.3±88.3 2 582.7±137.3 519.3±146.3 548.3±135.4 565.3±117.2 555.7±133.8 556.7±148.7 544.7±108.6 3 524.0±144.3 466.3±132.2 484.0±115.2 500.0±113.6 479.7±101.1 504.0±131.9 504.7±103.5 4 510.3±171.3 472.0±92.1 473.3±99.7 503.7±129.2 498.3±119.7 493.0±113.6 506.0±114.2 5 501.0±168.6 473.7±122.7 442.0±103.5 464.3±128.8 466.7±129.6 488.3±157.0 491.7±138.0 6 538.7±199.9 470.3±120.9 450.0±90.3 460.3±96.4 482.0±115.1 492.7±137.8 494.7±138.0 7 537.3±211.0 486.3±119.4 495.3±110.3 490.3±81.7 504.0±86.1 520.3±109.2 525.7±84.6 8 446.0±209.5 437.7±151.2 480.7±133.7 484.3±83.0 500.0±89.4 537.3±106.2 532.7±39.0 9 616.3±168.8 442.7±137.3 524.0±245.5 471.0±174.9 450.3±171.0 471.0±189.3 482.3±188.6 10 487.3±73.9 484.3±87.6 477.7±59.3 471.0±117.8 452.7±129.7 472.7±131.5 478.7±102.3 11 538.0±214.9 527.3±92.6 443.7±95.2 462.7±103.9 464.7±102.3 475.3±124.4 464.7±105.8 12 468.3±95.2 396.3±106.0 399.3±129.4 404.3±144.6 409.7±162.3 432.0±178.5 423.0±163.6 13 453.7±110.2 459.7±76.8 453.3±76.1 484.3±62.6 491.0±66.3 519.7±88.6* 519.0±62.3 14 444.3±167.6 428.0±126.0 431.3±92.8 463.0±95.8 485.3±88.9 530.0±76.9 527.7±62.6 15 479.0±228.7 440.7±142.4 461.0±124.8 486.7±112.5 503.7±79.8 521.3±101.9 514.0±87.3 16 432.3±200.3 426.3±146.9 456.0±138.6 491.7±103.5 493.3±105.3 518.3±106.8 520.7±82.7触点Contact术中Baseline术后1 天1 day post-operatively术后3 天3 days post-operatively术后1 周1 week post-operatively术后2 周2 weeks post-operatively术后3 周3 weeks post-operatively
5.脊髓病理
将刺激节段和未刺激节段进行切片、HE染色[5],镜下观察:SCS 刺激节段的脊髓形态正常,灰质居于中央,呈“蝴蝶形”。中央管位于灰质中央,位置和形态结构正常。灰质和白质的神经元胞体大小不等,呈多极神经元形态,细胞核位于中央,染色浅,核仁清楚;未观察到炎性细胞浸润,未见严重的组织疏松和空泡形成,未见细胞肿胀、萎缩、坏死、缺血等病理改变(见图2)。
讨 论
SCS 最早出现于20 世纪60 年代,经过半个多世纪的发展,已被广泛用于各种慢性顽固性疼痛的治疗[6,7]。美国食品药品监督管理局 (food and drug administration, FDA) 批准SCS 用于治疗躯干和四肢的慢性疼痛、顽固性腰背痛、腿痛和脊柱术后疼痛综合征 (failed back surgery syndrome, FBSS) 引起的疼痛[7]。在欧洲,SCS 还被批准用于难治性心绞痛和肢体缺血性疼痛的治疗[8]。
SCS 的作用机制是Melzack 和Wall[9]在1965年提出的“门控理论” (gate control theory)。其认为,在脊髓背角存在一种节段性痛觉调制神经网络,由初级传入纤维(如A 类和C 类神经纤维)、脊髓背角投射神经元(传递细胞,transmission cells,T 细胞)和胶质区的抑制性中间神经元(substantia gelatinosa,SG细胞)组成,其中SG细胞起关键的“闸门”作用,对痛觉传入具有突触前抑制效应。此外,研究表明,SCS 的疗效还与影响脊髓以上水平的痛觉调制[10]、调节痛觉相关神经递质水平的变化(如γ-氨基丁酸、5-羟色胺、乙酰胆碱、去甲肾上腺素和内源性阿片肽)等多种作用有关[11,12]。
我国的慢性疼痛具有人口基数大、患病年龄轻、缓解率不足、治疗不充分等特点[2~4]。国内的SCS 技术经过20 余年的发展,在缓解慢性顽固性疼痛中发挥着越来越重要的作用,并写入神经病理性疼痛中国专家共识[13],但植入的例数却远低于西方发达国家。究其主要原因,是我国缺少自主研发的SCS系统。
目前国际上的SCS 生产商主要来自美国,包括:①美敦力公司 (Medtronic, USA),是最早的SCS 设备生产商,也是产品类型最多的公司,主要研制各种传统模式下SCS 设备,在减小IPG 体积、提高MRI 兼容性、感应体位变化导致的电极移位、多触点电极等方面都居于领先地位;②圣犹达公司 (St. Jude, USA),2017 年被雅培公司(Abbott, USA)收购,旗下特点产品是背根神经节(dorsal root ganglion, DRG) 电刺激系列Proclaim™/Axium™和爆发电刺激系列BurstDR™;③波士顿科技 (Boston Scientific, USA),以能够提供多靶点、多刺激程式设定的电刺激为代表。④内夫罗公司 (Nevro, USA),旗下主要特点产品是HF-10™,即能够产生10 kHz 频率的高频SCS 相关系列产品;⑤Stimewave 公司 (USA):主要相关产品是Freedom Stimulator™,以体外无线刺激器为代表。进口设备昂贵的价格限制了SCS 在我国的普及应用。因此,尽快完成自主知识产权的SCS 设备的研发和应用,对于提高我国疼痛学科的诊疗水平具有重要意义。

图2 术后1 个月时实验羊HE 染色的脊髓切片(A-D,未刺激节段;A1-D1,刺激节段) Fig. 2 HE staining of spinal cord in sheep at 1 month post-surgery (A-D, unstimulated segments; A1-D1, stimulated segments)
本研究是国内首个在大型哺乳动物—羊身上进行新型SCS 系统安全性验证的临床前研究:在小尾寒羊上,观察我国自主研发的新型植入式SCS 系统对实验动物的行为学、血液指标、组织形态和体内设备阻抗的影响,验证不同规格刺激电极(穿刺电极和外科电极)和刺激模式(常规低频刺激50 Hz和高频10 kHz 刺激)的生物安全性、系统稳定性、手术操作性、组织相容性和刺激有效性。之所以选择羊作为实验动物,是因为羊脊柱与人脊柱的特征性解剖尺寸非常相似匹配,是理想的胸腰椎区域的解剖模型[14],其在骨科、儿科、呼吸科、心内科等都有广泛的应用[15]。
Gibson-Corley 等[16]采用自主设计的硬膜下SCS 刺激器,对4 只绵羊颈段和上胸段的脊髓后柱进行电刺激,观察了不同刺激位置对大脑皮层体感诱发电位 (somatosensory evoked potentials, SSEP) 的影响,发现刺激电压与电极位置与高γ 波段振幅之间存在明显关系,考虑到直接刺激脊髓背柱时较低的电压阈值及其对治疗窗口的可能影响,研究者认为这种硬膜内方式可能比目前常规使用的标准硬膜外技术具有特殊的临床优势。Safayi[17]等在羊身上,对硬膜下SCS 系统进行了安全性和有效性验证,重点测试了电极位置的稳定性、机械稳定性以及硬脊膜切开植入程序步骤的安全性和有效性。本研究同样选用羊进行临床前动物实验,发现自主研发的SCS 设备的可操作性较强,手术过程与临床SCS 手术过程有较高的相似性和可比性,可以满足临床前实验要求。
由于SCS 是椎管内操作,一些细小的异常都可能导致并发症的发生,涉及设备相关、生物相关以及操作技术等多个方面[18]。其中,最常见的是电极移位,发生率约10%~20%,直接影响麻刺感覆盖范围和镇痛效果[19]。电极移位与手术操作以及电极固定装置有直接关系,良好的电极锚定装置有助于将电极固定于理想位置。本研究发现,新型SCS 系统中的固定装置通过螺丝锁定的方法,实现了“锚”与电极二者的牢靠固定,消除了电极导线在“锚”中滑动的可能,与国外产品(如美敦力)的缝线固定相比,能够提供更好的电极固定。本研究术后1个月后,所有羊的植入电极的位置较术后即刻无明显改变,也说明了固定的牢固、可靠。
尽管脊髓损伤发生率不高,约为2%[20],但却是SCS 最严重的并发症之一,严重时可导致截瘫甚至死亡,其主要与操作者的技术水平和电极工艺水平、材质的生物可容性相关。本研究观察了SCS 术后1 个月时实验羊的刺激节段与未刺激节段的脊髓病理结构,发现刺激节段脊髓的镜下结构正常,未见明显的坏死、缺血、炎症等异常变化;同时实验羊在术后未见显著的运动异常,术后4 周时的电阻抗值与术后即刻相比无明显改变,提示新型SCS 系统工艺可靠,电极周围组织增生少,具有良好的组织相容性。
由于条件所限,本研究也存在一些不足:①样本量较少。本研究在3 只羊身上进行了相关评价,样本量偏少,只能大概反映新型SCS 系统的相关性能;②未设立对照组。本研究只进行了自身前后对照,未进行组间对照,结果可能存在偏倚;③未建立疼痛模型。本研究的目的是验证新型SCS 系统的安全性和组织相容性,故未建立疼痛模型,不能说明此系统对疼痛的治疗作用,也不能说明不同刺激模式治疗疼痛的优劣;④生物安全性指标单薄。本研究的生物安全性(组织排异反应)主要依据术后大体观察进行说明,缺少免疫学指标的佐证。上述不足,将在后续研究中逐步改进,为新型SCS 系统的临床应用提供充分的证据支持。
综上所述,动物实验表明新型植入式SCS 系统具有良好的生物安全性和组织相容性,设备性能稳定、可靠性好、操作性强、符合临床需求,具有广阔的应用前景。

