鲍曼不动杆菌碳青霉烯耐药性与生物膜形成及O-甘露糖蛋白相关性研究
邓国英, 杨淑凤, 任 峰, 崔 明, 隋韶光*
(1.大连医科大学 微生物学教研室,辽宁 大连 116044;2.大连医科大学附属第二医院 检验科, 辽宁 大连 116023; 3.大连医科大学附属第二医院 急诊医学科,辽宁 大连 116023)
鲍曼不动杆菌(Acinetobacterbaumannii)广泛分布于土壤和水等环境中,也存在于健康人的皮肤粘膜及腔道中,目前是引起医院感染的常见的机会性致病菌[1],该细菌易通过基因组变异获得耐药性并通过遗传物质的转移和重组进行传播[2]。在美国,临床分离到的鲍曼不动杆菌约45%为多重耐药菌,在拉丁美洲和中东地区,则高达70%[3]。碳青霉烯类如亚胺培南曾经是治疗该菌感染的首选抗菌药物,但是临床分离株对此类药物已经失去敏感性,多个耐药基因参与耐药性的形成[4]。鲍曼不动杆菌临床分离株对外界抵抗力强,容易在机体或无生命材料表面形成生物膜[5],生物膜作为细菌重要的致病机制之一,可以帮助细菌抵抗外界压力如抗菌药物,并有利于耐药性的传递。此外,在链球菌[6]、结核分枝杆菌[7]等致病菌的研究中,O-甘露糖蛋白在细菌耐药中发挥重要作用,是重要的毒力因子。为了探讨鲍曼不动杆菌耐药性与生物膜形成及O-甘露糖的关系,从大连医科大学附属第二医院收集24株鲍曼不动杆菌,用药物敏感试验观察这些菌株对常用抗菌药物的敏感性,针对耐碳青霉烯鲍曼不动杆菌,采用聚合酶链反应(polymerase chain reaction, PCR)检测耐药基因碳青霉烯酶基因OXA-23的有无,分析细菌耐药性与生物膜形成的相关性,并探讨耐药性与O-甘露糖蛋白表达的关系。
1 材料与方法
1.1 材料
1.1.1 菌株来源 鲍曼不动杆菌(Acinetobacterbaumannii)临床分离株均来自大连医科大学附属第二医院住院病人的痰标本。
1.1.2 培养基 哥伦比亚血平板及肉汤培养基,分别用于细菌的分离培养及增菌培养。
1.1.3 材料与仪器 细菌鉴定及药敏分析仪为梅里埃VITEK 2 Compact,抗菌药物的E-test试纸条来自法国梅里埃生物公司,基因扩增仪购自美国Bio-RAD公司,DNA提取试剂盒、DNA Marker DL2000及PCR试剂盒购自宝生物工程(大连)有限公司,琼脂糖为美国Thermo Fisher Scientific公司产品, 琼脂糖凝胶电泳仪来自大连捷迈科贸公司,结晶紫、刀豆蛋白凝集素A (Concanavalin A, Con A)、ProteoSilverTMPlus银染试剂盒及ConA琼脂糖层析柱购自Sigma公司,高速冷冻离心机为日本日立公司生产。使用的质谱仪器为基质辅助激光飞行时间质谱仪5800 MALDI-TOF/TOF,为AB SCIEX生产。
1.2 方法
1.2.1 菌株分离培养、鉴定及药物敏感试验 细菌培养严格按照无菌操作进行,VITEK2 Compact分析仪作细菌种属鉴定,质控菌株为霍氏肠杆菌(ATCC700323)。VITEK 2 Compact 分析仪也用于氨苄西林/舒巴坦等12种抗菌药物敏感试验,测定最小抑菌浓度值(minimal inhibitory concentration, MIC)。头孢哌酮、米诺环素及替加环素药物敏感试验则采用纸片扩散法。药敏试验质控菌株为大肠埃希菌(ATCC25922)和铜绿假单胞菌(ATCC27853)。
1.2.2 碳青霉烯酶OXA-23基因检测 鲍曼不动杆菌DNA提取按照试剂盒说明进行,OXA-23基因扩增所使用引物为F:5′-AAGCATGATGAGCGCAAAG-3′,R:5′-AAAAGGCCCATTTATCTCAAA-3′,OXA-58基因引物为F:5′- GGTTAGTTGGCCCCCTTAAAPCR-3′,R:5′-AGTTGAGCGAAAAGG-GGATT-3′,反应体系50 μL,包括10 × Pfu PCR Buffer 5 μL,10 mmol/L dNTP mixture 5 μL,PfuDNA聚合酶0.5 μL,上游引物1 μL,下游引物1 μL,DNA模板1 μL,灭菌ddH2O 36.5 μL。反应条件:95 ℃预变性5 min,1个循环;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸100 s,共30个循环;延伸温度为72 ℃,1个循环,时间15 min。PCR反应结束后,用含0.5 μL/mL溴化乙锭的1%琼脂糖凝胶电泳检测产物。
1.2.3 生物膜形成试验 培养鲍曼不动杆菌至OD值为0.5,取200 μL培养物加入微孔板,培养8 h,PBS清洗3次,1%结晶紫染色30 min,双蒸水清洗去除多余染液,乙醇洗脱,570 nm测定OD值,每组设3复孔,仅含有培养基孔为对照组。
1.2.4 O-甘露糖蛋白的获得及确证 ①膜蛋白的提取及定量:离心收获耐碳青霉烯鲍曼不动杆菌及非耐药菌,超声碎菌后,再次离心,取上清,4 ℃ 100 000×g超速离心1 h,沉淀膜蛋白,Bradford法定量蛋白。②ConA琼脂糖亲和层析获得O-甘露糖基化蛋白:用缓冲液(1mol/L NaCl, 5 mmol/L MgCl2,5 mmol/L MnCl2和 5 mmol/L CaCl2)冲洗ConA琼脂糖层析柱,然后进行层析柱的平衡。膜蛋白配成浓度为1 mg/mL,流经层析柱。应用平衡缓冲液冲洗。最后用200 mmol/L甘露糖苷洗脱目的蛋白,收获洗脱液并浓缩。③O-甘露糖蛋白的确证和解析:将蛋白进行12% SDS-PAGE,然后转移至PVDF膜,封闭后,用1∶ 5 000的辣根过氧化物酶标记的ConA(Sigma)室温孵育16 h后,洗膜后化学发光显色。同时电泳后的蛋白条带银染,切下质谱分析,并使用在线甘露糖基化位点预测软件(http://www.cbs.dtu.dk/services/NetOGlyc/)NetOGlyc 4.0 Server进行蛋白质的糖基化位点预测。
2 结果与分析
2.1 鲍曼不动杆菌的样本来源及临床分布
本研究收集的24株鲍曼不动杆菌均来自痰液的分离培养,其中21株来自重症医学科,其余3株分别来自神经外科、儿科和肾内科。标本来源以重症肺炎患者居多(16株)。
2.2 标本分离株的药物敏感试验结果
24株临床分离的鲍曼不动杆菌对15种抗菌药物耐药情况见表1。

表1 分离菌株对抗菌药物的耐药率
从表1可以看出,24株鲍曼不动杆菌对头孢他啶、头孢曲松、庆大霉素及哌拉西林均耐药,对亚胺培南的耐药率为83.33%,替加环素耐药率最低,为12.50%。
2.3 碳青霉烯酶基因OXA-23的检测
针对20株耐碳青霉烯鲍曼不动杆菌,检测了碳青霉烯酶基因OXA-23。PCR结果显示,13株检测到OXA-23基因片段,基因片段长度为1 066 bp(图1),检出率为65%。
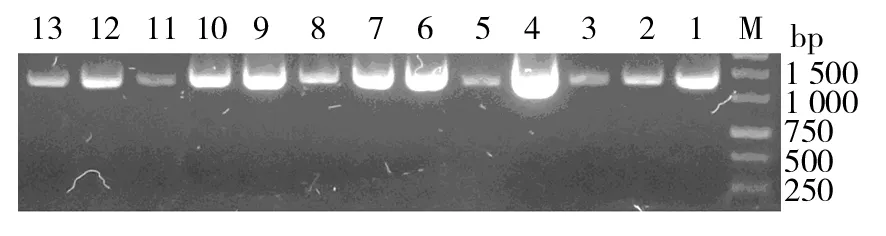
图1 鲍曼不动杆菌碳青霉烯酶 基因OXA-23 PCR结果Fig.1 PCR products of A. baumannii carbapenemase gene OXA-23M:DNA 分子标记;1~13:PCR产物 20株耐碳青霉烯鲍曼不动杆菌中,13株检测到碳青霉烯酶基因OXA-23 M:DNA Marker;1-13:PCR products OXA-23 gene was detected in 13 of 20 carbapenem resistant A. baumannii strains
2.4 鲍曼不动杆菌耐药性与生物膜相关性
结晶紫染色法显示,耐碳青霉烯鲍曼不动杆菌生物膜形成能力比非耐药菌更强(图2),这可能是因为细菌形成生物膜后耐药基因更容易传递,因而形成生物膜的菌株更易获得耐药性。

图2 鲍曼不动杆菌碳青霉烯耐药性 与生物膜形成的相关性Fig.2 The correlation between carbapenem resistance and biofilm formation in A.baumannii *P<0.05
2.5 鲍曼不动杆菌碳青霉烯耐药性与O-甘露糖蛋白表达的关系及糖基化位点预测
亲和层析获得的蛋白经SDS-PAGE、转膜及ConA识别,耐药菌株为5个条带,非耐药菌为4个条带(图3A),电泳及银染后,将蛋白条带(图3B)切除作质谱分析,结果显示,5个蛋白分别为OmpA/MotB、A1S_ 2371、A1S_ 0556、A1S_ 3744和A1S_ 3626,其中非耐药菌株缺少A1S_ 3626。糖基化位点位于Ser和Thr上,位点总数从7个到28个不等 (表2)。
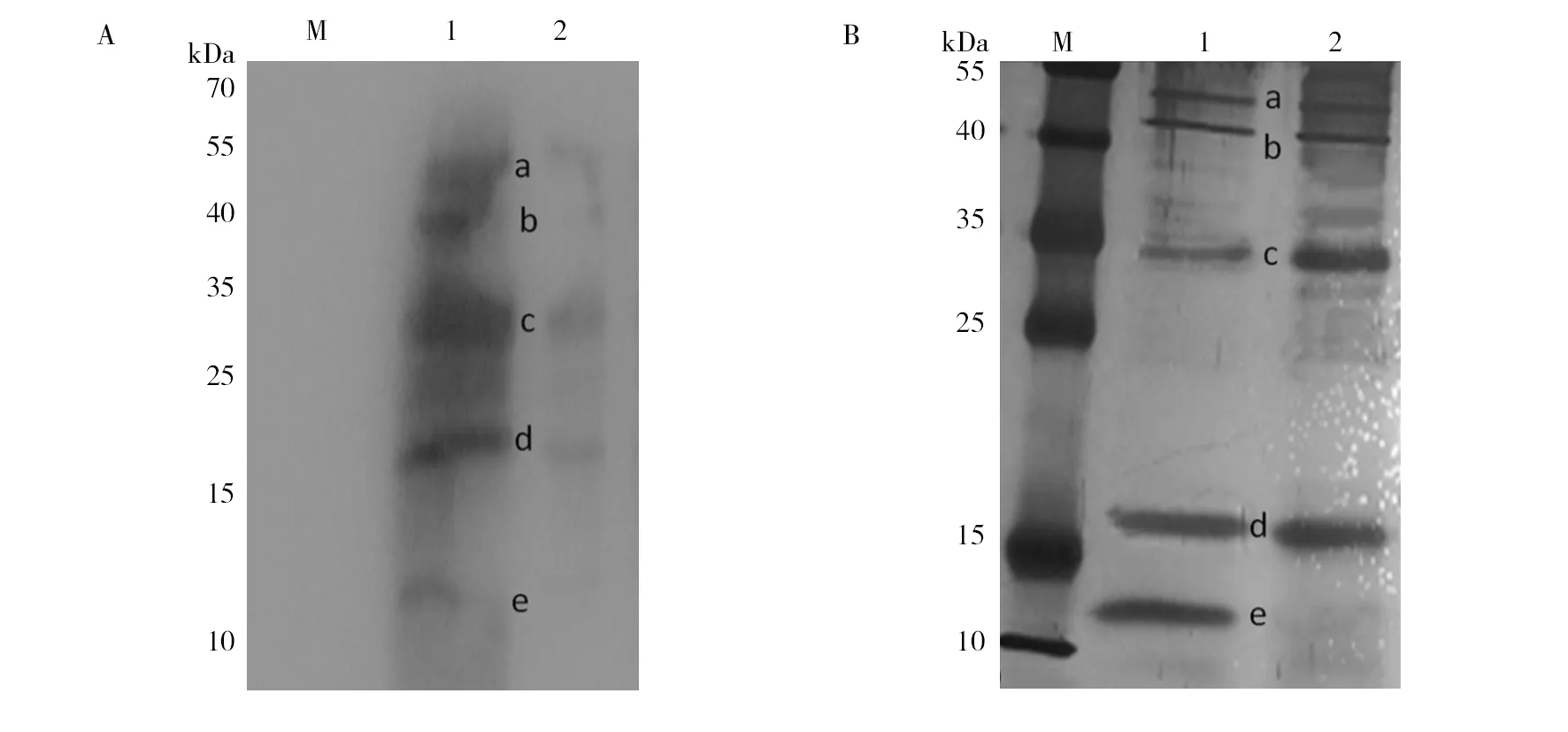
图3 亲和层析洗脱液ConA结合试验(A)及银染结果(B)Fig.3 The binding assay of ConA with elutes of affinity chromatography (A) and silver stain (B) a~e:检测到的糖蛋白条带 a-e:The detected protein bands
表2 鲍曼不动杆菌O-甘露糖基化蛋白质谱结果和糖基化位点预测
Table 2 MS analysis of O-mannosylated proteins and prediction of glycosylated sites inA.baumannii

条带序号质谱结果蛋白名称甘露糖基化位点位点总数aA1S_ 1193OmpA/MotB151Ser/152Ser/153Thr/161Thr/163Thr/320Thr/339Ser7bA1S_ 2371Putative uncharacterized protein23Ser/24Thr/25Thr/35Ser/51Ser/52Thr/62Thr/73Ser/74Thr/75Thr/89Ser/94Ser/95Thr/99Thr/102Thr/103Thr/104Thr/106Thr/108Ser/109Thr/111Thr/112Ser/117Thr/119Thr/122Ser/165Thr/188Thr27cA1S_ 0556Putative uncharacterized protein 4Ser/31Ser/53Thr/56Ser/238Ser/305Ser/306Thr7dA1S_ 3744Putative uncharacterized protein26Thr/37Thr/52Ser/55Ser/58Thr/76Thr/79Thr/80Thr/81Thr/87Thr/92Ser/95Ser/96Ser/98Thr/106Ser/108Thr/132Ser/139Thr/144Thr/157Thr20eA1S_ 3626Putative uncharacterized protein43Thr/55Ser/61Thr/65Ser/79Thr/86Thr/89Thr/94Thr/97Thr9
3 讨 论
近年来,鲍曼不动杆菌成为医院重症患者感染常见的致病菌,一方面是由于细菌对外界因素有较强的抵抗力,易于在医院环境及医疗器械上存活,另一方面,由于该细菌耐药菌株甚至多重耐药菌株的感染迅速增多,给治疗增加了难度[8]。
本研究从临床分离24株鲍曼不动杆菌,这些患者多为重症肺炎,部分伴有其他慢性疾病。对这些临床株进行抗菌药物敏感试验,发现耐药严重(表1)。碳青霉烯类抗菌药物属于β-内酰胺类,但是对细菌产生的β-内酰胺酶稳定,曾经是治疗鲍曼不动杆菌感染的重要药物,如今耐药率不断上升,药物敏感试验结果显示耐药率为83.33%。鉴于此,世界卫生组织已经将耐碳青霉烯鲍曼不动杆菌列为严重威胁人类健康的细菌,借此提醒医务工作者及患者防范该细菌[9]。OXA类碳青霉烯酶分为四个类别,分别是OXA-23、OXA-24、OXA-51和OXA-58,是鲍曼不动杆菌对碳青霉烯类抗菌药物产生耐药性最主要的原因[10]。 OXA-23介导的耐药性最为多见,它由质粒编码,耐药性可随质粒在细菌间扩散[11]。用PCR方法在基因水平检测OXA-23基因的有无,结果显示在20株耐碳青霉烯菌中13株为阳性,可见产生这一基因位于多数耐碳青霉烯鲍曼不动杆菌的遗传物质上。生物膜形成是细菌致病机制之一,细菌通过这种“群体行为”抵抗外界的压力,引起医院感染的常见细菌如肺炎克雷伯菌等耐药基因与生物膜有关[12]。鲍曼不动杆菌临床分离株在病人体内形成生物膜可能更有利于耐药基因在菌株间传递,所以结晶紫染色法显示耐药菌株形成生物膜的能力更强。
蛋白O-甘露糖修饰研究主要见于真核细胞,近些年,包括分枝杆菌属在内的多个种属细菌蛋白也存在O-甘露糖修饰[13]。O-甘露糖蛋白被认为是细菌重要的毒力因子,将鲍曼不动杆菌O-甘露糖基转移酶敲除,将大大减弱细菌形成生物膜的能力,提示蛋白连接的甘露糖在生物膜形成中的重要作用[14]。OmpA是目前已知的可增强细菌耐药性的O-甘露糖蛋白[15],在本研究中,耐药菌株和非耐药菌株O-甘露糖蛋白的区别主要体现在A1S_ 3626上,提示这一O-甘露糖基化蛋白可能在细菌耐药及生物膜形成中有重要作用。O-甘露糖蛋白提高细菌耐药性的机制还不是很清楚,已有的研究提示糖链可能在此功能上很重要[14],通过糖基化位点预测,5种蛋白的糖基化位点共7~28个不等,下一步将对检测到的5种糖蛋白的糖链进行解析,进一步探讨包括A1S_3626在内的O-甘露糖蛋白在耐药性及生物膜形成中的作用。

