急性白血病患者MCP-1、CCR-2及凝血功能指标的检测分析
何 玲,吴红卫,谭大为
(1.成都医学院第一附属医院血液科,四川成都 610503;2.贵州医科大学附属医院血液科,贵州贵阳 550004)
急性白血病(AL)是一种常见的造血系统恶性肿瘤,其特点是骨髓中造血干细胞恶变,形成原始细胞及幼稚细胞克隆并抑制正常造血,临床上表现为贫血、出血和发热等,可侵袭肝、脾、淋巴结等多组织和器官,影响患者的生活质量和生命健康[1-2]。AL按细胞形态学、免疫学、细胞遗传学及分子生物学(MICM)诊断分类通常可以分为急性淋巴细胞白血病(ALL)和急性髓细胞白血病(AML)两大类[3-4]。目前,美国国立综合癌症网络将AL的主要治疗方案设定为联合化疗,调节体内免疫系统,使患者体内的肿瘤细胞发生凋亡,使患者生存期延长[5-7]。本研究通过联合检测AL患者血清单粒细胞趋势化蛋白-1(MCP-1)、CC类趋化因子受体2(CCR-2)及凝血功能指标的变化,以探讨其在AL患者中判断病情、监测治疗的作用。
1 资料与方法
1.1一般资料 选取2016年1月至2017年12月成都医学院第一附属医院收治的AL患者100例和同期体检健康者50例。AL患者的诊断和分型均符合2018《血液病诊断及疗效标准第四版》,根据细胞形态学、免疫表型、细胞遗传学及进行MICM分型[8]。AL患者分为ALL组64例和AML组36例。ALL组患者中男36例,女28例;平均发病年龄(40.36±10.39)岁;病程(1.65±0.84)年。AML患者男20例,女16例;平均(41.46±11.62)岁;平均病程(1.73±0.94)年。同时选取本院50例体检健康者为对照组,男26例,女24例;平均(40.19±10.83)岁。本研究经本院伦理委员会批准,患者经家属同意自愿签署知情同意书。
1.2方法 治疗标准:按照2017年版《中国成人急性髓系白血病(非急性早幼粒细胞白血病)诊疗指南》、2012年版《中国成人急性淋巴细胞白血病诊断与治疗专家共识》标准、2014年版《中国急性早幼粒细胞白血病诊疗指南》[9-11]进行化疗。
所有研究对象分别于入院当天及化疗2个周期后,于清晨空腹采集6 mL静脉血,常规分离血清、血浆,采用酶联免疫吸附试验(ELISA)法测定研究对象血清内MCP-1、CCR-2含量,试剂盒购于上海慧颖生物科技有限公司;采用贝克曼库尔特公司生产的ACL-TOP血凝仪检测血浆纤维蛋白原(FIB)、血浆D-二聚体(D-D)、抗凝血酶(ATⅢ)、凝血酶原时间(PT)、凝血酶原时间国际标准化比值(PT-INR)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)表达,试剂盒购自上海晶抗生物工程有限公司。
2 结 果
2.1各组血液MCP-1、CCR-2含量表达 与对照组相比,ALL组和AML组MCP-1、CCR-2水平显著升高,ALL组MCP-1、CCR-2水平升高更为明显,差异有统计学意义(P<0.05)。与治疗前相比,ALL组和AML组患者治疗后体内MCP-1、CCR-2水平显著降低,差异有统计学意义(P<0.05)。见表1。
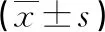
表1 各组血液细胞因子含量表达
注:与对照组相比,*P<0.05;与ALL组治疗前相比,#P<0.05;与ALL组治疗后相比,△P<0.05。
2.2各组凝血功能指标检测 与对照组相比,ALL组和AML组FIB、D-D、PT、APTT、TT显著上升,ATⅢ显著下降,差异具有统计学意义(P<0.05)。与治疗前相比,ALL组和AML组患者化疗后血浆FIB、D-D、PT、APTT、TT时间显著降低,差异有统计学意义(P<0.05),ATⅢ显著延长,差异有统计学意义(P<0.05),PT-INR没有显著改变,差异无统计学意义(P>0.05),见表2~3。
2.3患者MCP-1、CCR-2和凝血功能与患者治疗前后的相关性分析 相关性分析显示白血病患者MCP-1、CCR-2、FIB、D-D、ATⅢ、PT、APTT、TT水平与白血病治疗前后的相关系数分别为0.48、0.39、0.44、0.39、0.61、0.41、0.47、0.35,均呈正相关关系(P<0.05),在治疗后白血病患者MCP-1、CCR-2和凝血功能指标均得到了显著的改善;PT-INR白血病治疗前后的相关系数为-0.19,无显著的相关性(P>0.05)。
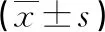
表2 各组凝血功能指标水平表达
注:与对照组相比,*P<0.05;与ALL组治疗前相比,#P<0.05;与ALL组治疗后相比,△P<0.05。
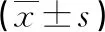
表3 各组凝血功能指标水平表达
注:与对照组相比,*P<0.05;与ALL组治疗前相比,#P<0.05;与ALL组治疗后相比,△P<0.05。
3 讨 论
AL是造血干细胞的恶性克隆性疾病,发病时白血病细胞出现增殖、分化及凋亡异常,并在骨髓中蓄积,对正常造血产生抑制作用,其病因目前尚未完全清楚,常伴有凝血功能的异常,包括血管内皮损伤,血小板功能异常、凝血、抗凝及纤溶激活而形成高凝或出血,是导致患者死亡的主要原因。MCP-1和CCR-2是MCP-1的特异度受体,可以不同程度地趋化单核细胞、嗜酸性粒细胞和嗜碱性粒细胞,在机体防御、慢性炎症及抗肿瘤等方面有重要作用[12-13]。
本研究结果表明,ALL组和AML组患者体内MCP-1、CCR-2水平显著升高,ALL组MCP-1、CCR-2水平升高更为明显,差异有统计学意义(P<0.05)。ALL组和AML组患者治疗后体内MCP-1、CCR-2水平显著降低,差异有统计学意义(P<0.05)。MCP-1与CCR2受体结合后,引起细胞内PTX敏感的Ca2+内流增加、磷脂酶C及PI3K的激活;MCP-1还可以调控JNK1、p38及ERK活性,进而激活MAPK通路,趋化内皮定向细胞运动,诱导血管形成。MCP-1还能趋化TGF-β促进血管生成,即MCP-1有促肿瘤作用[13-14]。本研究中AL患者血清MCP-1水平异常可能与机体炎性反应及免疫功能改变有关。AL患者体内出现血小板生成减少或功能异常,同时白血病细胞释放促凝物质,均可加速血液凝固性形成高凝状态或凝血功能异常。FIB是血浆中水平最高的凝血因子,其通过血小板聚集来加速血液凝固,增加促凝物质和减少抗凝物质,可参与调节体内的免疫活性和炎性反应,以及增加炎性介质的合成和分泌,FIG在体内成倍地升高,与血栓前状态形成密切相关,决定血液是否凝固[15-16],该指标水平的异常可能与肿瘤细胞在细胞因子的作用下发生髓外浸润有关。D-D是交联纤维蛋白特异度的降解产物,主要可以体现血液高凝状态及继发性纤溶亢进。外源性、内源性凝血系统的主要生物学指标ATⅢ、PT、APTT、TT水平异常多见于内源性和外源性促凝物质活性减弱[17-18]。
本研究发现,AL患者体内FIB、D-D、ATⅢ、PT、APTT、TT显著上升,说明AL患者体内存在出血、凝血异常,正常骨髓造血受到抑制,血小板不能有效发挥止血功能,凝血时间延长。与治疗前相比,ALL组和AML组患者化疗后血浆FIB、D-D、ATⅢ、PT、APTT、TT显著延长,差异有统计学意义(P<0.05),PT-INR水平没有显著改变,差异无统计学意义(P>0.05),说明化疗后随着白血病细胞被杀灭,患者的肿瘤负荷减轻,故非感染患者的凝血功能逐渐恢复,减少炎症介质合成和凝血因子的激活,体内凝血异常得到控制。
4 结 论
动态监测MCP-1、CCR-2及凝血功能指标变化有助于临床预测、判断AL患者的病情变化及评估治疗效果,可作为病情的判断及治疗的参考指标。

