耐碳青霉烯肺炎克雷伯菌的耐药分子学研究*
张晓慧,王瑞雪,高春艳,侯辰蕊,宋 静,戎建荣
(山西医学科学院·山西白求恩医院检验科,山西太原 030032)
碳青霉烯类抗菌药是治疗多重耐药肠杆菌科细菌(产ESBLs和/或产AmpC酶)导致的严重感染的选择药物[1]。但随着碳青霉烯类抗菌药的大量使用,耐碳青霉烯肠杆菌科细菌出现并逐渐增多,其中主要是耐碳青霉烯肺炎克雷伯菌(CRKP),严重威胁人类健康,给临床治疗重症感染带来严峻挑战,也是当前研究的热点。本研究对分离自本院的CRKP菌株进行了碳青霉烯酶的表型确证和产酶基因型(A、B、D类)的聚合酶链反应(PCR)扩增,并进行多位点序列分型(MLST),对本院的CRKP流行特征和耐药分子机制进行研究,为感染防控提供分子生物学依据。
1 材料与方法
1.1菌株来源 从本院临床微生物实验室的感染患者标本中分离到1 906株肺炎克雷伯菌,筛选出CRKP 46株(2.40%)。质控菌株包括:大肠埃希菌ATCC25922,肺炎克雷伯菌ATCC700603,肺炎克雷伯菌ATCC BAA 1705,肺炎克雷伯菌ATCC BAA 1706。
1.2仪器与试剂 主要仪器:Vitek-2 compact(法国Bio Merieux),MALDI-TOF MS 质谱仪(美国Bruker,Microflex LT/SH),PCR扩增仪(Eppendorf),电泳仪(北京君意,JY300C),凝胶成像仪(Alphalmager HP,Protein simple);试剂: 血平板(郑州安图),MH水解酪蛋白平板(天津金章),引物等基因扩增试剂盒(赛默飞世尔科技中国有限公司),亚胺培南和美罗培南纸片(Oxoid公司 ),DNA测序(上海生物工程公司)。
1.3方法
1.3.1菌种鉴定及药敏试验分析 根据美国临床和实验室标准化协会(CLSI)解释分类标准,当亚胺培南或美罗培南MIC为2.0~4.0 μg/mL或厄他培南MIC为2.0 μg/mL时,怀疑肠杆菌科细菌产碳青霉烯酶,需要作验证试验确证。因此,本研究采用亚胺培南MIC值≥2.0 μg/mL作为指标筛选CRKP菌株以免漏检低耐药株,同时检测美罗培南和厄他培南的MIC。将待检菌株血平板传代后35 ℃孵育18~24 h,采用MALDI-TOF-MS进行菌株鉴定,药敏试验采用MIC 法(VITEK-2 compact),纸片扩散(K-B)法复核,筛选出46株亚胺培南MIC≥2.0 μg/mL的肺炎克雷伯菌株。
1.3.2表型确证试验
1.3.2.1改良Hodge试验(MHT)[2,14]参照2017年CLSI解释分类标准,将0.5麦氏单位的大肠埃希菌(ATCC25922)菌液1∶10稀释后,均匀密涂在MH平皿上,中心贴美罗培南纸片,将待测菌株、阴性、阳性对照分别以中心美罗培南纸片为起点,沿半径方向离心划线,35 ℃孵育过夜,对碳青霉烯抗菌药敏感的大肠埃希菌ATCC25922沿接种线条向含有碳青霉烯类抗菌药纸片的方向生长即判断为阳性。阳性对照(肺炎克雷伯菌ATCCBAA1705),阴性对照(肺炎克雷伯菌ATCCBAA1706)。
1.3.2.2碳青霉烯酶灭活试验[2](CIM) 参照CLSI标准,用接种环从孵育过夜的血平板上挑取一环待测菌落,溶于Ep管的生理盐水中,漩涡振荡混匀菌悬液,用无菌镊子将美罗培南(10.0 μg)纸片浸入已混匀的菌悬液中(待测菌株、阳性对照、阴性对照),再次漩涡混匀,置于35 ℃孵育4 h后取出,立即贴于已经均匀密涂0.5麦氏单位的大肠埃希菌(ATCC25922)的MH平板上,再次置于35 ℃温箱,孵育18~24 h后观察结果。阴阳性对照菌株同改良Hodge试验。
1.4耐药基因检测
1.4.1PCR模板的制备 将46株实验菌株纯培养物,挑取一定量的新鲜菌落(18~24 h内)悬浊混匀于300.0 μL的去离子水中,沸水浴15 min后,12 000 r/min离心5 min,吸取上清液作为模板,-80 ℃保存备用。引物稀释前先12 000 r/min离心5 min后,加入等体积的去离子水,漩涡振荡器混匀,作为储存液。
1.4.2基因检测 7对反应引物[3]和PCR扩增条件参照本课题前期研究[14]见表1;总反应体系25.0 μL,2×Mix 12.5 μL,引物1.0 μL,模板1.0 μL,dd水9.5 μL;KPC、IMP、SME、GES、VIM、OXA48-L基因的反应条件:94 ℃预变性5 min;进入循环:94 ℃ 30 s,50 ℃ 30 s/50 ℃ 1 min (IMP),72 ℃ 1 min,30个循环后于72 ℃延伸7 min;NDM基因的反应条件:95 ℃预变性5 min;进入循环:95 ℃ 1 min,57.5 ℃ 30 s,72 ℃ 1 min,25个循环后于72 ℃延伸5 min;扩增产物采用1.50%琼脂糖凝胶电泳并成像记录结果。
1.5多位点序列分析(MLST) 所有CRKP菌株进行MLST分析,参照MLST专业网站[15](http://www.pasteur.fr/recherche /genopole/PF8/mlst /Kpneumoniae.html)对7个管家基因gapA、infB、mdh、pgi、rpoB、pheE和tonB进行PCR和测序。引物及反应条件参照巴斯德数据库(http://bigsdb.web.pasteur.fr)。测序结果在肺炎克雷伯菌MLST数据库(http://pubmlst.org/Klebsiella pneumoniae/)中进行BLAST 比对,确定其菌株ST型别。
2 结 果
2.1菌种鉴定及药敏试验
2.1.1菌种鉴定 历时两年收集本院临床分离到肺炎克雷伯菌株1 906株,筛选出CRKP 50株,鉴定药敏复核后,剔除敏感菌株4株,得到46株CRKP(2.40%),标本主要类型为痰液(41.30%)、尿液(19.50%)、腹水(8.70%)、引流液(4.30%)、血液(2.00%)和其他(24.20%);主要来源是重症医学科(16.00%),普通外科、全科医学科和神经外科(各10.80%),老年医学科(8.10%),呼吸内科、肿瘤内科和消化内科(各5.40%)等。
2.1.2药敏试验结果统计 见表2。
2.2耐药基因检测结果 所有CRKP菌株,扩增阳性产酶基因型包括3种:KPC、NDM、IMP。基因测序结果显示分别为KPC-2、NDM-1和IMP-4基因型见图1、2、3。
2.3药敏试验 MHT对所筛选的菌株进行产碳青霉烯酶表型确证,46株CRE中,MHT(+)33株(71.70%),见图4。
2.4CIM试验结果判读 若美罗培南纸片的抑菌圈直径为6~15 mm,则判断待测菌株产碳青霉烯酶,若≥19 mm,则判断待测菌株不产碳青霉烯酶,若抑菌圈直径在16~18 mm,则不能确定是否产酶[3]。本次试验结果显示46株测试菌株均为阳性(100.00%)见图5。

表1 引物序列及产物长度

图1 KPC-2基因测序图(部分)
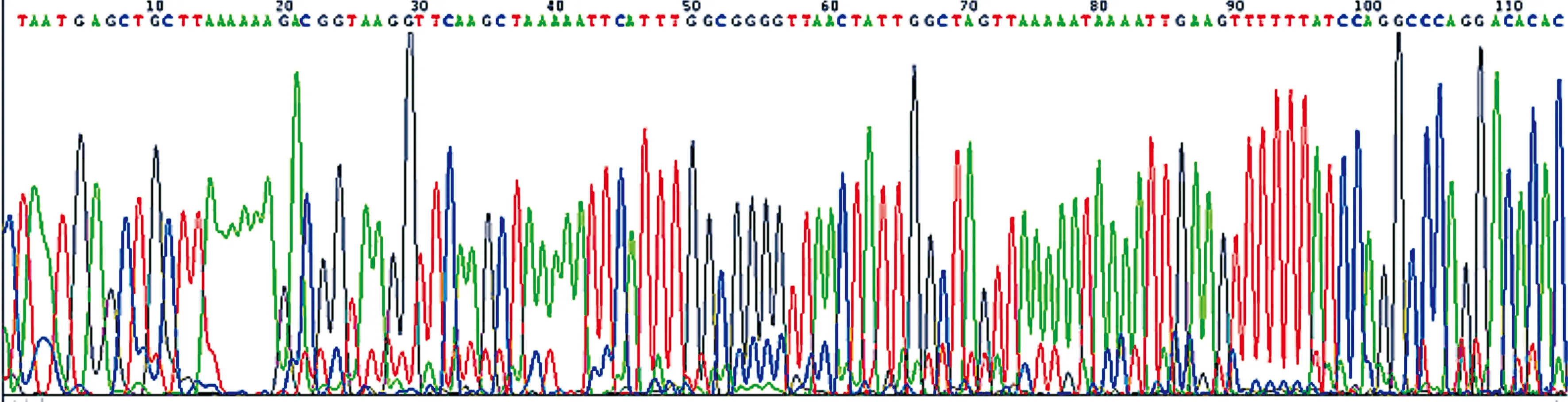
图2 NDM-1基因测序图(部分)

图3 IMP-4基因测序图(部分)

注:+表示阳性对照,-表示阴性对照。
图4 MHT结果(3、5号均为阳性标本)

注:+表示阳性对照,-表示阴性对照。
图5 CIM试验结果(3、5号均为阳性标本)
2.5MLST序列分型结果 MLST分型结果显示:46株CRKP包括8种ST型别,ST11型有33株,占71.70%,为最常见型别。其次,ST437、ST15、ST23、ST147、ST439和ST1955各2株,ST17有1株。其中,33株ST11型菌株均携带有bla KPC-2 基因,其中1株ST11型携带两种耐药基因:bla KPC-2和bla IMP-4基因,另1株ST11型携带bla KPC-2和blaNDM-1基因。46株CRKP中,33株产KPC-2型碳青霉烯酶菌株为同一群,均为产KPC-2型碳青霉烯酶的ST11型,ST17型属于一个群,而其余ST型属于一群。
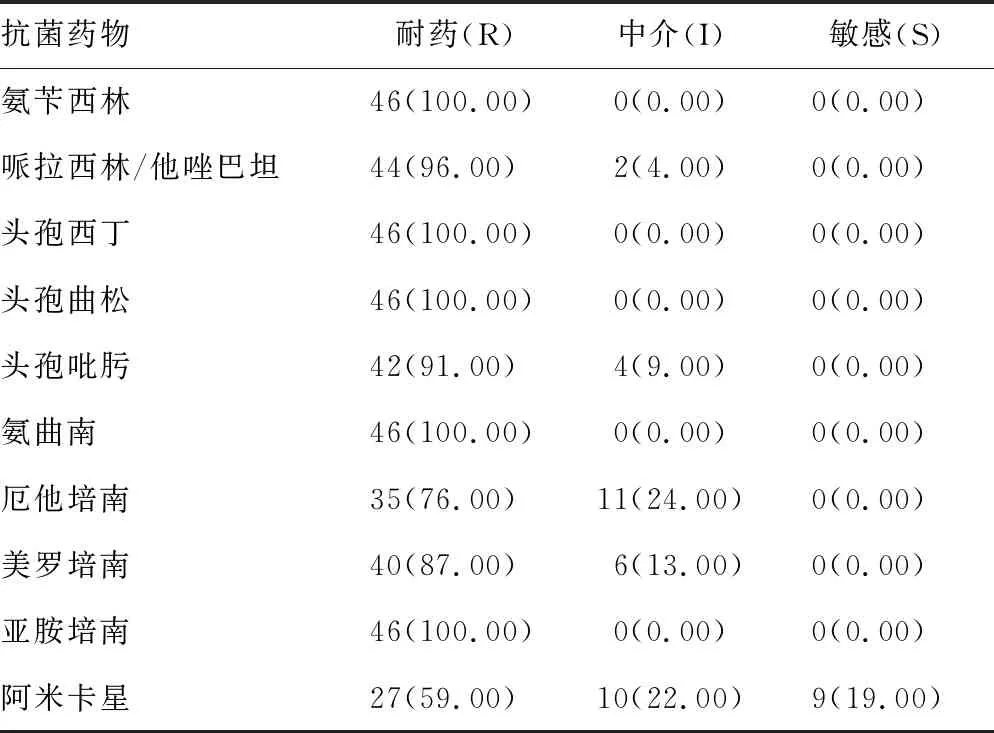
表2 46株测试菌的药物敏感试验结果分析[n(%)]

续表2 46株测试菌的药物敏感试验结果分析[n(%)]
3 讨 论
3.1CRKP耐药现状严峻 CRKP的感染已成为院内感染死亡的独立危险因素[2-4],对其细菌特征和耐药机制的研究显得尤为重要。我国自连云港第一人民医院2010年5月8日分离到第1株CRKP以来,CRKP分离率逐年上升,2015年CRKP分离率(22.37%)远高于江苏省(12.70%)和全国平均水平(7.60%)[5]。 不同地区不同医院由于地域不同、用药习惯的不同导致不同的耐药趋势出现,本研究收集到本院的46株测试菌株对头孢类抗菌药(除头孢吡肟91.00%外)的耐药率均为100.00%,亚胺培南耐药率为100.00%,而美罗培南耐药率为87.00%,中介率为13.00%,厄他培南耐药率为76.00%,中介率为24.00%,3种碳青霉烯类药物均处于中介耐药水平(亚胺培南、美罗培南MIC 2.0~4.0 μg/mL或厄他培南MIC为≥2.0 μg/mL),其他几类抗菌药(氨基糖苷类、喹诺酮类等)均表现为高耐药性,这些菌株的出现对临床治疗选择抗菌药提出了极大挑战。
3.2耐碳青霉烯酶表型确证试验 实验结果显示,MHT检测碳青霉烯酶阳性率为71.70%,而CIM在本次试验中阳性率达到100.00%,可见该试验用于检测产碳青霉烯酶具有可靠性。而且2018年CLSI[13]已删除了MHT作为确证试验,该试验主要是对A类碳青霉烯酶(尤其是KPC型)敏感度高,易漏检其他类型。
3.3PCR扩增结果分析 46株CRKP菌株,经PCR扩增和测序结果显示,有KPC-2、NDM-1和IMP-4 3种基因型的存在和流行,其中产KPC-2型碳青霉烯酶的ST11型为该院CRKP的主要型别,这与2017年中国上海报道的流行型别一致[6]。MLST分型同源性结果显示有10株来自不同科室、不同时间的细菌进化来源相近,均属于ST11型,为同一型别,说明院内可能出现耐药菌株的传播流行,临床各科室和医院感染控制部门也开始高度关注并采取有效的防控措施。
3.4MLST分型结果分析 研究结果显示该院CRKP的耐药机制以产KPC-2型碳青霉烯酶的ST11型菌株为主,同时存在其他碳青霉烯酶和ST型别。目前虽有超过115种ST型菌株中发现KPC酶[7],而全球最主要型别为ST258和ST11,二者仅有一个管家基因tonB之差,中国地区以ST11为主要型别,欧美则以ST258型为主。研究显示blaKPC基因多位于质粒上,这些质粒包括IncF(FIIk1、FIIk2和FIA),IncI2,IncX,IncA/C,IncR和ColE1[7]。有研究表明,blaKPC基因常存在于IncF型质粒[8-11],质粒则主要通过转座子Tn4401介导耐药基因的传播[12-15],转座子Tn4401携带KPC耐药基因可插入不同质粒中并随之水平转移,导致耐药基因的流行传播,这是造成blaKPC基因流行的原因之一。
3.5不足与展望 由于实验条件有限,本次研究设计的引物和测定方法可能不足以囊括所有该院的CRKP耐药基因型导致尚有未检出耐药基因的菌株,也可能有新的基因型出现而未能发现,本课题组也会继续监测耐药菌株的变迁和耐药机制的继续深入研究,耐药质粒的传播机制等,以期能够持续掌握本院的CRKP流行与耐药机制,为临床合理使用抗菌药和加强院感监测提供科学、准确的实验室依据。
4 结 论
本次实验研究本院CRKP菌株的耐药机制是以产KPC-2型碳青霉烯酶的ST11型为主,也是本院耐碳青霉烯肠杆菌科细菌的主要类型,并存在不同科室的克隆传播,为医院院内感染工作和感染防控提供科学依据,也提出问题,究竟存在哪种质粒的传播,以及研究切断质粒传播途径和运用转座子特性研发阻断途径等控制耐药菌株的流行分子学方法尤为迫切,也更加确证抗菌药合理规范使用,从源头上减少耐药菌产生的重要性。另外,现行的院感防控措施是否行之有效,更全面的防控措施和更完善的消毒灭菌隔离等控制流行措施有待研究开发和有效运行。

