红糖总多酚的提取测定及体外抗氧化作用
张芳铭,滕海辉,金永学,李慧敏,郑淘,曾艺琼,郑慧,杨勇*
1(湖南中医药大学 药学院食品药品工程系,湖南 长沙,410208) 2(麻阳鑫茂糖果业有限公司,湖南 怀化,418000)
红糖(又称砂糖)属于甘蔗粗提物,为甘蔗汁直接脱水产品,属甘蔗全提取物。由于红糖采用传统工艺制作而成,充分保留了甘蔗的各类营养成分,与白糖相比更符合现代健康理念[1-2]。传统工艺红糖是以甘蔗为原料,经提汁,澄清,煮炼而成的产品[3],主要含有蔗糖、果糖、葡萄糖等糖类和甘蔗多酚、维生素、微量元素、氨基酸、苹果酸、胡萝卜素、矿物质等非糖成分[4-5]。中医认为传统红糖具有驱寒暖胃、补血养颜、活血化瘀等功效,其保健功能物质基础可能与红糖产品中的非糖成分有密切关系[6]。甘蔗多酚含量高且抗氧化能力强[7],红糖作为甘蔗全汁浓缩物,甘蔗多酚在传统提取浓缩工艺中自然进入红糖产品,但目前对传统工艺红糖产品的多酚类成分研究报道较少。为探讨传统红糖的保健功能及机制,采用溶剂法提取红糖中的总多酚,优化提取条件,测定不同批次红糖的总多酚含量,DPPH法和总还原能力测定法评估红糖产品体外抗氧化能力,拟为传统工艺红糖多酚研究提供分析方法和依据。
1 材料与方法
1.1 材料与仪器
红糖:批次Ⅰ(10/2018)、批次Ⅲ(11/2018)、批次Ⅴ(10/2019)、批次Ⅵ(12/2019)、批次Ⅶ(01/2020),麻阳鑫茂糖果业有限公司;批次Ⅱ(11/2017)、批次Ⅳ(01/2017),麻阳县福寿糖业有限公司;没食子酸标准品(HPLC≥98%)、维生素C标准品(纯度≥99%)、福林酚试剂(1 mol/L),上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),纯度>97.0%,梯希爱(上海)化成工业发展有限公司;NaH2PO4(分析纯),汕头市西陇化工厂有限公司;Na2HPO4(分析纯),天津市恒兴化学试剂制造有限公司;无水乙醇(分析纯),成都市科隆化学品有限公司;无水Na2CO3、铁氰化钾、三氯乙酸、FeCl3,均为分析纯,国药集团化学试剂有限公司。
CP114电子天平,奥豪斯仪器(上海)有限公司;DZKW-4电子恒温水浴锅、SHB-Ⅲ-B真空泵,北京中兴伟业仪器有限公司;80-2台式离心机,金坛市大地自动化仪器厂;RE-52旋转蒸发器,上海亚荣生化仪器厂;紫外-可见分光光度计UV-1800,日本岛津有限公司;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;Waters 1525高效液相色谱仪,美国沃特世公司。
1.2 实验方法
1.2.1 红糖总多酚提取条件优化实验
1.2.1.1 标准曲线绘制与测定方法
参照文献[8]采用福林酚比色法测定多酚含量,并进行适当调整。精确配制质量浓度为0.05 mg/mL的没食子酸标准液,分别取没食子酸标准液0、0.5、1.0、1.5、2.0、2.5 mL于25 mL容量瓶中,分别加蒸馏水至5 mL,混匀后加入1.0 mL福林酚显色剂,摇匀,反应1 min后,再依次加入100 g/L Na2CO3溶液8 mL,定容至刻度线。20 ℃避光反应2 h,于760 nm波长处检测吸光度。以没食子酸质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
准确称取1.5 g红糖(批次Ⅶ,含水质量分数6.460%),按一定液料比加入乙醇溶液,在一定温度下提取一定时间后,再将提取液进行离心过滤,滤液在45 ℃下旋转蒸发后,用蒸馏水定容至100 mL,得待测液。取待测液1 mL置于25 mL容量瓶,同标准曲线方法操作,测定其吸光度值。通过标准曲线方程得公式(1)计算总多酚含量。

(1)
式中:A,红糖样品的吸光度值;m,红糖质量,g。
1.2.1.2 单因素实验
为了考察不同因素对红糖总多酚提取效果的影响,根据所查文献和预实验结果[9-12],选择乙醇体积分数(30%、40%、50%、60%、70%)、液料比(10∶1、15∶1、20∶1、25∶1、30∶1、35∶1)、提取温度(20、30、40、50、60 ℃)和提取时间(30、35、40、45、50、55 min)进行单因素实验。
固定液料比20∶1(mL∶g),提取温度50 ℃,提取时间30 min的条件下,乙醇体积分数分别为30%、40%、50%、60%、70%,同1.2.1.1方法对红糖总多酚进行提取并计算含量。
固定乙醇体积分数50%,提取温度50 ℃,提取时间30 min的条件下,液料比分别为10∶1、15∶1、20∶1、25∶1、30∶1、35∶1 (mL∶g),同1.2.1.1方法对红糖总多酚进行提取并计算含量。
固定乙醇浓度50%,液料比20∶1(mL∶g),提取时间30 min的条件下,提取温度分别设置为20、30、40、50、60 ℃,同1.2.1.1方法对红糖总多酚进行提取并计算含量。
固定乙醇体积分数50%,液料比20∶1(mL∶g),50 ℃下,分别提取30、35、40、45、50、55 min,同1.2.1.1方法对红糖总多酚进行提取并计算含量。
1.2.1.3 响应面法优化提取条件
根据单因素实验所确定的乙醇浓度、液料比、提取温度、提取时间的最优区间,利用Design-Expert 8.0.6软件中的Box-Behnken响应面优化分析,采用4因素3水平的响应面分析法,以多酚提取含量为响应值,优选出红糖总多酚的最佳提取条件,实验因素与水平见表1。

表1 红糖多酚提取条件响应面分析因素与水平设计Table 1 Response surface analysis factors and levelsdesign of extraction conditions of total polyphenolsin brown sugar
1.2.2 不同批次红糖多酚定量定性分析
1.2.2.1 不同批次红糖总多酚含量的测定
准确称取1.5 g不同批次的红糖(分别为批次Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ),按最优提取条件进行提取,后续操作同1.2.1.1方法,另测定不同批次红糖的水分含量,总多酚含量按公式(2)计算,以红糖干物质为计算基准。

(2)
式中:A,红糖样品的吸光度值;m,红糖质量,g;w,红糖含水质量分数。
1.2.2.2 不同批次红糖多酚的HPLC定性分析
色谱条件:使用Agilent的ZORBOX-C18液相色谱柱(250 mm×4.6 mm,5 μm);流动相(体积比):流动相A(甲醇)∶流动相B(0.5%乙酸)=1∶99;紫外检测波长280 nm;流速1 mL/min;进样量10 μL;柱温30 ℃[13-14]。
1.2.3 红糖体外抗氧化能力评价
1.2.3.1 DPPH自由基清除能力测定
分别取总多酚质量浓度为0.012,0.024,0.036,0.048,0.060 mg/mL的不同批次红糖(批次Ⅰ、Ⅱ、Ⅳ)多酚提取液1 mL于试管中,分别加入4 mL质量浓度为0.05 mg/mL DPPH的乙醇溶液,用力振荡混匀后,室温避光反应30 min,以无水乙醇为空白,于517 nm处测定吸光度值[15-17],按公式(3)计算DPPH自由基清除率。
(3)
式中:A0,1.0 mL蒸馏水+4.0 mL DPPH溶液的吸光度;As,1.0 mL样品溶液+4.0 mL DPPH溶液的吸光度;Ac,1.0 mL样品溶液+4.0 mL无水乙醇的吸光度。
分别取不同批次红糖多酚样品溶液(批次Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ)各1 mL于试管中,后续操作与计算同上述方法,得到不同批次红糖多酚提取液的DPPH自由基清除率。
1.2.3.2 总还原能力的测定
物质还原能力的测定就是对该物质将Fe3+还原为Fe2+能力的测定[18]。取不同批次红糖多酚提取液1 mL,依次加入2.5 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和2.5 mL 10 g/L的铁氰化钾溶液,混匀后在50℃水浴下反应30 min,然后加入2.5 mL 100 g/L的三氯乙酸,在3000 r/min下离心10 min,取2.5 mL上清液,依次加入2.5 mL蒸馏水和1 g/L的FeCl3水溶液0.5 mL,混匀后室温反应10 min,以溶剂为空白,在700 nm波长下测定吸光度(吸光度越大,还原能力越强)[19-21]。
2 结果与分析
2.1 标准曲线回归方程
测定不同质量浓度没食子酸标准品溶液760 nm处吸光度值,根据测定结果,得到没食子酸标准曲线回归方程为y=20.171x+0.004 2,R2=0.998 8。
2.2 单因素实验
2.2.1 乙醇体积分数对多酚提取的影响
由图1可知,随着乙醇体积分数的增加,红糖总多酚含量呈现先上升后下降的趋势,当φ(乙醇)=60%时,提取含量最大,当φ(乙醇)>60%时,得率下降明显。这可能是由于红糖为蔗汁浓缩物,含有蛋白质、多糖等大分子物质,当φ(乙醇)>60%时,多酚会与这些大分子类物质复合或包埋,而在高浓度醇溶液中沉降,从而降低了多酚提取率。

图1 乙醇体积分数对红糖总多酚提取的影响Fig.1 Effect of ethanol concentration on extractionof total polyphenols from brown sugar
2.2.2 液料比对多酚提取的影响
液料比对红糖总多酚提取的影响如图2所示。红糖总多酚的含量随着液料比的增加呈现先上升、中间段平稳、后下降的趋势。增大液料比,可增大红糖与提取溶剂的接触面积,从而增加多酚成分的溶出,提高提取含量。当液料比为30∶1时,红糖总多酚提取含量最高;提取溶剂用量继续增大时,红糖总多酚提取含量反而下降。
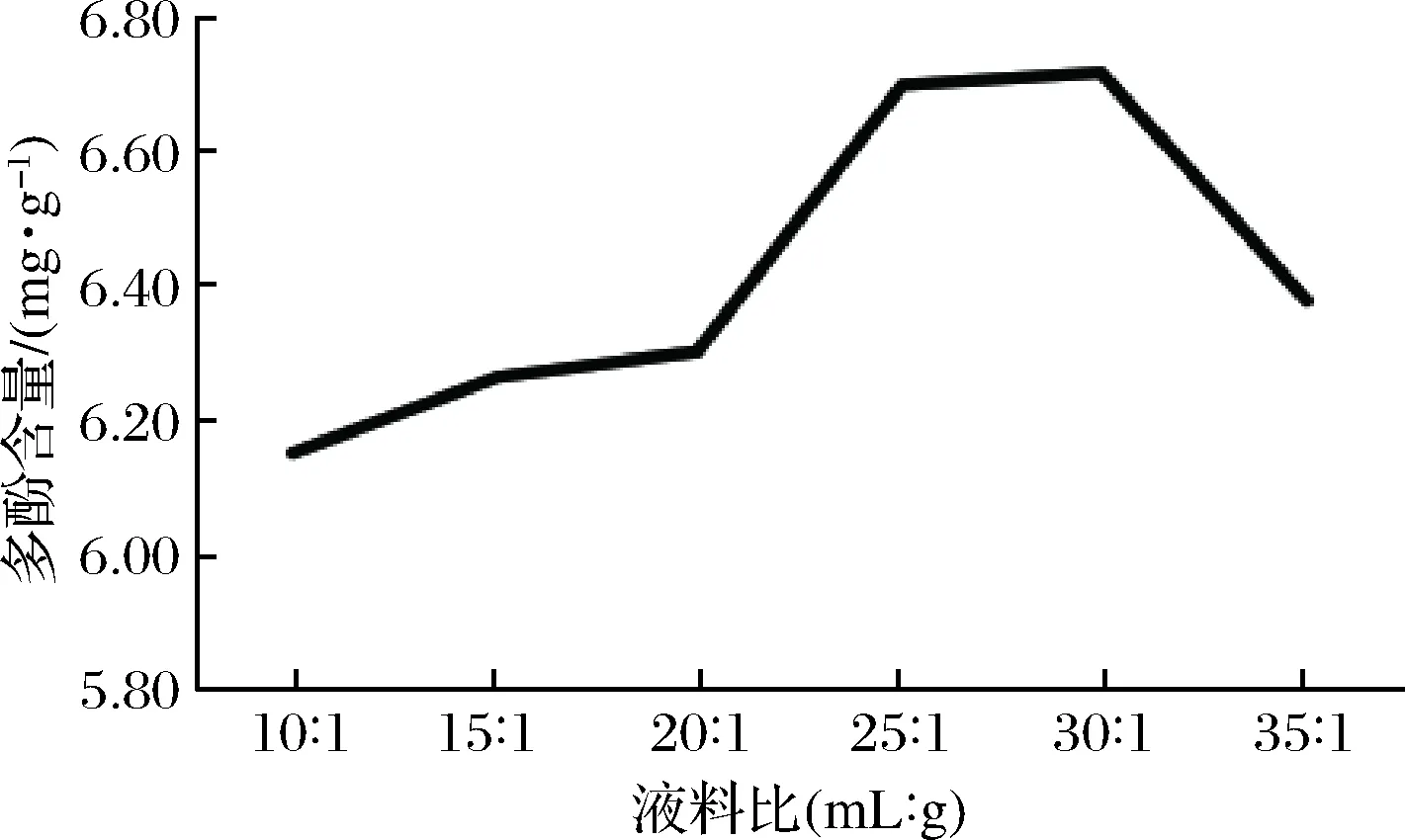
图2 液料比对红糖总多酚提取的影响Fig.2 Effect of liquid material ratio on extractionof total polyphenols from brown sugar
2.2.3 温度对多酚提取的影响
由图3可知,红糖总多酚的含量随温度的升高呈现先上升后下降的趋势。50 ℃时红糖总多酚提取含量最高。温度继续升高时,红糖多酚提取含量下降。这可能是由于温度持续增加会破坏多酚结构,从而使多酚含量下降,所以,最佳温度为50 ℃。
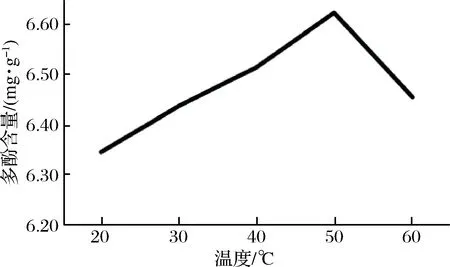
图3 提取温度对红糖总多酚提取的影响Fig.3 Effect of extraction temperature on extractionof total polyphenols from brown sugar
2.2.4 提取时间对多酚提取的影响
如图4所示,在提取时间30~55 min间,红糖多酚提取含量随时间的增加呈现先上升后下降的趋势。45 min时,提取含量最大。45 min后,提取含量随时间的增加而下降。这可能由于长时间提取会使部分多酚物质被氧化,所以,最佳提取时间为45 min。
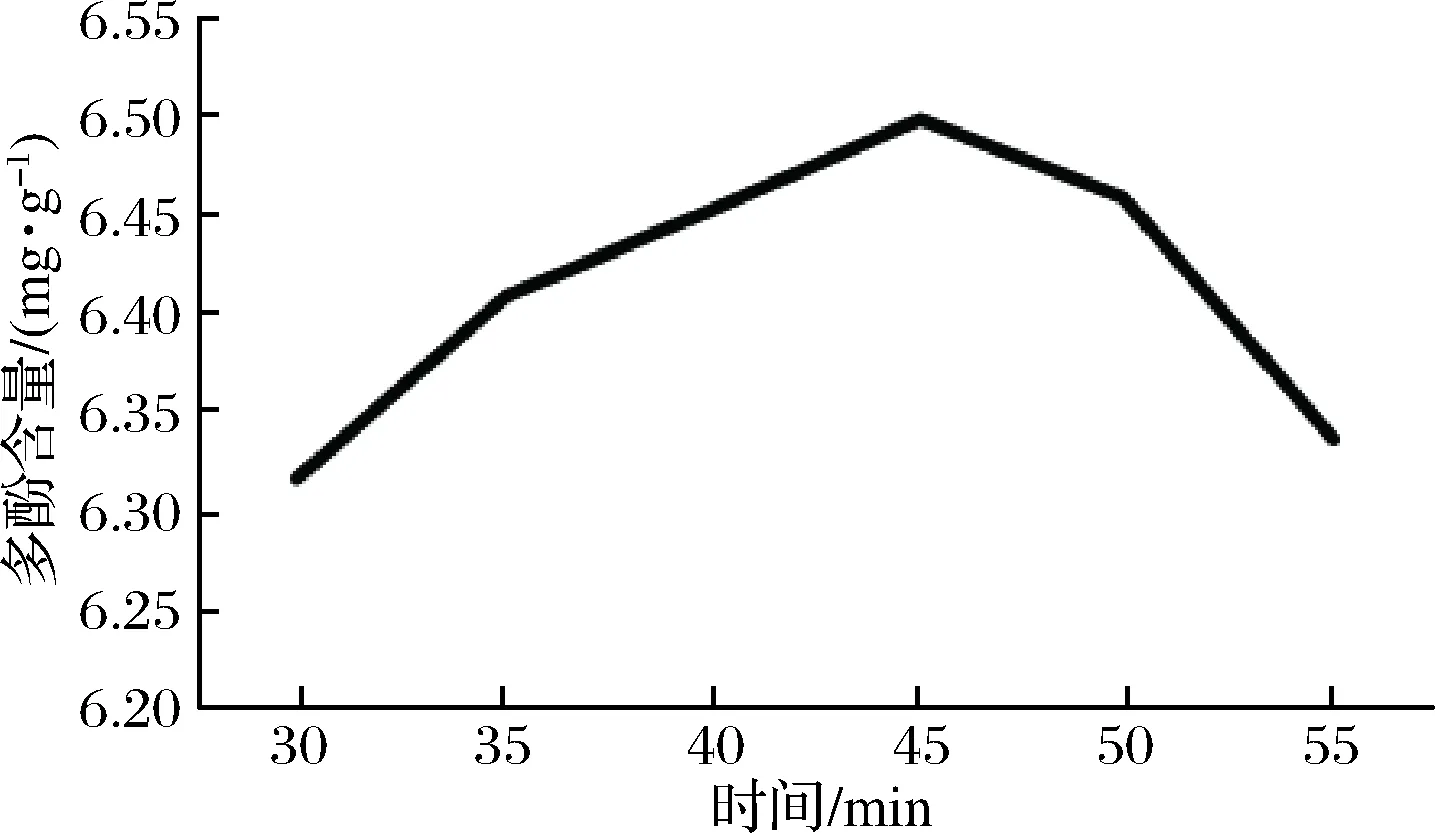
图4 提取时间对红糖总多酚提取的影响Fig.4 Effect of extraction time on extraction oftotal polyphenols from brown sugar
2.3 响应面优化实验
以单因素实验为基础,采用4因素3水平的响应面法对红糖总多酚提取条件进行优化分析,实验设计与结果见表2。
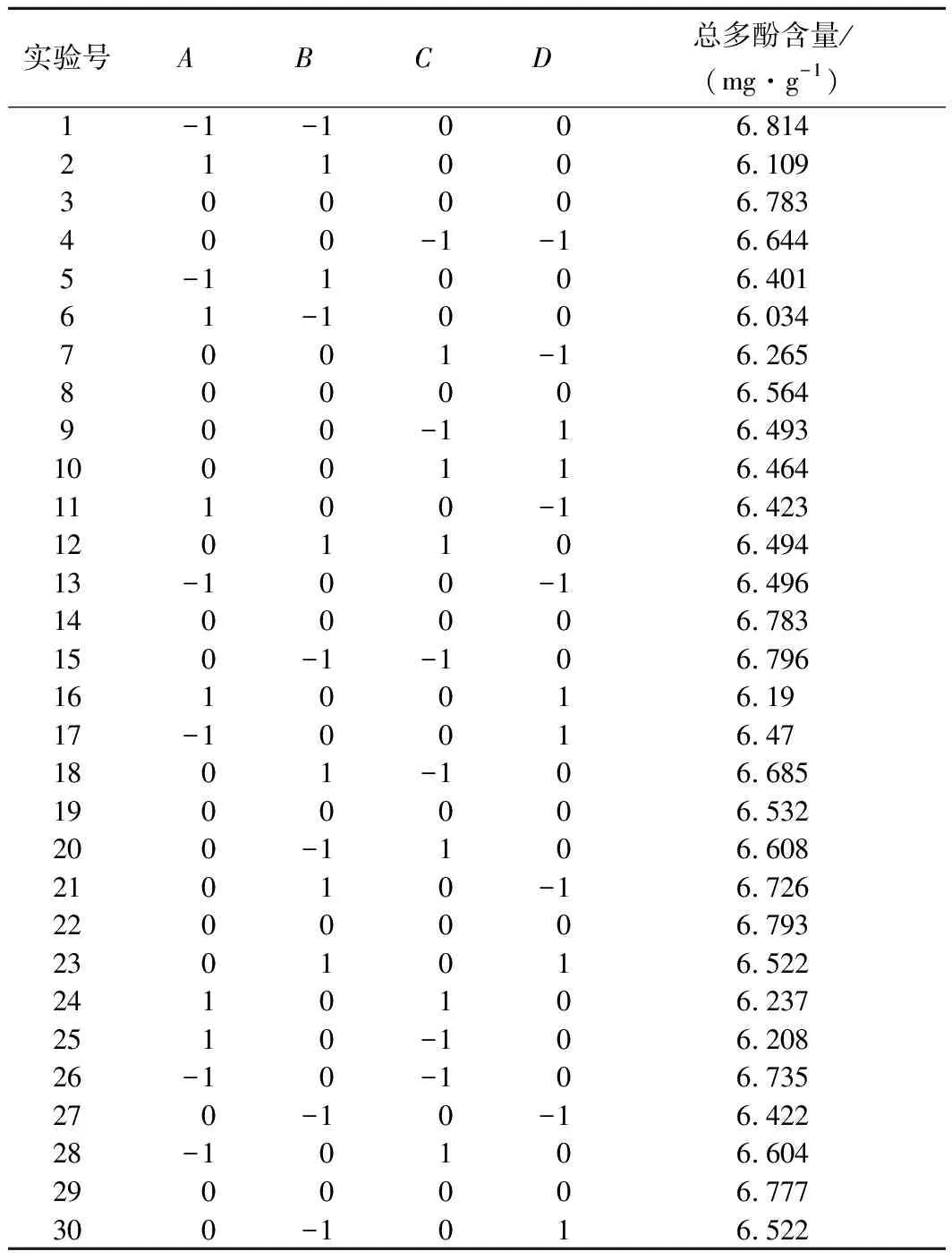
表2 红糖总多酚提取条件响应面法实验设计与结果Table 2 Response surface method design and results
对表2数据进行分析,得红糖总多酚与提取各因素变量间的函数关系,所得的编码因子二次多项式方程为:
总多酚含量=+6.71-0.19A-0.022B-0.074C-0.026D+0.12AB+0.040AC-0.052AD-0.000 75BC-0.076BD+0.088CD-0.24A2-0.059B2-0.047C2-0.12D2
由表3数据分析可知,回归模型F=4.38,P=0.005 7<0.01,说明该二次回归方程模型差异高度显著,模型成立有统计学意义。失拟项方差分析表明,F=0.95,P=0.587 1>0.05,失拟项不显著,说明模型拟合良好,可以用此模型对红糖总多酚的提取工艺进行分析并预测其最佳工艺参数。
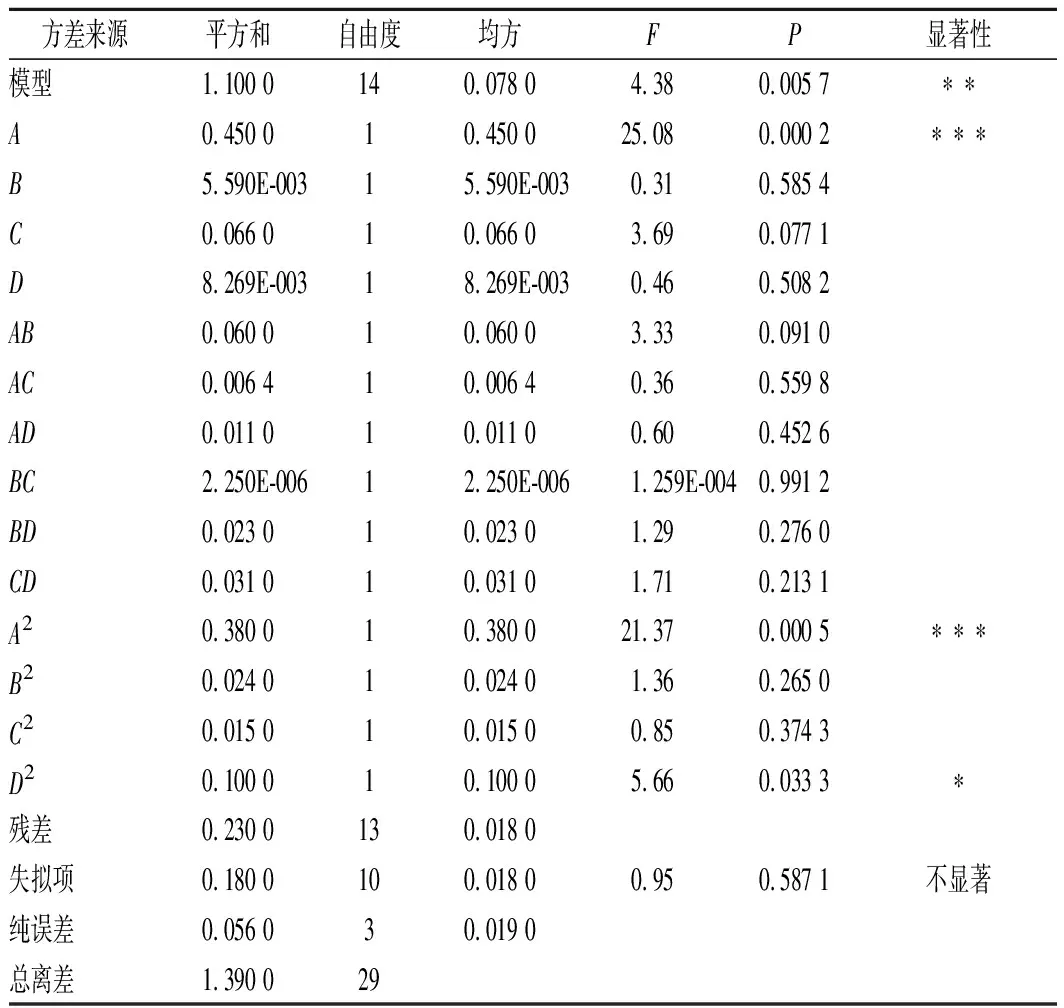
表3 响应面二次模型的方差分析Table 3 Analysis of variance of response surfacequadratic model
注:P<0.001表示差异极显著;P<0.01表示差异高度显著;P<0.05表示差异显著
由回归方程显著性检查结果分析,回归方程的一次项中,乙醇体积分数(A)对红糖总多酚提取含量差异极显著,提取温度(C)对红糖总多酚提取含量差异接近显著,液料比(B)和提取时间(D)对红糖总多酚提取含量差异不显著。二次项中,乙醇体积分数(A2)差异极显著,提取时间(D2)差异显著。由P值的大小可得出各因素对红糖总多酚提取含量的影响排序为:乙醇体积分数(A)>提取温度(C)>提取时间(D)>液料比(B)。
各因素对红糖总多酚提取含量影响的响应面曲线图和等高线图见图5。

a-乙醇体积分数和液料比;b-乙醇体积分数和提取温度;c-乙醇体积分数和提取时间;d-液料比和提取温度;e-液料比和提取时间;f-提取温度和提取时间图5 各因素对红糖总多酚提取含量影响的响应面曲线图和等高线图Fig.5 Response surface curve and contour map ofthe influence of various factors on the extraction totalpolyphenol content from brown sugar
利用Design-Expert 8.0.6软件中的Box-Behnken响应面优化分析,得到红糖总多酚提取的最佳条件为:乙醇体积分数为52.78%,液料比为25.54∶1(mL∶g),提取温度为40 ℃,提取时间为44.82 min。红糖总多酚提取含量预测值为6.828 mg/g。考虑到实验的可操作性,调整工艺参数为:乙醇体积分数53%,液料比26∶1(mL∶g),提取温度40 ℃,提取时间45 min。在此最优提取条件下,进行3次验证实验,红糖总多酚的最终提取含量为6.794 mg/g,与预测值6.828 mg/g接近,表明回归模型可以较好的反映红糖多酚的最佳提取条件。
2.4 不同批次红糖总多酚含量的测定结果
按最优提取条件提取不同批次的红糖的总多酚,采用前文方法测定提取液的总多酚含量,按扣除水分后的不同批次红糖干物质为计算基准表示总多酚含量见表4。

表4 不同批次红糖的总多酚含量Table 4 Total polyphenol content of differentbatches of brown sugar
2.5 不同批次红糖多酚HPLC检测结果
将批次Ⅰ和批次Ⅴ的红糖多酚提取液按前文色谱条件进样分析,色谱图见图6。批次Ⅰ与批次Ⅴ的红糖多酚HPLC色谱图中各个峰出峰时间一致,说明所含多酚种类相同,但峰面积有一定差异,因此不同批次红糖多酚种类间含量存在差异。
2.6 红糖的抗氧化能力评价
2.6.1 红糖多酚DPPH自由基清除能力
总多酚质量浓度同为0.012,0.024,0.036,0.048,0.060 mg/mL的不同批次红糖多酚提取液的DPPH自由基清除率测定结果见图7。
由图7可知,不同批次红糖多酚提取液的DPPH自由基清除能力折线基本重合。这表明,原料均为红糖,样液均为红糖总多酚提取液的情况下,不同批次在同浓度下清除DPPH自由基的能力差异不大,且红糖多酚的DPPH自由基清除能力与其质量浓度呈正相关。说明来源于不同批次红糖的多酚在同一多酚浓度下的抗氧化能力基本相同。当质量浓度为0.060 mg/mL时,批次Ⅰ、批次Ⅱ、批次Ⅳ红糖多酚提取液的DPPH自由基清除率分别为56.447%、60.606%、62.623%。

a-批次Ⅰ;b-批次Ⅴ图6 不同批次的红糖多酚色谱图Fig.6 Chromatogram of different batches of brown sugarpolyphenols
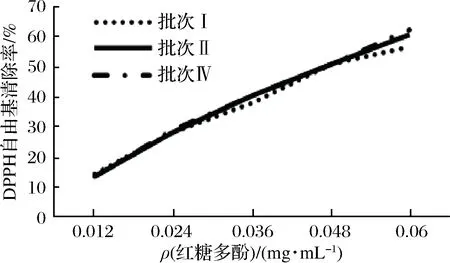
图7 不同批次红糖多酚提取液的DPPH自由基清除能力Fig.7 DPPH free radical scavenging capacity of differentbatches of brown sugar polyphenol extracts
2.6.2 不同批次红糖的DPPH自由基清除能力
不同批次红糖提取液的DPPH自由基清除能力测定结果见表5。红糖多酚提取液的DPPH自由基清除能力与其总多酚含量呈正相关,即总多酚含量越多,DPPH自由基清除能力越强。

表5 不同批次的红糖多酚提取液多酚含量与对DPPH自由基的清除能力Table 5 Polyphenol content and DPPH free radical scavenging ability of different batches of brown sugar polyphenol extract
2.6.3 不同批次红糖的总还原能力
由表6可知,吸光度值随其总多酚含量的增大而增大,即不同批次红糖多酚的总还原能力与其多酚含量呈正相关。
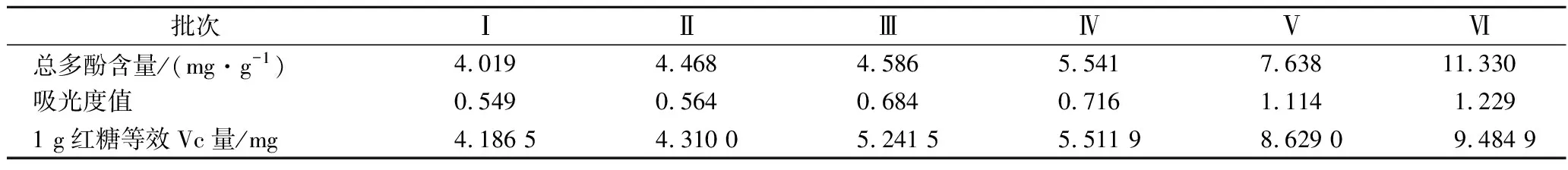
表6 不同批次的红糖多酚提取液多酚含量与总还原能力Table 6 Polyphenol content and total reduction capacity of different batches ofbrown sugar polyphenol extract
3 结论
通过响应面法优化得到红糖多酚的提取条件为:乙醇体积分数为52.78%,液料比为25.54∶1(mL∶g),提取温度为40 ℃,提取时间为44.82 min,调整工艺参数为:乙醇体积分数53%,液料比26∶1(mL∶g),提取温度40 ℃,提取时间45 min,为红糖总多酚的提取提供了科学依据。
红糖多酚具有一定的抗氧化能力,且其抗氧化能力与其总多酚含量呈正相关。不同批次的红糖多酚在同质量浓度下,抗氧化能力无明显差异,但不同产品间因为多酚含量差异较大,故抗氧化能力差异也大。

