内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选
赵雪平,温雅娇,李正英*,郑海武,黄海英,李晓娟
1(内蒙古农业大学 职业技术学院,内蒙古 包头,014109) 2(内蒙古农业大学 食品科学与工程学院,内蒙古 呼和浩特,010018)
酵母菌在葡萄酒发酵过程中扮演着重要的角色,它可以分解葡萄汁中的大部分糖转化为酒精和CO2。但还会生成一些其他的代谢产物,包括甘油、高级醇、酯、醛等,而这些代谢产物影响了葡萄酒的色泽、香气及口感, 决定着葡萄酒的质量[1]。酿酒酵母的筛选是优良酵母菌选育的基础,因此意义非常巨大。酵母的一般来源有果实表面、土壤、发酵醪液等,内蒙古乌海地区的地理和气候为葡萄生长提供了很好的条件,优质的葡萄又为酵母菌提供了生长繁殖的场所,因此期许在此地区能够筛选出优良的酿酒酵母菌。另外优良的酿酒酵母应具备起酵快的特点,而且也要有一定的耐受性,也是考察酿酒酵母能否运用于生产的条件[2]。目前大多数酿酒企业或酒庄都使用进口酿酒酵母或国内的安琪酵母,国内酿酒酵母品种单一,这也是筛选酿酒酵母的另一个重要原因[3]。
本研究筛选内蒙古乌海地区的葡萄果皮、果园土样以及自然发酵醪液中的酿酒酵母,并以商品化酿酒酵母为对照,研究其耐受性、发酵特性并进行了鉴定,以期为我国葡萄酒品质提升提供依据。
1 材料与方法
1.1 材料与设备
1.1.1 菌种
(1)测试菌种:采集于内蒙古乌海地区酿酒葡萄果园的土壤、果实表皮及发酵醪液。
(2)对照菌种:商用酿酒酵母CECA(安琪酵母股份有限公司)、商用酿酒酵母CSM(法国拉曼公司)。
1.1.2 原料
酿酒葡萄采于内蒙古农业大学职业技术学院科技园区。
1.1.3 培养基
孟加拉红琼脂培养基(g/L):孟加拉红0.033,氯霉素0.1,MgSO40.5,KH2PO41,蛋白胨5,葡萄糖10,琼脂15;
YEPD固体培养基(g/L):酵母浸出粉5,蛋白胨10,琼脂14,葡萄糖20;
YPD液体培养基(g/L):酵母浸出粉10,蛋白胨20,葡萄糖20;
TTC上层培养基[4](g/L):氯化三苯基四氮唑(TTC) 0.5,葡萄糖5,琼脂15;
TTC下层培养基[4](g/L):MgSO40.4,KH2PO41.0,酵母浸出粉1.5,蛋白胨2,葡萄糖10,琼脂20,调节pH至5.5;
BIGGY琼脂培养基(g/L):BIGGY琼脂45;
产酯固体培养基[5-6](g/L):溴甲酚紫0.04,三丁酸甘油脂15 mL/L,酵母浸粉10,蛋白胨20,葡萄糖20,琼脂20;
发酵培养基(g/L):(NH4)2SO41,MgSO41,KH2PO41,酵母浸粉10,胰蛋白胨20,葡萄糖200。
1.1.4 主要试剂
酵母浸粉、胰蛋白胨,北京奥博星生物技术有限责任公司;葡萄糖,天津市风船化学试剂科技有限公司;琼酯粉,天津市科密欧化学试剂有限公司;KH2PO4,天津市标准科技有限公司;(NH4)2SO4,天津市天大化学试剂厂;MgSO4,北京双环化学试剂厂;NaOH,天津市盛奥化学试剂有限公司;乳酸,天津市化学试剂三厂;乳酸钾,山东优索化工科技有限公司;酒石酸钾钠,国药集团化学试剂有限公司;酵母菌DNA提取试剂盒,天根生化科技有限公司;引物、dNTPs、Taq 酶,上海生工生物技术服务有限公司。
1.1.5 仪器与设备
synergyHIMF+Take3全功能酶标仪,美国BioTek仪器有限公司;THZ-98AB恒温振荡培养箱、LRH-70生化培养箱、CX21光学显微镜、HWS12电热恒温水浴锅,上海一恒科学仪器有限公司;SX-700立式压力蒸汽灭菌锅,北京世贸远东科学仪器有限公司;VD-1320超净工作台,哈尔滨东联电子技术开发有限公司;HC-2518R高速离心机,海玉博生物科技有限公司。
1.2 实验方法
1.2.1 酿酒酵母菌株的分离纯化
采集内蒙古乌海地区的果园土壤30份、葡萄表皮30份和农家发酵醪液10份,作为酵母菌的分离来源。将收集的葡萄或土壤样品制成菌液,并且稀释,吸取50 μL稀释后的菌液于孟加拉红固体平板上,用涂布棒涂匀,28 ℃培养1~3 d。挑选单个的具有典型酵母菌菌落特征且形态差异较为明显的菌落,划线纯化2~3代,将上述分离纯化得到的酵母菌接入YEPD斜面培养基,4 ℃保藏。
1.2.2 酿酒酵母菌株的筛选
将分离后的酵母菌株利用TTC培养基显色法测定菌株产乙醇能力,BIGGY琼脂培养基显色法测定菌株产H2S的性能以及产酯培养基显色法测定菌株产酯特性。筛选出产乙醇能力强、低产H2S且高产酯的优良酵母菌株。
1.2.2.1 高产乙醇酵母菌株的筛选
酵母菌株划线接种到TTC下层培养基上,以商业酿酒酵母CECA和CSM及空白试验作为对照,28 ℃培养1~3 d后,在菌落上覆盖一层TTC上层培养基,28 ℃遮光培养。观察各平皿中菌落的显色情况,菌株与培养基反应,使菌落呈现白色、浅红色、红色和深红色,菌落呈现的颜色越深,表明菌株产乙醇能力越强。
1.2.2.2 低产H2S酵母菌株的筛选
将1.2.2.1中筛选出的高产乙醇酵母菌株点种到BIGGY琼脂培养基上,并以商业酿酒酵母CECA和CSM及空白试验作为对照,28 ℃培养1~3 d,观察各菌株菌落颜色,菌株产生的H2S与BIGGY培养基中的铋发生反应,使菌落呈现白色、黄色、浅棕色和深棕色,颜色越深,代表菌株产H2S的量越多。
1.2.2.3 高产酯酵母菌株的筛选
将1.2.2.2中筛选出的酵母菌株划线接种到产酯培养基上,以商业酿酒酵母CECA和CSM及空白试验作为对照。观察其菌落颜色。菌株产酯能力不同所呈现在产酯平板上的菌落颜色也不相同,菌落黄色越深,表明菌株的产酯量越多[7]。
1.2.3 酵母菌株耐受性测定
耐受性测定包括耐乙醇性能试验、耐SO2性能试验、高糖耐受性试验和低pH的耐受性试验,将YPD液体培养基分装到试管中再放入倒置的杜氏管中,杜氏管内不含空气。121 ℃灭菌20 min,冷却至室温,按照表1的条件调节培养基的浓度梯度,接种待测酵母菌株体积分数为2%,每个处理平行3次,28 ℃培养1~3 d,观察其产气状况判断其耐受性。以商业酿酒酵母CECA和CSM及空白试验作为对照。

表1 酵母菌株耐受性测定条件梯度Table 1 Conditional gradient for tolerance measurement ofyeast strains
1.2.4 优良菌株的鉴定
1.2.4.1 酵母菌DNA的提取
采用柱式酵母基因组 DNA 抽提试剂盒提取。
1.2.4.2 菌株26S rDNA D1/D2基因序列的PCR扩增
(1)引物设计:正向引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和反向引物NL4(5′-GGTCCGTGTTTCAAGACGG-3′)[8-10]。
(2)反应体系:引物(10 μmol/L)各0.5 μL,基因组 DNA 0.5 μL,10×Buffer(with Mg2+)2.5 μL,2.5 mmol/L的dNTP 1 μL,Taq酶0.2 μL,加双蒸水补足至25 μL。
(3)PCR扩增条件:94 ℃,4 min;94 ℃,45 s;55 ℃,45 s;72 ℃,1 min,循环30次;72 ℃,延伸10 min。PCR产物取5 μL在1%琼酯糖凝胶电泳上进行电泳检测,电泳参数:150 V,100 mA,10~20 min电泳观察[8-10]。
酵母菌株序列测定后,将测序结果在NCBI数据库中进行比对,通过比对测序菌株与数据库中模式菌株的可信值,构建系统进化树。
1.2.5 酵母菌株发酵产品感官评价
将培养至对数生长期的优良菌株接种到YPD液体培养基中,在 10 ℃、12 000 r/min条件下离心3 min,收集菌泥备用[11]。选用种植于内蒙古农业大学职业技术学院科技园区的葡萄进行发酵试验[葡萄汁理化指标为: 23.0 °Brix,还原糖154.07 g/L,总酸(6.86±0.2)g/L,pH 3.14]。葡萄汁中按体积分数2%的接种量接入优良酵母菌株,同时用法国商业酵母CSM和国产商业酵母CECA作对照。在 25 ℃下恒温发酵。每24 h测定还原糖、总酸和乙醇体积分数,当残糖质量浓度下降至4 g/L 以下时视为发酵结束,按照GB/T 15037—2006[12]的方法,组织7位有经验的品评员,进行感官评定[13-14]。
2 结果与分析
2.1 酵母菌株的分离纯化
将酿酒葡萄产区的部分地区所采集的葡萄及其果园土壤样品或发酵醪液中酵母菌的分离纯化,通过对酵母菌形态观察以及显微镜镜检,初步去除重复菌株,共筛选出13株酵母菌株编号为KY1~KY3、KA1~KA3、KX1~KX4、KB1~KB3,如图1所示,多数为出芽繁殖的椭球形菌株。
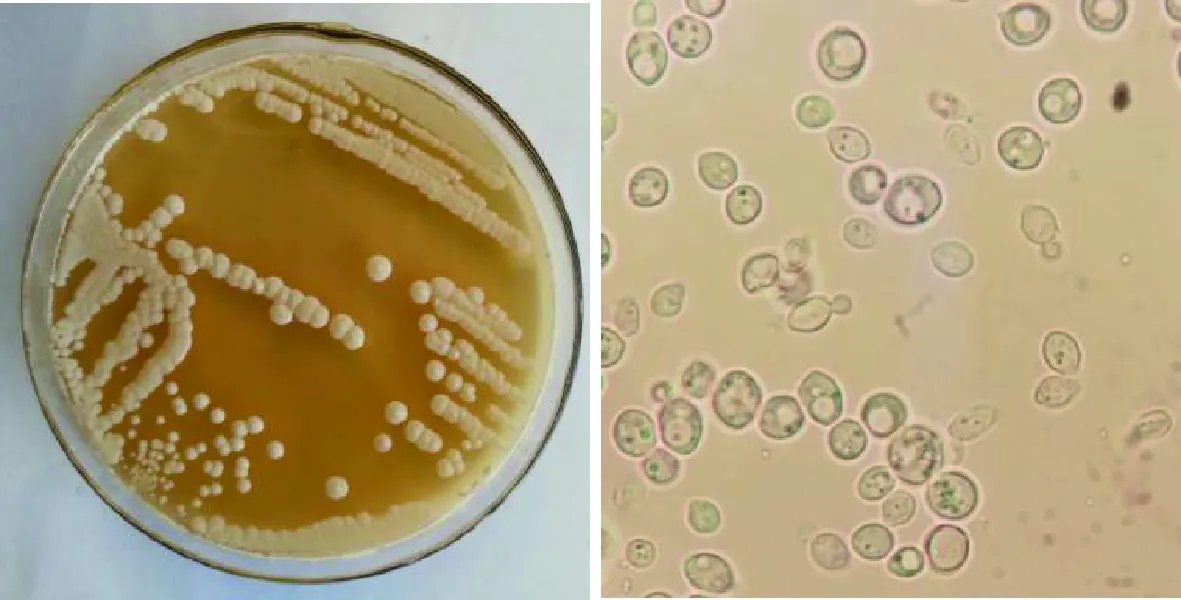
图1 酵母菌在YEPD培养基上的菌落特征以及显微镜下的形态Fig.1 Colony characteristics of yeast on YEPD medium andmorphology under microscope
2.2 酵母菌株筛选
2.2.1 高产乙醇酵母菌的筛选
将分离纯化的13株酵母菌进行产乙醇能力试验,结果见表2。
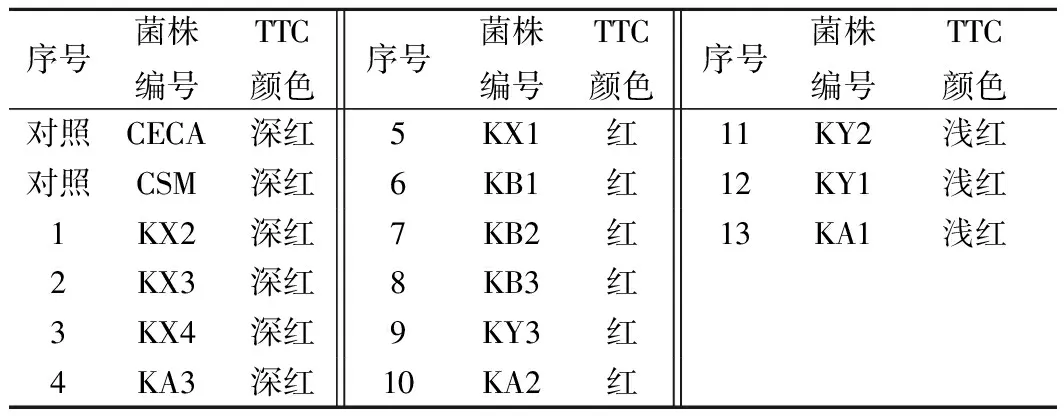
表2 酵母菌在TTC培养基上的显色结果Table 2 Chromogenic results of yeast on TTC medium
由表2可知,有4株酵母菌(KX4、KA3、KX2、KX3)的菌落在TTC培养基上呈深红色,其产乙醇能力与对照组相当,因此选择这4株产乙醇能力强的酵母菌进行下一步的筛选试验。
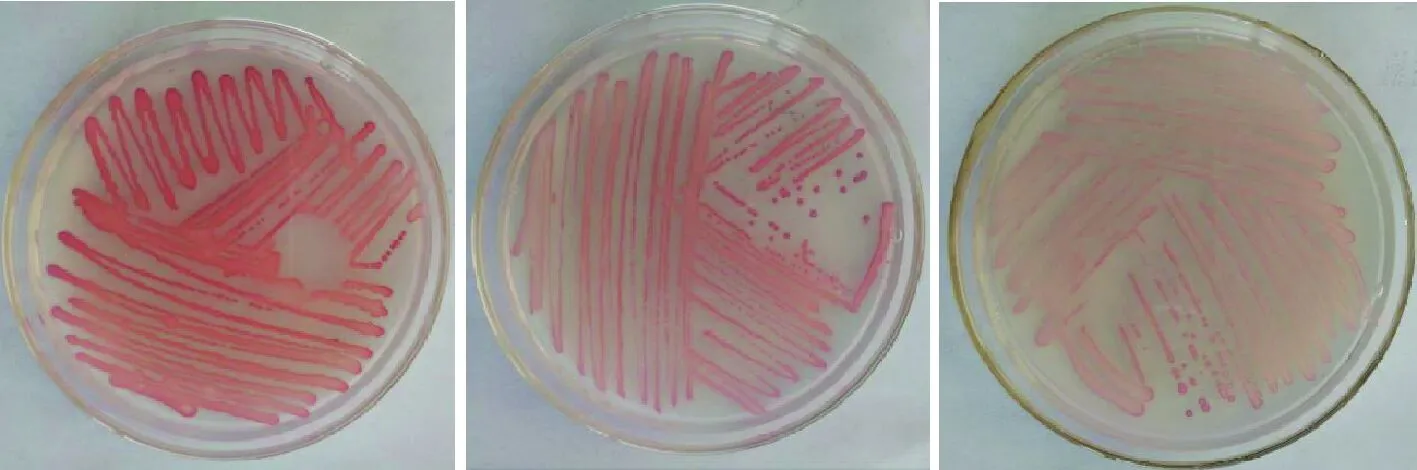
图2 酵母菌在TTC培养基上的的显色结果Fig.2 The colour results of yeast on TTC medium注:从左到右为:深红色、红色、浅红色
2.2.2 低产H2S酵母菌株的筛选试验
将高产酒精的4株酵母菌进行低产H2S酵母菌株的筛选试验,结果见表3。

表3 酵母菌在BIGGY培养基上菌落颜色Table 3 Colony colour of yeast on BIGGY medium
BIGGY琼脂是一种具有选择性的培养基,使用铋作为指示剂,来测定菌株生长时是否有产生H2S[14],颜色越深,表面菌株产H2S越多[15]。由图3可知,对照菌株CECA菌落在BIGGY培养基上呈浅棕褐色,为低产H2S酵母,CSM呈棕褐色,为中产H2S酵母。H2S产生的不良气味会影响葡萄酒的风味[16],且对人体有毒害作用,基于此,仅保留低产和中产H2S的菌株KX3、KX2和KX4作后续研究。

图3 酵母菌在BIGGY培养基上的的显色结果Fig.3 The results of yeast colour on BIGGY medium注:从左到右为:浅棕褐色、棕褐色、褐色
2.2.3 高产酯酵母菌株的筛选结果
将3株低产或中产H2S高产乙醇酵母分别接种到产酯培养基上,并以商业菌株CECA和CSM作对照,28 ℃恒温培养1~3 d。观察菌落附近的颜色并记录,显色结果见表4。
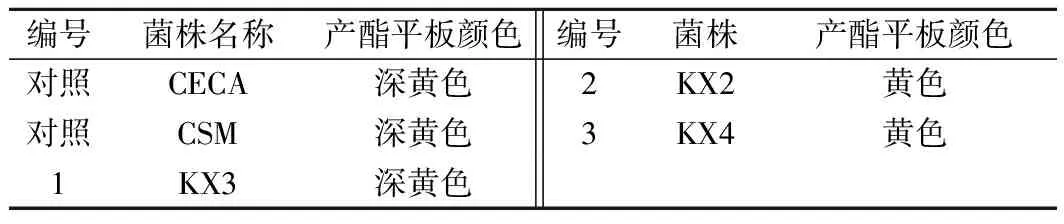
表4 产酯特性筛选结果Table 4 Screening results of ester-producing characteristics
由图4可知,对照菌株CECA、CSM及KX3的菌落在产酯培养基上呈深黄色,即产酯能力较强,所以选择KX3酵母菌株进行后续研究。
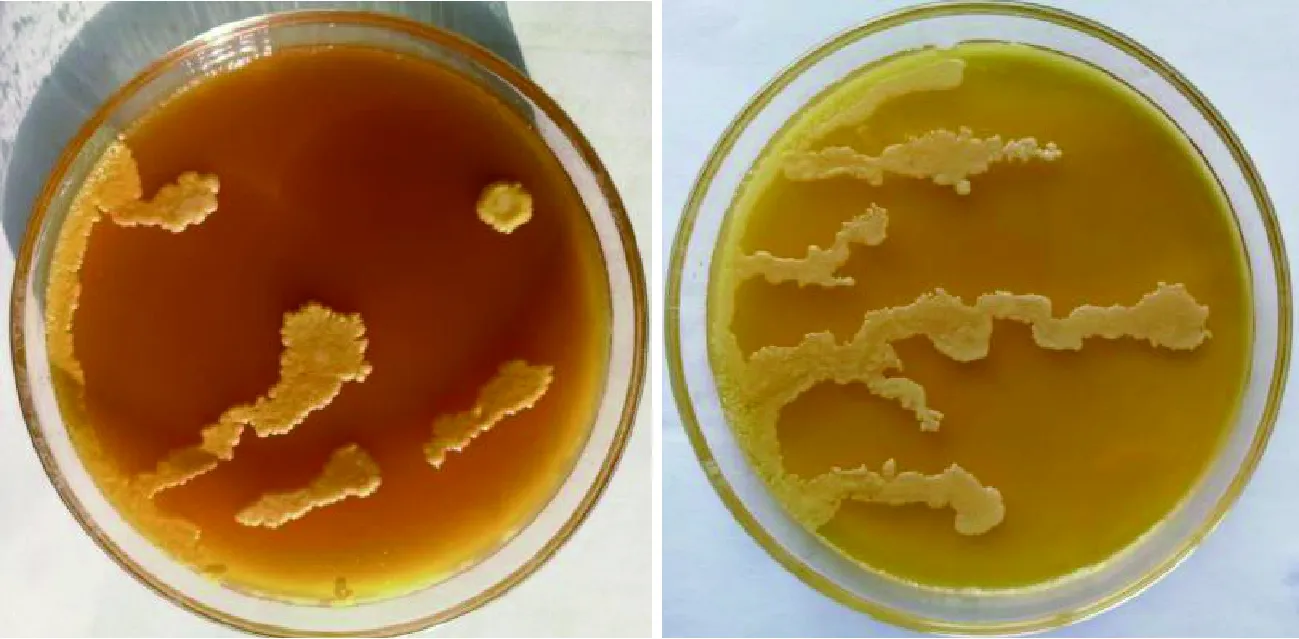
图4 酵母菌在产脂培养基上的的显色结果Fig.4 The colour results of yeast on lipid-producing medium注:从左到右为:黄色、浅黄色
2.3 酿酒酵母菌株的鉴定
2.3.1 酵母菌株26S rDNA D1/D2区域的PCR扩增
如图5所示,通过对酵母菌株DNA 的提取和PCR扩增,可以看出酵母菌株的DNA片段长度在580~600 bp左右,符合前人对酵母菌基因序列长度的研究范围[17]。

图5 酵母菌株PCR扩增电泳图Fig.5 PCR amplified electrophoresis map of yeast strains
2.3.2 酵母菌株26S rDNAD1/D2区测序结果
DNA测序结果在NCBI网站上进行序列同源性比对,结果如表5所示。比较得到酵母菌株KX3的DNA片段与酿酒酵母同源性最高,达到100%,与测序结果进行对比,并用MEGA4.1构建系统进化树,如图6所示。最终确定酵母菌株KX3为酿酒酵母。

表5 酵母菌株26S rDNA D1/D2序列测序结果Table 5 Sequencing results of 26S rDNA D1/D2 sequenceof yeast strain

图6 酵母菌株26S rDNA构建的系统进化树Fig.6 Phylogenetic tree constructed by yeast strain 26S rDNA
2.4 酿酒酵母耐受能力测定
将筛选出的酵母菌株KX3进行耐受性试验测定,试验结果见表6。

表6 酵母菌株耐受性能测定试验结果Table 6 Screening results of ester-producing characteristics
由表6可知,菌株KX3的耐乙醇体积分数为16%,耐SO2质量浓度为400 mg/L耐高糖质量浓度为500 g/L,耐低pH值为2.5,符合酿酒生产的标准。
2.5 酵母菌发酵特性研究
由图7可知,斜率越大发酵越快,KX3与CECA的发酵速率相当,且高于菌株CSM;从图8可以看出,从第4~12 h起,OD值随培养时间延长而快速增长,进入对数生长期,培养到12 h后进入稳定期,说明该菌株具有良好的生长特性[18-19]。

图7 CO2失重量Fig.7 CO2 weight loss
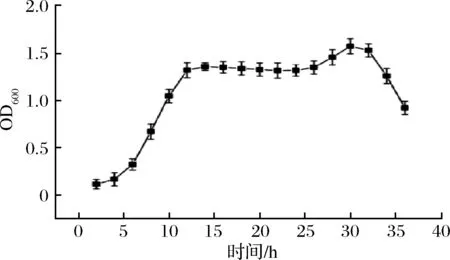
图8 KX3生长曲线图Fig.8 OD600 value of growth curve of KX3
2.6 酵母菌株发酵产品感官评价
对优选的酿酒酵母KX3和2株商业酿酒酵母发酵葡萄酒的色泽、香气、澄清度、滋味、典型性等方面进行了评分[20-21],结果见图9。
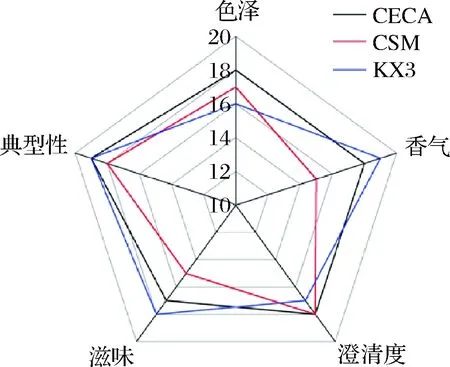
图9 不同酵母菌发酵的干红葡萄酒感官评定Fig.9 Sensory scoring scale for dry red wine fermentedby different yeasts
在2株商业酵母菌和1株优选酵母菌发酵葡萄酒的感官评分中,CECA发酵葡萄酒经感官评价,酒体澄清透亮有光泽,呈宝石红色,有典型的葡萄酒风味,回味绵长,总评分为91分;CSM发酵葡萄酒经感官评价,酒体澄清透亮有光泽,呈宝石红色,清新爽口,果香协调,具有典型性,总评分为85分;KX3发酵葡萄酒,酒体澄清透亮有光泽,呈宝石红色,口感细腻柔和,果香馥郁,酒体丰满,典型明确,总评分为89分。筛选出的优良菌株中KX3酿制的葡萄酒评分仅次于对照菌CECA ,具备葡萄酒的典型特性。
3 结论
优良酿酒酵母菌表现为具有良好的耐受性、发酵特性及发酵产品典型的风味,目前本土优良酿酒酵母菌有待进一步的分离和筛选,本文以内蒙古乌海地区果园的土壤、葡萄果皮及发酵醪液为筛选源,并以商业酿酒酵母菌CECA、CSM为对照,筛选出的菌株KX3经26S rDNA D1/D2区测序鉴定为酿酒酵母菌,耐乙醇体积分数为16%,耐SO2质量浓度为400 mg/L,耐高糖质量浓度为500 g/L,耐pH值为2.5,并且起酵快,经感官评定,酒体果香浓郁、典型性好,可以运用于商业化生产,而发酵产生的香气物质还有待进一步研究。

