表没食子儿茶素没食子酸酯对柔红霉素与人血清白蛋白相互作用影响的光谱学及细胞毒性研究
郭庆英,刘 敏,*,赵燕娜,吴玉姝,孙 彬,刘 杰,韩 军
1.聊城大学化学化工学院,山东 聊城 252059 2.聊城大学生物制药研究院,山东 聊城 252059
引 言
柔红霉素[Daunomycin,DNR,图1(a)]为第一个临床应用的抗肿瘤抗生素[1]。但其在临床化疗中的不良反应,尤其是心脏毒性,使其应用受到了限制[2]。微生物药物学和肿瘤药理学家甄永苏院士指出:茶多酚与抗肿瘤药物联用具有增效、减毒以及逆转耐药性的作用,可作为生化调节剂应用于临床[3]。儿茶素类化合物为茶多酚的主要成分,其中表没食子儿茶素没食子酸酯[epigallocatechin-3-gallate,EGCG,图1(b)]含量最高(约占儿茶素的50%)且具有最大活性[3]。
人血清白蛋白(HSA)是血浆中含量最丰富的蛋白质,因其独特的分子结构及良好的生物相容性而成为药物传输领域的研究热点。晶体结构表明HSA由585个氨基酸组成,包括三个结构相似的域(Ⅰ—Ⅲ)。药物与蛋白的结合直接影响药物的吸收、分布和代谢方式,进而影响药效的发挥。EGCG和DNR单一药物与人血清白蛋白之间的相互作用已有报导[4-5]。但遗憾的是EGCG对DNR与人血清白蛋白的相互作用及细胞毒性的影响尚未见文献报导。本工作利用荧光光谱法、紫外-可见吸收光谱法、圆二色谱法、动态光散射研究了EGCG存在下DNR与人血清白蛋白的相互作用,测定了其结合常数、结合位点数、焓变、熵变等热力学参数,并从微观结构出发加以讨论。同时考察了单一药物、联合药物及药物与蛋白复合物对人宫颈癌HeLa细胞的细胞毒性作用。所得结果将为EGCG与DNR的联合用药提供理论基础。
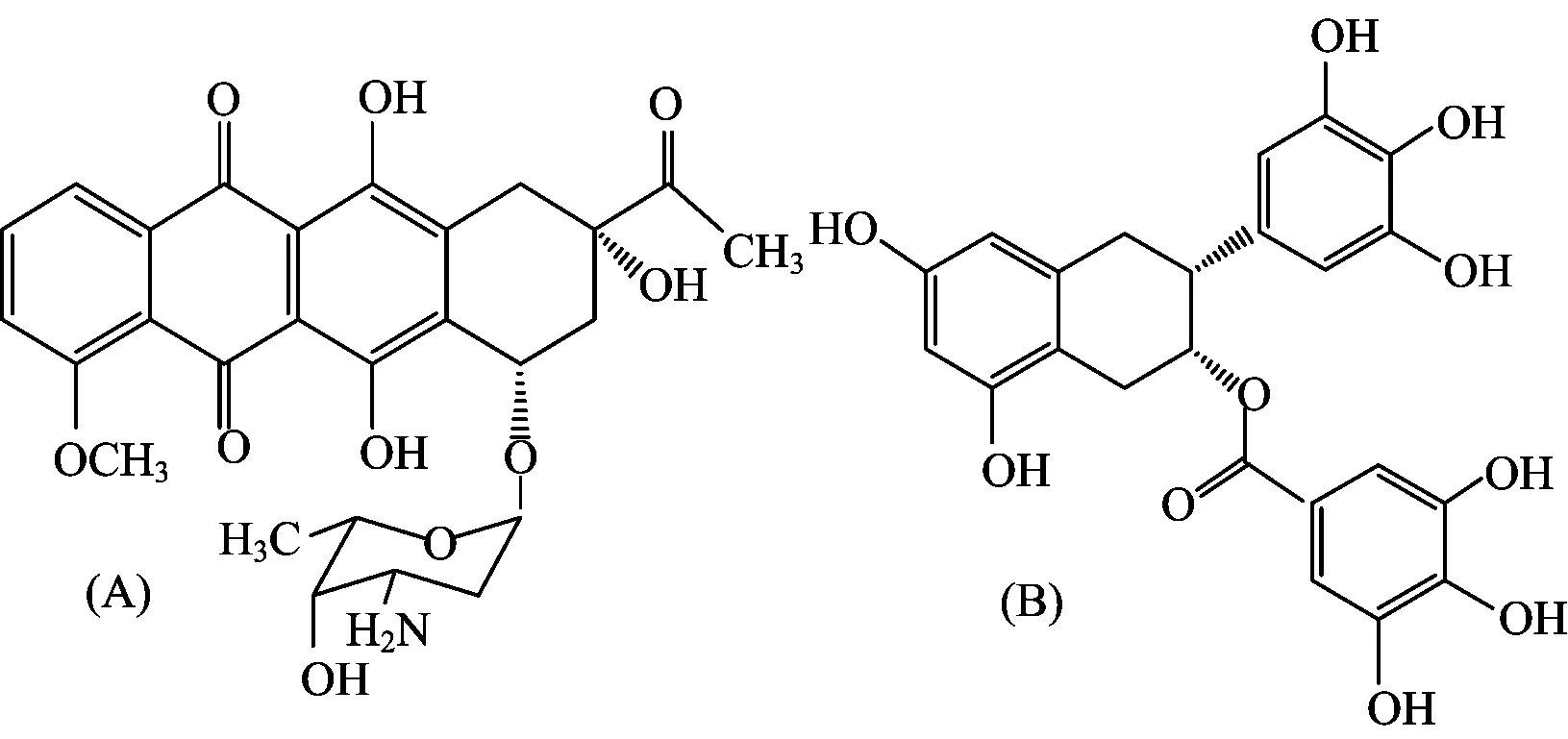
图1 DNR (a)和EGCG (b)的分子结构图Fig.1 Molecular structures of DNR (a) and EGCG (b)
1 实验部分
1.1 试剂和细胞
人血清白蛋白(HSA,纯度≥98%,分子量为66.5 kDa),盐酸柔红霉素(DNR,纯度≥98%),血晶素(纯度≥99%) 和四丁基溴化铵(TBAB,纯度≥99%) 购自上海源叶生物科技有限公司;华法林(纯度≥99%) 和布洛芬(纯度≥99%)购自北京百灵威科技有限公司;3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴化物(MTT)购自美国Sigma公司;DMEM培养基购自美国Thermo Fisher公司;人宫颈癌HeLa细胞株购自武汉普赛诺生命科技有限公司。实验所用其他试剂均为分析纯且使用前无需再次纯化。实验中使用Milli-Q水净化系统中获得的去离子水制备溶液。实验所用缓冲溶液为在不同温度下配制的pH 7.4的Tris-HCl缓冲溶液(0.05 mol·L-1)。人血清白蛋白的储备液在4 ℃下储存过夜。
1.2 仪器
荧光分光光度计(F-4600型,日立,日本);紫外分光光度计(T9CS,北京,中国);动态光散射仪(Zetasizer Nano ZS,马尔文,英国);圆二色光谱仪(J-810,Jasco,日本);细胞培养箱(HERAcell150i,Thermo,美国);酶标仪(Elx 808,Bio tek,美国)。
1.3 荧光光谱
1.3.1 二元体系荧光光谱
在DNR+HSA二元体系中,HSA的浓度为4×10-6mol·L-1,DNR的浓度为(0,0.4,0.8,1.2,1.6,2.0,2.4,2.8,3.2,3.6,4.0,4.8)×10-5mol·L-1。激发波长为295 nm,激发与发射狭缝宽度均为5.0 nm,测量温度为298.2,302.2,306.2和310.2 K,配制好的样品恒温30 min后测定305~420 nm范围的荧光光谱。固定激发和发射的波长差分别为60和15 nm,其他与上述条件相同,扫描DNR存在下HSA的同步荧光光谱。
1.3.2 位点标记
为了确定DNR在蛋白上的结合位置,用血晶素、华法林和布洛芬为标记探针,分别标记HSA的ⅠB,ⅡA和ⅢA结构域[6]。首先制备标记物与HSA的混合溶液,其中标记物与HSA的浓度均为4×10-6mol·L-1,平衡30 min后向上述溶液中加入不同量的DNR溶液,DNR的浓度与二元体系荧光光谱实验中相同,利用1.3.1中的实验参数记录DNR+(标记物+HSA)的荧光数据。
1.3.3 三元体系荧光光谱
EGCG存在下的DNR+(EGCG+HSA)三元体系中,EGCG与HSA的摩尔比为1∶1,其他条件均与二元体系荧光光谱实验一致。
1.4 紫外吸收光谱
HSA的浓度为5×10-6mol·L-1,DNR 的浓度分别为(0,0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0和6.0)×10-5mol·L-1,以pH 7.4的Tris-HCl 缓冲溶液为参比,测定DNR存在下HSA在245~305 nm波长范围内的紫外吸收光谱。
1.5 圆二色光谱
所测溶液为HSA (2×10-6mol·L-1)、HSA+DNR (HSA∶DNR=1∶5或1∶15)、HSA+EGCG (HSA∶EGCG=1∶2)与(HSA+EGCG)+DNR(HSA∶EGCG∶DNR=1∶2∶15)。扫描波长为200~250 nm,扫描速率为200 nm·min-1,分辨率为0.1 nm,响应时间为1 s,累积次数3次。
1.6 动态光散射
HSA的浓度保持为1.5×10-5mol·L-1。HSA+DNR二元体系中,HSA与DNR的摩尔比为1∶5或1∶15。(HSA+EGCG)+DNR三元体系中,HSA∶EGCG∶DNR为1∶2∶15。测量粒径前所有溶液皆通过0.22 μm的水系过滤头(Millipore公司,美国)进行过滤,测量温度为25 ℃。
1.7 体外细胞毒性
所用HeLa细胞株利用DMEM培养基 (含10%胎牛血清和100 U·mL-1的青霉素、链霉素),于37 ℃,5% CO2细胞培养箱中培养,每2天更换一次培养液,用胰酶消化并传代,留取对数期细胞用于MTT实验,以测定DNR,HSA+DNR,EGCG+DNR以及HSA+EGCG+DNR复合物对HeLa细胞的体外细胞毒性。将HeLa细胞以3×103个·孔-1的密度接种在96孔板上,0.1 mL含有血清的培养基中培养24 h,然后用0.1 mL含有药物或药物复合物且不含有血清的培养基替换原先培养基,其中HSA∶DNR=1∶1,HSA∶EGCG∶DNR=1∶1∶1,继续培养48 h,加入20 μL MTT (PBS配制浓度为5 mg·mL-1),培养4 h后除去孔中溶液,每孔加入150 mL DMSO使用酶标仪在570 nm波长下测定吸光度。
2 结果与讨论
2.1 荧光光谱法
2.1.1 DNR对HSA猝灭机制的研究
如图2所示,在激发波长为295 nm时,HSA在338 nm处产生内源荧光。随着DNR浓度的增大,HSA的荧光强度出现有规律的降低,峰形和峰位保持不变,表明DNR对HSA存在荧光猝灭现象,二者存在相互作用。
荧光猝灭机制分为动态猝灭和静态猝灭,可以通过猝灭常数与温度的关系来进行判断。荧光猝灭常数可利用Stern-Volmer方程求得[7]
F0/F=1+KSV[Q]=1+kqτ0[Q]
(1)
式(1)中,F0和F分别为加入猝灭剂前后HSA的荧光强度,KSV为猝灭常数,kq为猝灭速率常数,τ0为HSA的荧光寿命,约为10-8s[8],[Q]为猝灭剂的浓度。

图2 pH 7.4,298.2 K下DNR对HSA的荧光猝灭光谱(DNR∶HSA=1~12)Fig.2 Fluorescence emission spectra of HSA in the presence of DNR (DNR∶HSA=1~12) at 298.2 K,pH 7.4
不同温度下的F0/F对DNR浓度作图均呈良好线性关系,所得猝灭速率常数列于表1中。由表1可见,猝灭速率常数kq数量级均为1012,远远大于各类猝灭剂对生物大分子的最大动态猝灭速率常数2.0×1010L·mol-1·s-1,并且可以看出在298.2,302.2,306.2和310.2 K下,随着温度的升高HSA的猝灭常数减小,由此可以推测出DNR与HSA形成复合物,此过程为静态猝灭过程。
紫外吸收光谱法用于DNR与HSA结合机制的验证。不同浓度DNR对HSA紫外吸收光谱的影响如图3所示,随着DNR浓度的增加,HSA吸光度增大,表明DNR与HSA之间形成复合物。另外对于静态猝灭来说,蛋白的吸收强度由于生成复合物而改变,动态猝灭则不会变化。图3中插图所示为紫外差谱图,图中(HSA+DNR)-DNR吸收谱线与HSA的吸收谱线存在差异,该结果进一步表明DNR与HSA相互作用为静态猝灭过程[9]。
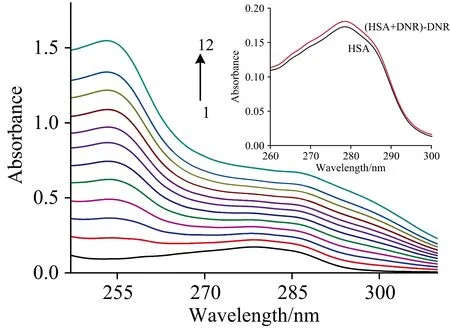
图3 298.2 K时DNR存在下HSA的紫外吸收光谱图,插图为差谱图,c(HSA)=c(DNR)=5×10-6 mol·L-1Fig.3 Absorption spectra of HSA in the presence of DNR at 298.2 K. The inset corresponds to the absorption spectra of HSA only and the difference absorption spectra between HSA+DNR and DNR at the same concentration,c(HSA)=c(DNR)=5×10-6 mol·L-1

表1 不同温度下DNR与HSA相互作用的猝灭速率常数、结合常数、结合位点数和吉布斯自由能变Table 1 Quenching rate constants,binding constants,the number of binding sites and Gibbs free energy changes for the interaction of DNR with HSA at different temperatures
2.1.2 DNR与HSA结合的热力学参数
对于静态猝灭,相互作用过程中的结合常数(Ka)和结合位点数(n)可以通过下列方程得到[10]
log[(F0-F)/F]=logKa+nlog([Q]0-n(F0-F)[P]0/F0)
(2)
其中[Q]0和[P]0分别为药物与蛋白的总浓度。如本课题组前期工作[8]中所述,在Microsoft Excel中赋予n的初值为1,log[(F0-F)/F]对log([Q]0-n(F0-F)[P]0/F0)作图并线性拟合得到一个n值,多次拟合直到n值为定值不再变化。由log[(F0-F)/F]对log([Q]0-n(F0-F)[P]0/F0)的最终线性作图(图4),所得结合常数Ka与结合位点数n列于表1中。由表1数据可见,所测温度下的结合位点数n均约为1,表明利用荧光方法所得DNR在HSA上有一个结合位点。四个温度下结合常数数量级均为104,且随着温度升高而增加,表明DNR与HSA的结合为中等强度的结合,高温有利于DNR的结合。
当温度变化不太大时,焓变可看作一个常数,则焓变和熵变可由298.2,302.2,306.2和310.2 K四个温度下DNR与HSA相互作用的结合常数利用Van’t Hoff方程式(3)求得[11]
lnKa=-ΔHo/RT+ΔSo/R
(3)
吉布斯自由能变ΔGo由式(4)求得[11]
ΔGo=ΔHo-TΔSo=-RTlnKa
(4)
lnKa对1/T作图得DNR与HSA相互作用的焓变和熵变分别为40.92±0.52 kJ·mol-1和221.83±1.70 J·mol-1·K-1,表明结合过程主要为熵驱动,且疏水作用为结合过程的主要驱动力[12]。
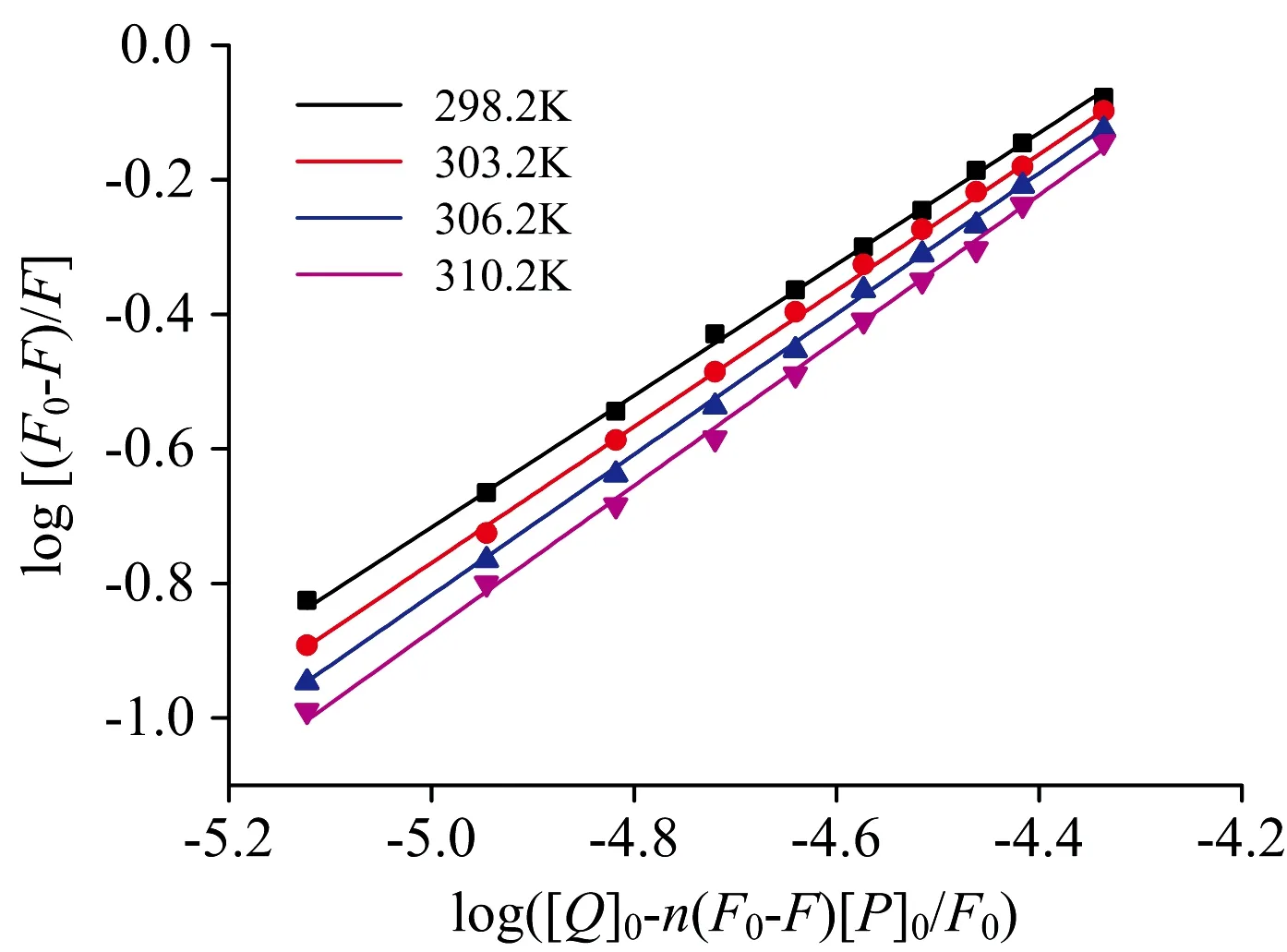
图4 不同温度下,DNR+HSA作用的Stern-Volmer曲线Fig.4 Modified Stern-Volmer plots for DNR+HSA interaction at different temperatures
2.1.3 DNR在HSA上的结合位点
为了确定DNR在HSA上的结合位置,在298.2 K下分别用血晶素、华法林和布洛芬作为位点ⅠB,ⅡA和ⅢA的特异性探针进行了竞争标记实验。标记物存在下,DNR与HSA相互作用的结合常数与结合位点数列于表2。与不存在标记物相比,存在华法林时DNR与HSA的结合明显减弱;布洛芬和血晶素存在下,结合常数略有减小,表明DNR与华法林存在竞争作用,即主要结合在HSA的位点ⅡA上。

表2 298.2 K,标记物存在下DNR与HSA的结合常数(Ka)与结合位点数(n)Table 2 Binding constants (Ka) and the number of binding sites (n) for the binding of DNR to HSA in the presence of site markers at 298.2 K
2.1.4 DNR存在下HSA的同步荧光光谱
当Δλ为15和60 nm时,同步荧光分别为酪氨酸和色氨酸残基的荧光特性。图5所示为DNR与HSA结合的同步荧光光谱图。当Δλ=15 nm和Δλ=60 nm时,同步荧光的最大发射波长均没有明显变化,表明DNR的加入不会使色氨酸和酪氨酸周围的微环境发生明显变化。DNR对HSA同步荧光的猝灭结果表明Δλ=60 nm时的荧光猝灭程度明显高于Δλ=15 nm时,这表明Δλ=60 nm时DNR对HSA的猝灭更明显,即DNR在HSA上的结合位置更接近色氨酸残基。
2.1.5 EGCG存在下对DNR与HSA亲和力的影响
由标记实验得出DNR结合于HSA的ⅡA位点,文献表明EGCG同样结合于ⅡA位点[8]。为说明一种药物的存在对HSA与另一种药物亲和力的影响,进行了三元体系竞争实验。图6为EGCG存在下DNR与HSA在298.2 K下相互作用的荧光光谱图。由图可看见,DNR的加入导致HSA的荧光强度进一步降低,表明EGCG存在下DNR继续与HSA结合。

图5 HSA (4×10-6 mol·L-1)与DNR (0~4.8×10-5 mol·L-1) 相互作用的同步荧光光谱图Fig.5 Synchronous fluorescence spectra for the interaction of HSA (4×10-6 mol·L-1) with DNR (0~4.8×10-5 mol·L-1)

图6 DNR与HSA在EGCG存在下的荧光光谱图1:HSA;2:HSA+EGCG;3~13:(HSA+EGCG)+DNRFig.6 Fluorescence spectra of DNR+HSA in the presence of EGCG1:HSA;2:HSA+EGCG;3~13:(HSA+EGCG)+DNR
由于EGCG和DNR结合在蛋白的相同位点上,则可如前期工作[8]所述建立三元体系模型。利用EGCG存在下不同浓度的DNR对应的HSA荧光强度,通过Matlab进行非线性最小二乘回归使实验测量的荧光强度Fexp与计算所求荧光强度Fcalc之差的平方和∑(Fexp-Fcalc)2最小,则可拟合得到EGCG存在下DNR与HSA相互作用的Kα2和n(表3)。由表3可知,DNR在EGCG存在下与HSA作用的结合常数和结合位点数均明显减小,这主要是由于EGCG和DNR结合在HSA的相同位点上,EGCG的存在降低了DNR与HSA的亲和力,从而导致DNR的游离浓度增加。此外,当温度由298.2 K升高至310.2 K时,三元体系的结合常数增大,表明EGCG存在下,DNR与HSA的结合仍为吸热过程,即EGCG存在下,DNR与HSA的主要作用力仍为疏水作用。

表3 存在和不存在EGCG下,DNR与HSA结合的结合常数(Ka)和结合位点数(n)Table 3 Binding constants (Ka) and the number of binding sites (n) for the binding of DNR to HSA in the absence and presence of EGCG
2.2 EGCG存在下DNR与HSA结合的二级结构变化
HSA,HSA+DNR及(HSA+EGCG)+DNR的圆二色光谱图在208和220 nm处出现两个负峰,表明体系中主要的二级结构组成为α-螺旋[13-14]。α-螺旋含量可用式(5)和式(6)计算[8]
MRE=observed CD/(cp×n×l×10)
(5)
α-helix(%)=[(-MRE208-4 000)/
(33 000-4 000)]×100
(6)
其中,MRE表示残基椭圆率,cp表示蛋白的浓度,n和l分别为氨基酸残基数 (585)和光路径长度(0.1 cm)。表4中数据表明DNR的加入使HSA的α-螺旋含量减少,且随着DNR浓度增加进一步减少,表明DNA的结合使得HSA的二级结构发生轻微变化。EGCG的存在使HSA的α-螺旋含量减少,但是在EGCG存在的三元体系中α-螺旋含量大于相应的二元体系的α-螺旋含量,表明两种药物存在竞争结合,即EGCG的存在阻碍了DNR与HSA的结合。

表4 存在或不存在EGCG时,HSA和DNR+HSA的α-螺旋含量与水合粒径(Dh)Table 4 The α-helical contents and hydrodynamic diameters of HSA and HSA+DNR in the absence and presence of EGCG
2.3 EGCG存在下DNR与HSA结合的粒径变化
HSA,HSA+DNR及(HSA+EGCG)+DNR体系的水合粒径(Dh)值列于表4中。所测体系的多分散性指数在0.1~0.2之间,表明即使药物存在下的二元与三元复合物的尺寸也呈均匀分布。在DNR与HSA相互作用后,颗粒直径略微增加,表明由于药物分子与HSA的结合导致复合物结构松散。但是HSA∶DNR=1∶15时,EGCG的存在使Dh的值相较于二元体系减小,表明EGCG与DNR存在竞争结合,EGCG使DNR与HSA的结合减弱,与CD结果一致。
2.4 体外细胞毒性实验
通过MTT法测量DNR,HSA+DNR,EGCG+DNR和HSA+EGCG+DNR对人宫颈癌HeLa细胞的细胞毒性。细胞毒性的计算方法如式(7)[15]
Cytotxicity=(A-B)/A×100%
(7)
其中,A和B分别为正常培养基培养及加有药物或药物-蛋白复合物的培养基培养的细胞的吸光度。

图7 DNR,HSA+DNR(a),EGCG+DNR以及HSA+EGCG+DNR(b)对HeLa细胞的体外细胞毒性Fig.7 In vitro cytotoxicity of DNR,HSA+DNR (a),EGCG+DNR and HSA+EGCG+DNR (b) in HeLa Cells
两种药物对同一细胞的协同作用可通过式(8)计算[16]
CI=(D)1/(Dx)1+(D)2/(Dx)2
(8)
其中,CI表示组合指数,(Dx)1和(Dx)2为单一药物作用达到x%时药物的浓度,D1和D2为两种药物共同作用达到x%时药物的浓度。本文中,x%指50%抑制。
图7(a,b)为DNR,HSA+DNR,EGCG+DNR及HSA+EGCG+DNR对人宫颈癌HeLa细胞的细胞毒性。由图看见,DNR对HeLa细胞的细胞毒性具有剂量依赖性[图7(a)]。计算得到上述四个体系的IC50值分别为(0.09,0.04,0.07和0.01)×10-6mol·L-1。IC50值表明HSA的加入使DNR的细胞毒性增大,其原因可能为DNR+HSA大分子复合物更容易使药物通过内吞的形式进入细胞,从而更好地发挥作用。
CI>1,CI=1和CI<1时分别表示两种药物的加和、拮抗和协同作用。EGCG+DNR和HSA+EGCG+DNR复合物的CI50值分别为0.82和0.78,均小于1,表明EGCG与DNR存在协同作用,并且HSA存在下协同作用进一步增强。这主要是由于EGCG与DNR结合在HSA的相同位点上,EGCG的存在导致DNR的游离浓度增加。并且药物与HSA结合形成的大分子复合物更容易内吞进入细胞,从而更好地发挥作用。此结果表明EGCG能够增强DNR对HeLa细胞的细胞毒性。此结果将为EGCG和DNR用于癌症联合治疗提供理论依据。
3 结 论
通过多种光谱方法研究了模拟生理条件下DNR与HSA的相互作用以及EGCG对DNR与HSA结合的影响。并且通过MTT法考察了单一药物、组合药物及其与HSA的复合物对HeLa细胞的体外细胞毒性。实验结果表明,DNR与HSA的结合为静态猝灭过程,其结合过程的主要驱动力为疏水作用力。标记实验表明DNR主要结合在HSA的位点ⅡA上。同步荧光光谱表明DNR在HSA上的结合更接近色氨酸残基。在(HSA+EGCG)+DNR三元体系中,EGCG的存在阻碍了DNR与HSA的结合,这是由于两种药物结合于HSA的同一位点,而存在竞争结合。CD光谱和DLS结果表明与DNR结合后蛋白的构象发生了变化,α-螺旋含量减少,蛋白粒径增大。EGCG存在下α-螺旋含量大于相应的二元体系,而粒径相对于二元体系的有所减小。体外细胞毒性实验结果表明EGCG与DNR的组合对HeLa细胞产生协同抗肿瘤作用。此外,DNR单一药物和EGCG+DNR组合药物的细胞毒性可通过它们与HSA的结合在一定程度上得到增强。本研究可为EGCG和DNR联合用于癌症临床治疗提供理论依据。

