新疆地区胃食管反流病食管外表现与白细胞介素1β基因多态性的相关性
王 娜,旷历琼,杨 英,王 黎,李 媛,王效杰,王 珺,彭 程
新疆维吾尔自治区人民医院 1.干部保健中心; 2.消化内科,新疆 乌鲁木齐 830001
胃食管反流病(gastroesophageal reflux disease, GERD)是一种常见消化系统疾病,主要由胃、肠分泌液及内容物逆流侵蚀食管或组织黏膜而引起[1]。除食管外,咽喉部、呼吸道及口腔等处都可受累产生局部炎症反应,进而出现临床症状,即食管外表现。但由于对GERD食管外表现复杂多样,其相关症状无统一的诊断标准,常导致误诊而影响治疗[2]。加之GERD在不同地区发病率及症状表现存在明显差异,更需要针对不同地区人群的研究来服务于临床[3]。白细胞介素-1β(IL-1β)作为体内一种重要的炎性介质,能够通过多种途径调节胃酸分泌[4],近来不断有研究认为IL-1β在启动子-511位点基因多态性与GERD发生密切相关[5]。但既往研究多停留在GERD易感性层面,少有对遗传因素与GERD食管外表现差异的深入分析。本研究针对新疆地区GERD患者食管外表现进行流行病学研究,并分析其与白介素IL-1β基因多态性的相关性,以期为新疆地区GERD诊治提供新的研究思路,推动我国GERD相关理论的发展和完善。
1 资料与方法
1.1 研究对象持续纳入2018年1月至2019年4月新疆维吾尔自治区人民医院确诊为GERD并愿意配合此次研究的门诊或住院患者,主要来自消化内科、耳鼻喉科和呼吸科、干部保健中心、微创外科。通过自制问卷在门诊或病房搜集患者一般状况及饮食情况并录入医院信息管理系统(HIS),最后通过HIS汇总患者信息。在研究开始前对研究团队成员进行统一的问卷培训,调查过程中,使用统一的指导语并对问卷进行相应的解释,以提高应答率及问卷完成的质量。本研究在开展前获得本院伦理委员会的审核批准,并在伦理委员会的监督指导下进行。
1.2 纳入及排除标准纳入标准:(1)临床确诊为GERD:胃食管反流病量表(gastroesophageal reflux disease questionnaire,Gerd Q)≥8分[6];(2)年龄为20~75岁;(3)接受胃镜检查并同意提供胃黏膜样本进行基因检测;(4)愿意配合此次研究并签署知情同意书。
排除标准:(1)继发性食管炎,如胃食管手术后食管炎、合并消化性溃疡、霉菌等感染因素有关的食管炎;(2)合并腹水、上呼吸道感染、恶性肿瘤及肠梗阻;(3)咳嗽变异性哮喘(CVA)、上气道咳嗽综合征(UACS)及嗜酸细胞性支气管炎(EB)等引起有咳嗽症状的疾病;(4)严重的心、肺、肾、脑及肝脏疾病。
1.3 食管外表现诊断反流性咳嗽的诊断:依据2009年中华医学会呼吸病学分会《咳嗽的诊断与治疗指南》[7],即慢性咳嗽,以白天咳嗽为主;24 h食管pH值监测Demeester积分≥12.70,和(或)SAP≥75%;抗反流治疗后咳嗽明显减轻或消失。反流性咽喉炎的诊断:以针对纤维镜检查的反流性咽喉炎患者设立的反流体征评分量表(reflux finding score,RFS)作为评估标准,当RFS总分≥7分(总分26分)[8]时确诊。反流性哮喘的诊断:哮喘诊断遵循2016年中华医学会《支气管哮喘防治指南》[9]相关标准,同时满足以下条件:排除其他原因引起的哮喘如过敏性哮喘、运动性哮喘、感染性哮喘及严重哮喘持续发作期;经抗酸治疗(标准剂量的质子泵抑制剂)后症状缓解或消失。
1.4 IL-1β-511位点基因多态性检测方法选取所有食管外表现GERD患者,并从无外表现组患者中随机抽取170例,取以上患者胃镜检查中获得黏膜组织约100 mg,使用天根组织基因组DNA提取试剂盒(DP-304)提取基因组DNA,严格按照试剂盒说明书指导进行操作,无特殊变动。参照文献[10]报道利用Primer5进行引物设计,PCR引物由北京鼎国生物技术工程有限责任公司合成。rs16944上游引物片段5′-TTGCAAACCATCTACCACAAGTT-3′,下游引物片段5′-CAGAGCTCATCTGGCATTGA-3′。PCR反应总体系为40 μl,反应液为:10×buffer(含Mg2+,20 μM/L)4 μl,dNTP(10 μM/L)1 μl,TaqDNA聚合酶(2 U/L)1 μl,模板DNA 1 μl,上下游引物各1 μl(10 μM/L),加ddH2O至40 μl,在PTC-100 PCR扩增仪上扩增。反应程序:95 ℃预变性5 min,进入循环,95 ℃变性45 s,57 ℃退火1 min,72 ℃延伸45 s,共35个循环;72 ℃延伸10 min,4 ℃保存。反应结束后取5 μl扩增产物于1TAE缓冲液中用质量浓度为10 g/L琼脂糖凝胶电泳20 min(恒压150 V),电泳结果在凝胶成像系统下拍照并保存。PCR扩增产物由北京鼎国生物技术工程有限责任公司测序,采用正向测序方法,结果返回后对相应位点分型并记录。
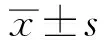
2 结果
2.1 新疆地区GERD患者食管外表现发生率研究期间共纳入1 100例GERD患者,其中维族468例,汉族632例,年龄(50.00±12.60)岁(32~75岁),体质量(70.32±14.58)kg(50~90.5 kg)。共524例患者出现食管外表现,其中30例患者同时发生反流性咽炎和反流性咳嗽,28例同时发生反流性咽炎和反流性哮喘,26例同时发生反流性咳嗽和反流性哮喘。新疆地区反流性咽喉炎、反流性咳嗽和反流性哮喘的发生率分别为26.91%、16.09%和12.27%。汉族患者食管外表现发生率总体低于维族(P=0.001),但反流性咽喉炎发生率高于维族患者(P=0.001),具体结果见表1。
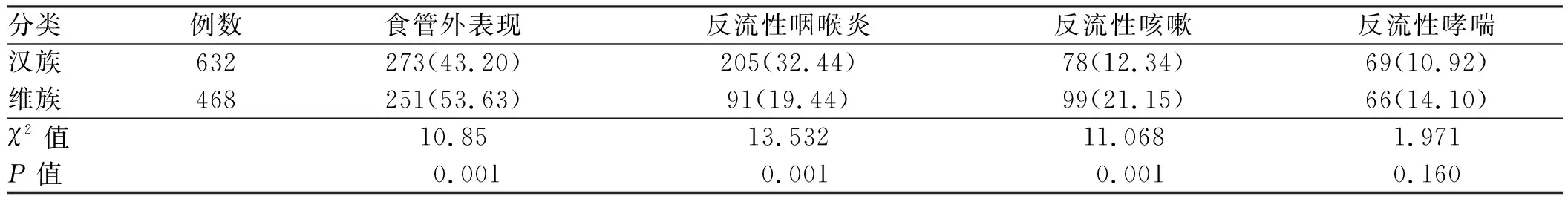
表1 新疆地区GERD食管外表现的发生率[n(%)] Tab 1 Incidence of extra-esophageal manifestations in patients with GERD in Xinjiang region [n(%)]
2.2 新疆地区GERD患者IL-1β-511位点基因Hardy-Weinberg检验对rs16944位点基因型观察值与期望值进行Hardy-Weinberg平衡分析,结果显示,反流性咽喉炎(χ2=2.988,P=0.223)、反流性咳嗽(χ2=3.589,P=0.166)、反流性哮喘(χ2=3.944,P=0.139)以及无食管外表现组(χ2=3.782,P=0.151)吻合度良好。
2.3 IL-1β-511基因表型在不同新疆GERD食管外表现分布进一步对食管外表现组与无食管外表现组基因型差异分析显示,无食管外表现组基因启动子IL-1β-511等位基因G携带占比57.1%,高于反流性咽喉炎组(P<0.001)、反流性咳嗽组(P<0.001)与哮喘组(P<0.001)。基因型分布分析显示,反流性咽喉炎(χ2=17.477,P<0.001)、反流性咳嗽(χ2=14.413,P=0.001)以及反流性哮喘(χ2=14.373,P=0.001)与无食管外表现人群相比,差异均有统计学意义,具体结果见表2。
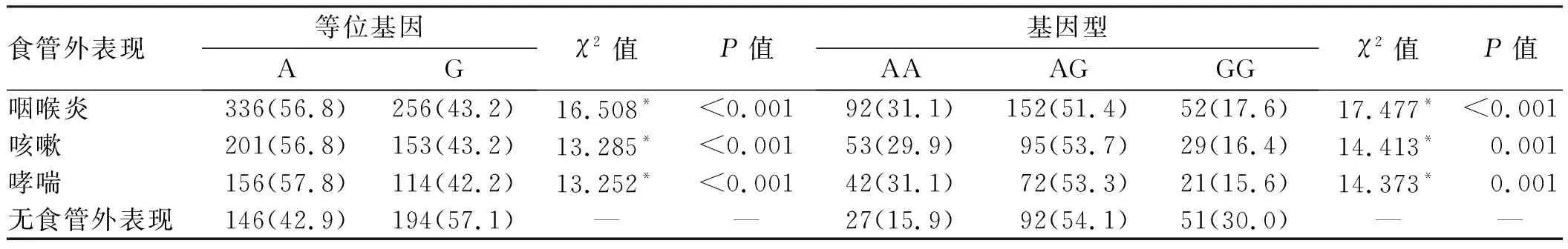
表2 新疆GERD患者发生食管外表现IL-1β-511基因多态性[n(%)]Tab 2 IL-1β-511 gene polymorphism in GERD patients with extra-esophageal manifestations in Xinjiang region [n(%)]
注:*:与无食管外表现人群比较。
2.4 新疆地区GERD患者食管外表现影响因素的单因素分析对比有无食管外表现患者一般资料、饮食习惯和IL-1β-511基因型等进行单因素差异分析。结果显示,两组患者在性别、年龄、BMI资料相近,差异无统计学意义(P>0.05)。而维族患者食管外发生率高于汉族患者,肉食、辛辣、高盐饮食习惯及饮酒史更易导致食管外表现发生(P<0.05)。IL-1β-511基因型分布差异有统计学意义(P<0.05),具体结果见表3。
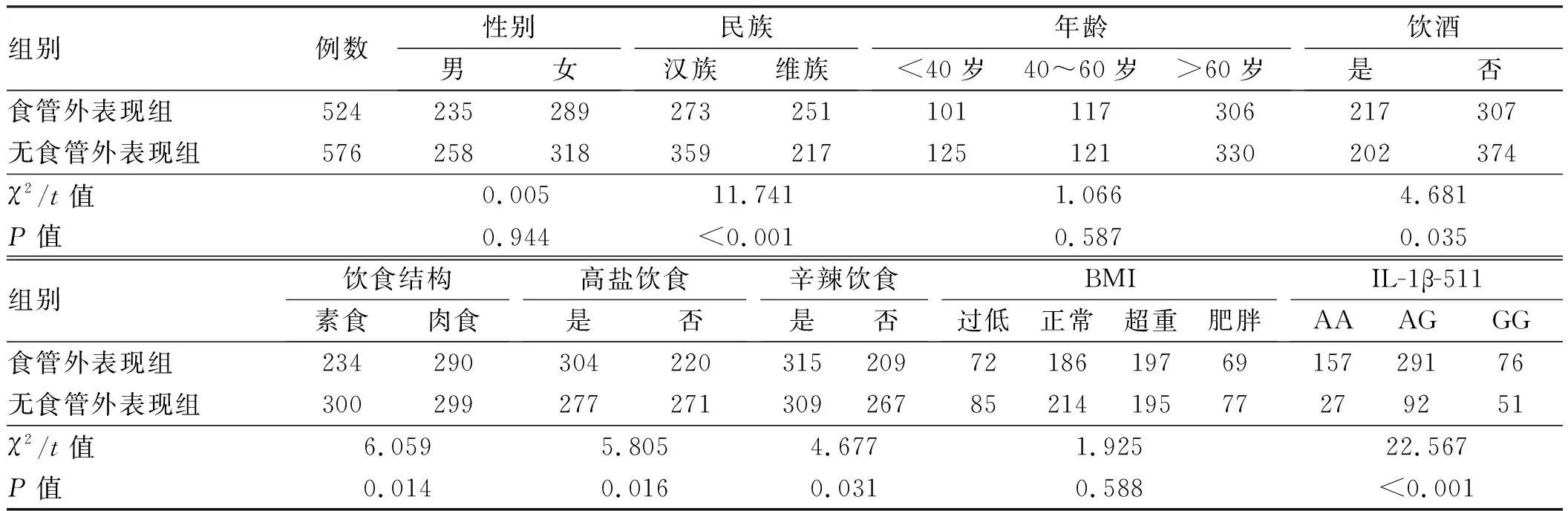
表3 新疆地区GERD食管外表现影响因素的单因素分析Tab 3 Univariate analysis of extra-esophageal manifestations in GERD patients in Xinjiang region
注:高盐饮食的标准为:每日食盐摄入量超过10 g/L;饮食结构分为肉食为主和素食为主,肉食为主的标准为:每周3次及以上食用肉食,每次食用肉食>100 g,2次以下为素食为主。IL-1β-511分析中无食管外表现组总例数为170。
2.5 IL-1β-511基因遗传变异与食管外表现相关性分析在对出现食管外表现危险因素分析的基础上,对IL-1β-511基因遗传变异与不同食管外表现症状进行多因素Logistic回归分析,其中因变量赋值(0=无食管外表现,1=相应外表现症状)。在校正民族、饮食结构、高盐饮食、辛辣饮食几个潜在影响因素后,基因型模型分析显示,G等位基因增加对反流性咽喉炎(OR=0.656,95%CI:0.434~0.993)、反流性咳嗽(OR=0.886,95%CI:0.802~0.979)、反流性哮喘(OR=0.777,95%CI:0.650~0.929)均为保护因素;而显性模型分析中同样显示AG与GG基因型是出现食管外表现(咽喉炎、咳嗽、哮喘)的保护因素,具体结果见表4。
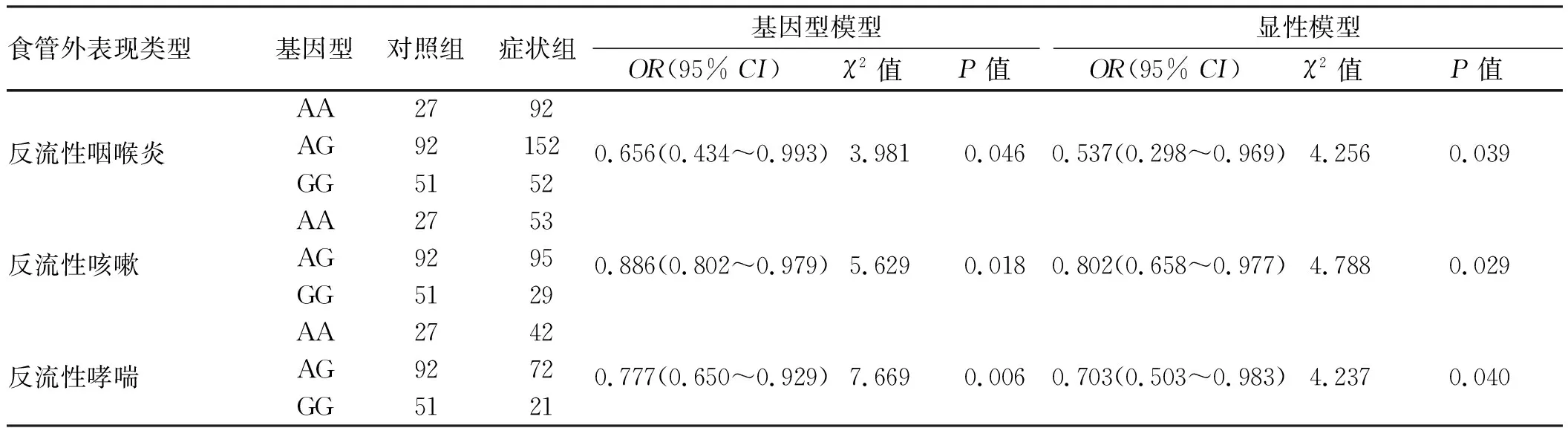
表4 IL-1β-511基因遗传变异与新疆地区GERD食管外表现关联Tab 4 Correlation between IL-1β-511 gene polymorphism and extra-esophageal manifestations in Xinjiang region
注:基因型模型中的OR值表示控制民族、饮食结构、高盐饮食、辛辣饮食等因素后,G等位基因数每增加一个食管外表现发生风险;显性模型中的OR值表示控制民族、饮食结构、高盐饮食、辛辣饮食等因素后,与A等位基因纯合基因型比较,G等位基因杂合和纯合型对食管外表现发生风险的影响。
3 讨论
GERD除典型临床症状胃灼热和反酸外,还具有慢性咳嗽、声音嘶哑、咽部异物感、慢性鼻炎、哮喘等食管外症状,部分患者甚至因食管外症状突出而就诊于其他的科室,以致延误GERD的诊断和治疗[11]。国外报道,超过30%的GERD患者出现过食管外表现症状[12]。国内学者在回顾性分析上海市200例GERD患者中,95例合并有食管外表现,发生率达47.5%[13]。最近的研究显示,国内GERD食管外表现主要以反流性咽喉炎、反流性哮喘和反流性咳嗽最为常见[14]。本文通过对新疆地区1 100例GERD患者反流性咽喉炎、反流性哮喘和反流性咳嗽发生情况汇总分析,结果显示,新疆地区524例食管外表现并发率为47.64%,与既往研究报道相近。但对不同民族进行亚组分析发现,新疆地区汉族患者食管外表现(43.20%)明显低于维族患者(53.63%)。这可能与维吾尔族生活和饮食习惯有关,虽然汉族与维吾尔族共同居住新疆,但受到宗教信仰、经济条件和语言文化等多因素影响,饮食和生活习惯存在较大差异。维族人群饮食结构偏向肉食和高脂饮食,且维族男性普遍吸烟、饮烈酒,暴露更多的食管外表现危险因素,更易诱发食管外表现。进一步对不同民族食管外表现症状分析发现,维族患者更易发生反流性咳嗽与哮喘,而汉族患者反流性咽喉炎的发生概率更高。新疆地区汉族人群更多从事室内工作,更易受到室内外温差大的刺激,同时缺少运动,加之汉族人群多为外地来疆工作,新疆地域辽阔,自然环境复杂且与国内其他地区相差较大,因此,汉族患者咽部黏膜更易受到刺激,诱发咽喉炎症状。
GERD食管外表现不仅受到生活习惯、饮食结构、心理压力等因素的影响,大量研究发现,遗传因素与GERD的发病机制密切相关,并可能参与GERD食管外表现症状的发生、发展。本文对IL-1β-511位点基因多态性分析显示,其基因型分布在是否出现食管外表现患者中存在明显差异(χ2=26.987,P<0.001)。IL-1β是由Th1细胞分泌的重要促炎症细胞因子,IL-1β在胃黏膜中表达水平升高,能够提升胃体内炎症水平,通过破坏胃壁细胞生理功能而减少胃酸分泌,从而减弱食管反流中高酸性对食管的刺激,保护食管黏膜[15]。同时IL-1β位点基因多态性与H.pylori感染GERD患者胃黏膜IL-1β表达密切关联,提示IL-1β可能直接参与胃黏膜清除H.pylori,并抑制感染带来的胃酸分泌[16]。最近一篇荟萃分析报道再次确认IL-1β-511基因多态性与GERD发生存在密切相关性[17]。
IL-1β-511位点碱基突变后,能够增加IL-1β蛋白的表达。Kim等[18]研究发现,GERD患者中IL-1β-511 TT基因型患者胃黏膜中IL-1β表达明显增加,亚组分析发现IL-1β在反流性食管炎患者中表达相较于非糜烂性胃食管反流和健康受试者中明显较少,提示IL-1β-511基因型与不同外表现症状可能存在相关性。在观察到新疆地区GERD食管外表现组患者IL-1β-511基因型分布与非症状组存在明显差异后,我们进一步对等位基因和基因型与发生不同食管外表现的相关性进行深入分析。回归分析显示在校正了饮食因素和民族差异后,G等位基因的突变仍是食管外表现(反流性咽喉炎、咳嗽、哮喘)发生的保护因素,显性模型分析也证实AG与GG型GERD患者发生食管外表现症状危险度降低。
目前主流观念认为GERD患者并发反流性咽喉炎、咳嗽和哮喘有相近的病理基础,均可能与酸性物质的反流,以及反流物微粒刺激迷走神经,引起咽喉部及支气管和肺部的相应症状。同时反流物对途经组织(咽喉、吸道黏膜、气管、支气管等)刺激诱导局部高炎症反应,造成组织损伤进而诱发相应症状。而IL-1β-511位点T碱基突变后,促使IL-1β蛋白表达增加,作为胃酸的强拮抗剂,能够直接中和胃酸过多带来的刺激;同时IL-1β表达提高,能够加速壁细胞破坏腺体,抑制胃酸分泌。以上两种途径均可减少GERD酸性反流物对外部组织的刺激,可能对食管外表现起到保护作用。幽门括约肌对胃内容物停留时间和拮抗十二指肠液反流起到关键作用,而以上功能受到幽门括约肌周期性收缩中的收缩压和持续张力中的静息压的影响。在大鼠模型研究中发现,IL-1β蛋白可能通过cGMP、NO途径调剂鼠幽门括约肌内钙离子浓度,从而影响幽门括约肌的收缩振幅与频率,从而调节幽门括约肌的生理功能[19]。我们推测IL-1β-511基因多态性可能也会影响幽门括约肌功能,通过调节反流液量及频率而影响食管外表现症状的发生。
综上所述,IL-1β-511位点基因多态性与新疆地区GERD患者食管外表现存在明显相关性,G等位基因突变是发生食管外表现的保护因素。

