敲低长链非编码RNA LOXL1-AS1表达对胃癌细胞增殖、凋亡的影响及其机制
李 明, 谭诗云, 柴 红
武汉大学人民医院消化内科 消化系统疾病湖北省重点实验室,湖北 武汉 430060
胃癌是常见的消化道恶性肿瘤,其死亡率高居肿瘤相关死亡的第三位。特别是在发展中国家,胃癌患者的数量占全球胃癌患者的70%以上[1]。我国每年约21 000例胃癌患者死亡,占世界胃癌死亡总人数的一半[2]。虽然近年来在肿瘤诊治方面有了巨大进步,但胃癌患者预后仍然很差,5年生存率低于20%[3]。随着生物学的迅速发展,阐明胃癌发生和发展的分子机制是实现胃癌靶向治疗的关键。
长链非编码RNA(long non-coding RNA,lncRNA)为长度超过200个核苷酸的RNA分子。其本身不具备编码蛋白的能力,但可在转录水平、转录后水平调控基因的表达和调节真核细胞的各种生理过程[4]。大量研究发现,lncRNA在肿瘤中异常表达,在肿瘤的发生和发展过程中起着关键作用[5-9]。lncRNA HEIH在大肠癌组织和细胞中均表达上调,且与肿瘤大小、浸润深度、不良预后呈正相关[10]。如lncRNA LUCAT1与卵巢癌转移及临床分期呈正相关,且可通过调控miR-612/HOXA13通路促进卵巢癌细胞增殖、侵袭和转移[11]。因此,进一步了解肿瘤相关lncRNA的机制,将有助于开发预后评估标志物,并为肿瘤靶向治疗提供新的思路。LOXL1-AS1是一种lncRNA,编码在赖氨酰氧化酶样1(LOXL1)基因的相反链上[12]。它在细胞应激反应中起着重要作用,并与剥脱综合征的发展相关[13]。有研究报道,LOXL1-AS1在胶质母细胞瘤的间充质亚型(MES)中高表达,并通过NF-κB途径促进MES特征的表达[14]。另一项研究发现,LOXL1-AS1通过激活PI3K/AKT途径调节成神经管细胞瘤的增殖和转移[15]。我们前期研究发现,LOXL1-AS1在胃癌中的表达水平显著高于癌旁组织,且LOXL1-AS1在胃癌中的高表达与肿瘤直径大小、局部淋巴结转移、远处转移、TNM分期和患者预后密切相关。LOXL1-AS1在胃癌中的作用尚不明确,本研究旨在从细胞水平探讨LOXL1-AS1调控胃癌增殖、凋亡的作用。
1 材料与方法
1.1 材料胃癌细胞株(AGS、BGC823、NCI-N87、MGC803和SGC7901)和正常胃黏膜细胞株GES1购自上海君瑞生物技术有限公司;胎牛血清、RPMI 1640购自美国Gibco公司;CCK-8试剂盒购自上海同仁化学;细胞培养瓶、细胞培养皿及6孔培养板购自Corning公司;转染试剂Lipofectamine 2000购自Sigma公司;RNAiso Plus试剂盒、cDNA合成试剂盒及PCR试剂盒购自Takara(大连)有限公司;lncRNA LOXL1-AS1 mRNA靶向shRNA(序列5′-GTGGACAAATCATAACTGAAT-3′)和scramble shRNA (即对照组)(序列5′-GCGTGAAAGTCAACTAATTAA-3′)及其载体由上海吉凯基因化学技术有限公司设计并构建。PI3K、p-PI3K、Akt、p-Akt、Bcl-2、Bax及β-actin抗体购自英国Abcam公司。蛋白浓度测定试剂盒、HRP-羊抗兔、HRP-羊抗鼠购自湖北百奥斯生物公司。
1.2 方法
1.2.1 细胞培养:胃癌细胞和胃黏膜细胞复苏后用含质量浓度为100 g/L胎牛血清的RPMI 1640培养液,置于37 ℃、体积分数为5% CO2饱和湿度条件的恒温箱中培养。实验均选用处于对数生长期的细胞进行。
1.2.2 细胞构建:通过转染LOXL1-AS1 mRNA靶向shRNA构建LOXL1-AS1敲低的胃癌细胞模型。取对数生长期的胃癌BGC823细胞,接种于6孔培养板内,倒置显微镜下观察,当细胞融合度为50%左右时转染。根据制造商的说明书,使用Lipofectamine 2000将插入有scramble shRNA和LOXL1-AS1靶向shRNA的质粒转染到在6孔板中培养的胃癌BGC823细胞中,转染24 h后,更换正常培养基继续培养,收集细胞并加工用于后续实验,实验分组:转染scramble shRNA组即sh-NC组,转染LOXL1-AS1靶向shRNA组即sh-LOXL1-AS1组。
1.2.3 qRT-PCR实验:使用RNAiso Plus试剂提取胃癌细胞株总RNA。根据试剂盒使用说明书,使用cDNA合成试剂盒合成第一链cDNA,采用ABI Prism 7500实时荧光定量PCR仪进行实时PCR检测LOXL1-AS1表达水平,以GAPDH为内参。每20 μl反应体系内加入400 ng cDNA、10 μl TB Green series、正反链引物各0.6 μl及6.88 μl RNase-free ddH2O。qRT-PCR实验条件为95 ℃ 15 min预变性,95 ℃ 10 s、56 ℃ 20 s、72 ℃ 30 s重复40个循环。引物及探针序列如下:LOXL1-AS1引物Forward:5′-GATATGTTGGATGATGGA-3′,Reverse:5′-GATATGTTGGATGGATGA-3′;GAPDH引物Forward:5′-GAAGGTGAAGGTCGGAGTC-3′,Reverse:5′-GAAGATGGTGATGGGATTTC-3′。使用比较循环阈值(Ct)计算基因的相对表达(2-△△Ct),实验重复3次。
1.2.4 细胞增殖实验:将对数生长的两组细胞消化收集重悬,以每孔5 000个/100 μl接种于96孔板中孵育,到达预先设定的实验时间后加入10 μl CCK-8试剂,将细胞在细胞培养箱中继续孵育2 h,然后用酶标仪在450 nm波长处测量吸光度。
1.2.5 流式细胞仪检测细胞凋亡:消化收集2组细胞,根据凋亡试剂盒说明书,分别加入PI及Annexin V染色,再加入结合缓冲液后上流式细胞仪检测细胞凋亡率。
1.2.6 Western blotting实验:收集上述2组细胞,加入200 μl预冷的含PMSF的蛋白裂解液,用移液器反复抽吸后震荡1 min,4 ℃条件下裂解30 min,4 ℃条件下12 000 r/min离心10 min,将上清液小心移至经高压消毒的EP管内,根据蛋白测定试剂盒说明书检测蛋白质浓度,计算蛋白质含量;采用免疫印迹法检测蛋白质表达情况,取40 μg各组样品行SDS-PAGE电泳,再转膜至PVDF膜,5% BSA封闭1 h,根据蛋白分子量切割条带,分别加入一抗及内参β-actin抗体,室温下孵育2 h,再次TBST洗膜,ECL显色及曝光,显影、定影、拍照并分析数据。
1.3 统计学分析采用Graphpad Prism统计学处理软件。计量资料两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 LOXL1-AS1在胃癌细胞株中的表达我们前期研究发现[16],LOXL1-AS1在胃癌中的表达水平显著高于癌旁组织,且LOXL1-AS1在胃癌中的高表达与肿瘤直径大小、局部淋巴结转移、远处转移、TNM分期和患者预后密切相关。因此,我们进一步检测胃癌细胞株(AGS、BGC823、NCI-N87、MGC803和SGC7901)和正常胃黏膜细胞株GES-1中LOXL1-AS1表达情况,结果如图1所示,与正常胃黏膜细胞株GES-1相比,上述胃癌细胞株中LOXL1-AS1表达水平均显著升高(P<0.05)。
2.2 下调LOXL1-AS1表达对胃癌细胞增殖、凋亡的影响基于在5种胃癌细胞株中LOXL1-AS1的表达水平,我们选择胃癌细胞系BGC823细胞转染LOXL1-AS1靶向shRNA构建LOXL1-AS1敲低模型,通过qRT-
PCR验证转染效率,结果表明,转染LOXL1-AS1靶向shRNA后,BGC823细胞中LOXL1-AS1被显著抑制(见图2A);CCK-8实验结果显示,敲低LOXL1-AS1表达后的胃癌BGC823细胞增殖率显著降低(见图2B);流式细胞仪检测结果显示,转染LOXL1-AS1靶向shRNA后细胞凋亡率显著升高(见图2C)。
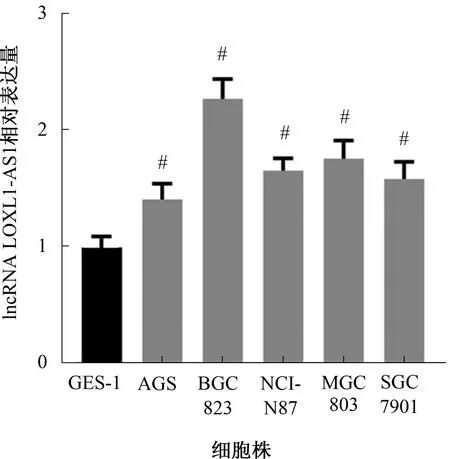
注:与正常胃黏膜细胞株GES-1比较,#P<0.05。
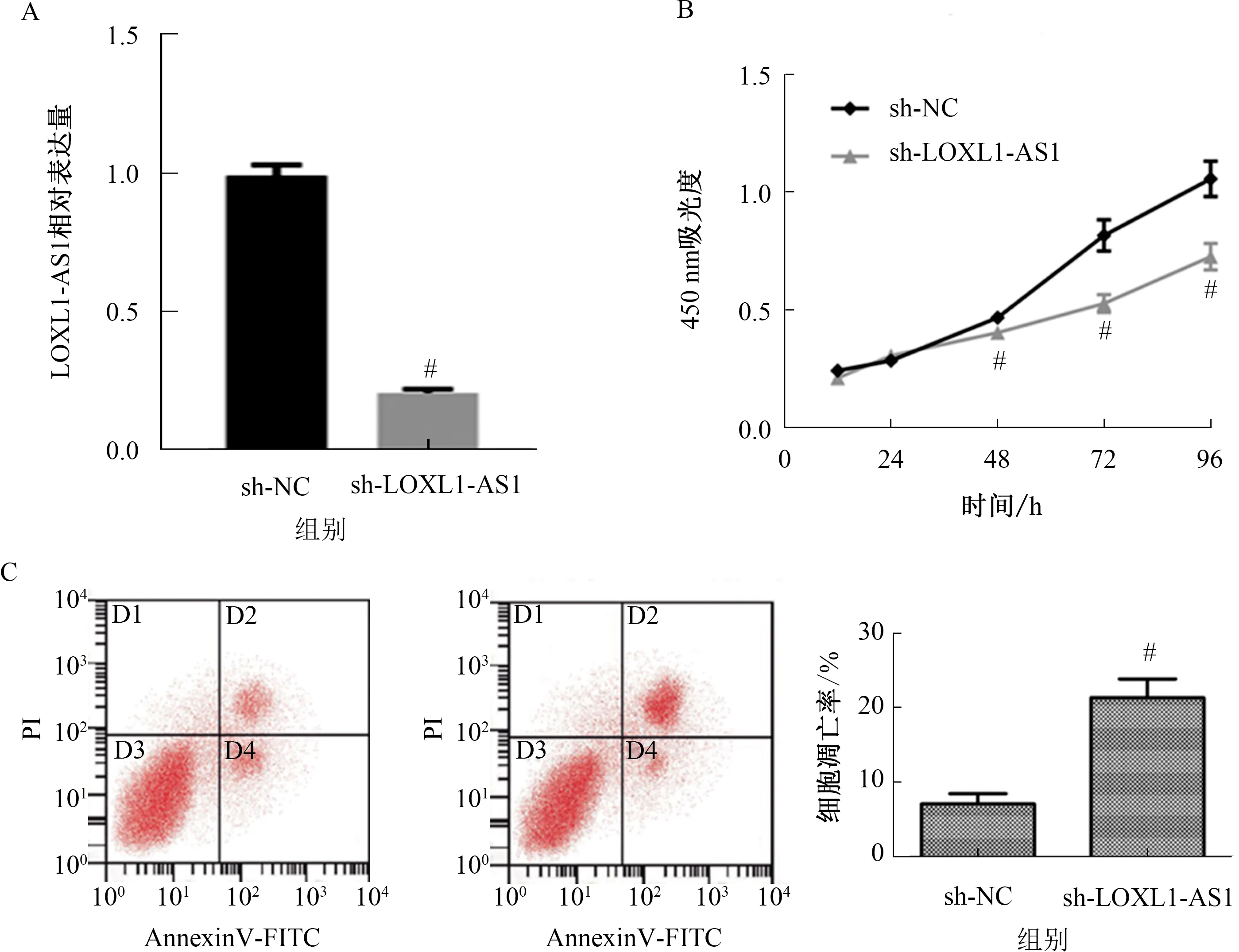
注:A:敲低LOXL1-AS1表达后BGC823细胞LOXL1-AS1表达量显著降低;B:敲低LOXL1-AS1表达后BGC823细胞增殖率显著降低;C:敲低LOXL1-AS1表达后BGC823细胞凋亡率显著升高。与sh-NC组相比,#P<0.05。
2.3 敲低LOXL1-AS1表达对胃癌细胞凋亡相关蛋白的影响Western blotting检测LOXL1-AS1靶向shRNA转染后对BGC823细胞凋亡相关蛋白Bcl-2、Bax表达的影响,结果显示,敲低LOXL1-AS1表达后,BGC823细胞抗凋亡蛋白Bcl-2表达下调,同时促凋亡蛋白Bax表达上调(见图3)。
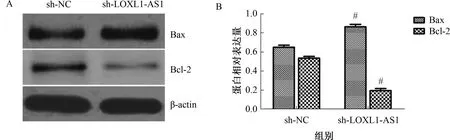
注:A:免疫印迹图;B:灰度值分析。与sh-NC组相比,#P<0.05。
2.4 敲低LOXL1-AS1表达对胃癌细胞PI3K/Akt通路的影响PI3K/Akt通路与肿瘤细胞增殖、凋亡密切相关,我们进一步检测了LOXL1-AS1靶向shRNA转染后对BGC823细胞PI3K/Akt通路相关蛋白表达的情况,免疫印迹结果显示,敲低LOXL1-AS1后,BGC823细胞p-PI3K和p-Akt表达显著降低,提示敲低LOXL1-AS1表达可抑制PI3K/Akt信号通路(见图4)。
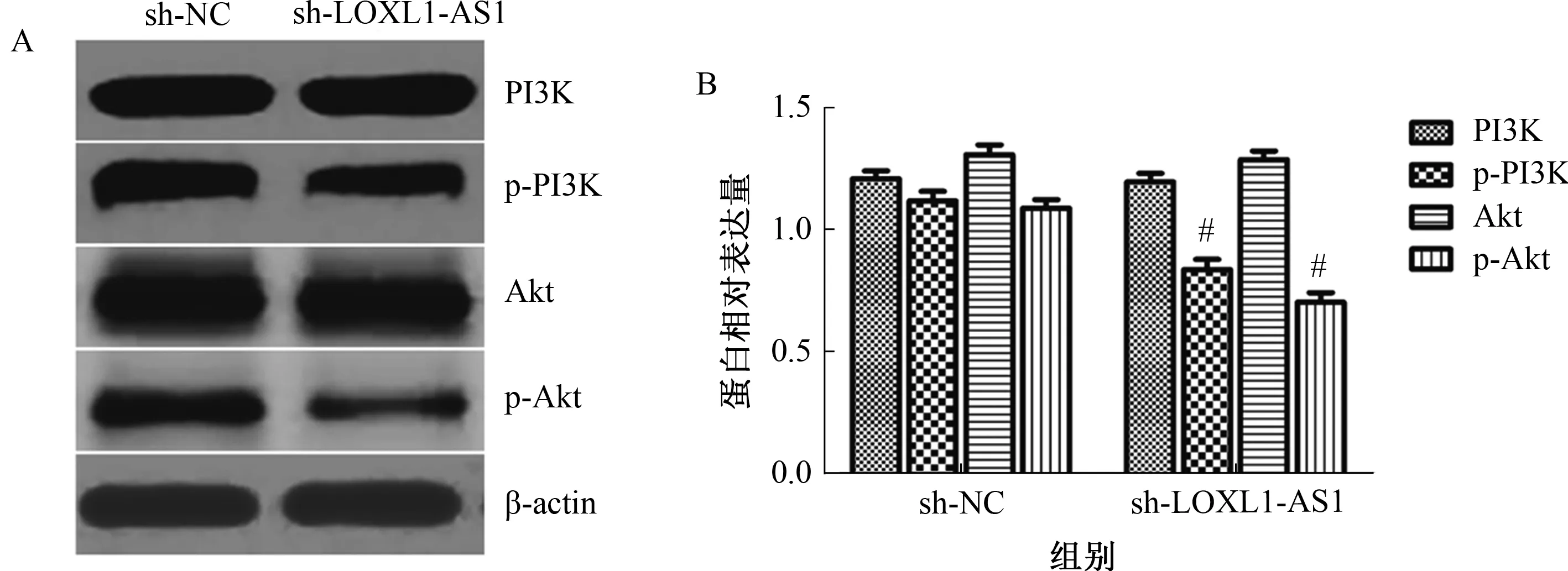
注:A:免疫印迹图;B:灰度值分析。与sh-NC组相比,#P<0.05。
3 讨论
lncRNA研究已经成为肿瘤基因领域研究的热点,大量研究证实,lncRNA的异常表达与肿瘤的发病机制、复发、侵袭转移、耐药及预后等密切相关[17-19]。LOXL1-AS1在多种肿瘤中高表达并影响肿瘤进展,例如,LOXL1-AS1可促进骨肉瘤细胞增殖、迁移和侵袭[20]。我们前期研究发现,LOXL1-AS1在胃癌中的表达水平显著高于癌旁组织,且LOXL1-AS1在胃癌中的高表达与肿瘤直径大小、局部淋巴结转移、远处转移、TNM分期和患者预后密切相关,提示LOXL1-AS1可促进胃癌发生、发展。我们进一步检测了不同胃癌细胞株(AGS、BGC823、NCI-N87、MGC803和SGC7901)和正常胃黏膜细胞株GES-1中LOXL1-AS1表达情况,结果显示,与正常胃黏膜细胞株GES-1相比,上述胃癌细胞株中LOXL1-AS1表达水平均显著升高。
为了进一步探讨LOXL1-AS1在胃癌增殖、凋亡中的作用,我们选取胃癌细胞株中LOXL1-AS1表达最高的胃癌BGC823细胞,转染LOXL1-AS1靶向shRNA敲低LOXL1-AS1表达,qRT-PCR检测验证转染后BGC823细胞LOXL1-AS1表达显著下调。我们进一步观察了下调LOXL1-AS1表达前后胃癌BGC823细胞增殖和凋亡的影响。CCK-8检测结果显示,敲低LOXL1-AS1表达后BGC823细胞增殖显著降低;流式细胞仪检测结果显示,敲低LOXL1-AS1表达后BGC823细胞凋亡率显著升高。上述结果表明,LOXL1-AS1在胃癌发生、发展中起促进作用,而敲低LOXL1-AS1表达可能在胃癌中具有一定的治疗意义。
我们进一步探讨了敲低LOXL1-AS1表达抑制胃癌增殖并促进细胞凋亡的机制。PI3K/Akt信号通路广泛参与机体的病理和生理过程的调控,并在肿瘤中异常激活,与肿瘤细胞增殖、凋亡密切相关[21-22]。本实验发现,敲低LOXL1-AS1表达后胃癌BGC823细胞p-PI3K和p-Akt表达显著降低,同时抗凋亡蛋白Bcl-2表达下调,促凋亡蛋白Bax表达上调,提示敲低LOXL1-AS1表达可抑制PI3K/Akt信号通路,继而上调促凋亡蛋白Bax表达,并下调抗凋亡蛋白Bcl-2表达,最终抑制细胞增殖并促进细胞凋亡。
综上所述,lncRNA LOXL1-AS1在胃癌发生、发展中起促进作用,敲低LOXL1-AS1表达可抑制胃癌细胞增殖并促进细胞凋亡,其机制可能是通过抑制PI3K/Akt信号通路,继而调控凋亡相关蛋白表达。

