血浆糖化血红蛋白与超敏C反应蛋白联合检测在糖尿病合并冠心病患者中的应用研究
王改改
三门峡市陕州区人民医院检验科,河南 三门峡 472000
冠心病(CHD)是糖尿病(DM)患者最常见的并发症,其主要因患者多伴随高血压、肥胖、高胰岛素血症等心血管危险因素,且高胰岛素血症又引发患者糖脂代谢紊乱、高纤维蛋白原血症等,从而增大冠心病的发病率[1]。糖化血红蛋白(HbA1c)是患者早期糖化蛋白质的重要组成部分,与动脉粥样硬化的发展关系密切[2];超敏C反应蛋白(hs-CRP)是全身性炎症反应急性期的非特异性标志物,也是心血管事件危险最强有力的预测因子[3]。本研究通过对三门峡市陕州区人民医院84例糖尿病合并冠心病患者的HbA1c与hs-CRP水平进行检测,旨在分析糖尿病合并冠心病患者HbA1c与hs-CRP水平在临床中的应用价值。报告如下。
1 资料与方法
1.1 一般资料
选取于2015年2月—2019年2月间三门峡市陕州区人民医院收治的168例糖尿病患者,本研究经医院医学伦理委员会审核通过,将84例糖尿病患者设为对照组,其中男45例,女39例,年龄40~65岁,平均年龄(52.26±3.54)岁;糖尿病病程3~11年,平均病程(6.14±1.01)年;将84例糖尿病合并冠心病患者设为观察组,其中男44例,女40例,年龄41~67岁,平均年龄(52.31±3.68)岁;糖尿病病程3~12年,平均病程(6.17±1.12)年。纳入标准:符合糖尿病相关诊断标准[4];患者及家属知情同意。排除标准:合并肾功能衰竭者;合并恶性肿瘤者;自身免疫系统障碍者;伴随慢性感染性疾病者。两组一般资料对比,差异无统计学意义(P>0.05)。
1.2 方法
两组患者均于检测前禁食12 h,于次日清晨抽取空腹静脉血,HbA1c检测采用酶法;hs-CRP检测采用乳胶免疫比浊法;TG及TC使用氧化酶法,肌酸激酶同工酶(CK-MB)使用免疫抑制法。上述指标均采用BS-800全自动分析仪检测。
1.3 观察指标
(1)对比两组HbA1c与hs-CRP水平。(2)根据观察组的HbA1c水平,以6.5%为界,将6.5%及以下患者设为低HbA1c组,6.5%以上患者设为高HbA1c组,比较两组TG、TC、CK-MB及hs-CRP水平。(3)比较不同HbA1c水平糖尿病合并冠心病患者冠状动脉病变状况。使用Judkins法检测两组冠状左右动脉病变情况,并根据冠脉病变程度及范围分为单支病变、双支病变、多支病变。
1.4 统计学方法
数据采用SPSS 22.0软件进行统计分析,计数资料以例数和百分比(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者HbA1c与hs-CRP水平比较
观察组HbA1c、hs-CRP水平高于对照组,差异有统计学意义(P<0.05),见表1。
2.2 不同HbA1c水平DM合并CHD患者生化指标比较
高HbA1c组TG、TC、CK-MB、hs-CRP均高于低HbA1c组,差异有统计学意义(P<0.05),见表2。
表1 两组患者HbA1c与hs-CRP水平情况(±s)
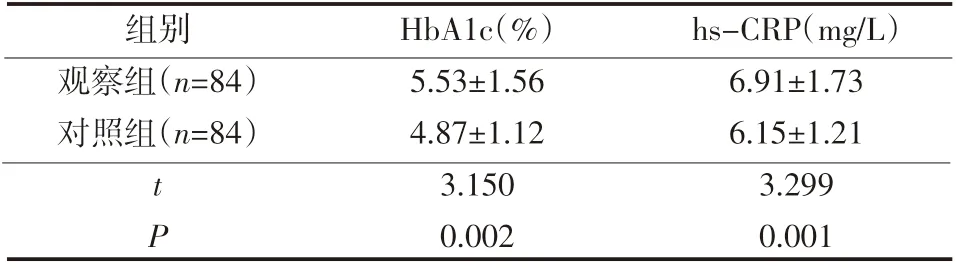
表1 两组患者HbA1c与hs-CRP水平情况(±s)
组别观察组(n=84)对照组(n=84)tP HbA1c(%)5.53±1.56 4.87±1.12 3.150 0.002 hs-CRP(mg/L)6.91±1.73 6.15±1.21 3.299 0.001
表2 两组不同HbA1c水平DM合并CHD患者生化指标情况(±s)
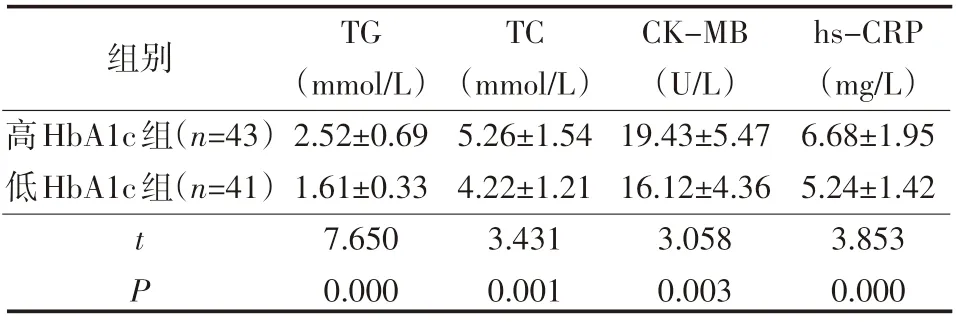
表2 两组不同HbA1c水平DM合并CHD患者生化指标情况(±s)
组别高HbA1c组(n=43)低HbA1c组(n=41)tP TG(mmol/L)2.52±0.69 1.61±0.33 7.650 0.000 TC(mmol/L)5.26±1.54 4.22±1.21 3.431 0.001 CK-MB(U/L)19.43±5.47 16.12±4.36 3.058 0.003 hs-CRP(mg/L)6.68±1.95 5.24±1.42 3.853 0.000
2.3 不同HbA1c水平DM合并CHD患者冠状动脉病变状况
高HbA1c组多支病变发生率高于低HbA1c组,差异有统计学意义(P<0.05),见表3。
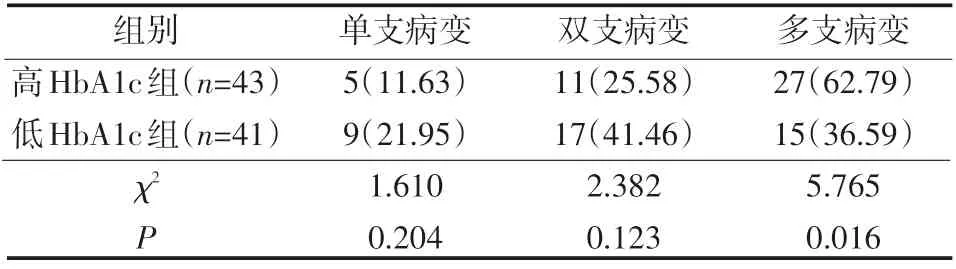
表3 两组DM合并CHD患者冠状动脉病变状况 例(%)
3 讨论
HbA1c是红细胞中血红蛋白与血清中糖类相结合的产物,该指标是通过持续、缓解且不可逆的糖化反应形成,其水平高低取决于血糖与血红蛋白接触时间及血糖浓度,与是否空腹、抽血时间、葡萄糖浓度变化及胰岛素使用情况无关,因此,该指标可有效反映过去1~2个月内血糖控制情况,是衡量糖尿病患者长期血糖控制情况的金标准,也是诊断及管理糖尿病的重要手段[5]。hs-CRP是微生物侵入机体后引起组织损伤等炎性刺激时肝细胞合成的急性相蛋白,该因子可提高巨噬细胞的吞噬能力,并对单核细胞表面组织进行刺激,提高表面组织因子的表达能力,从而加快炎症反应蔓延,据相关研究显示,2型糖尿病的发病与其关系密切[6]。
本研究中,观察组HbA1c、hs-CRP高于对照组,高HbA1c组TG、TC、CK-MB、hs-CRP均高于低HbA1c组,高HbA1c组多支病变发生率高于低HbA1c组。表明DM合并CHD患者较DM患者而言,HbA1c、hs-CRP显著升高,体内炎症反应更加剧烈;同时,高HbA1c组病情更为复杂,各项生化指标均高于低HbA1c组;此外,高HbA1c组冠状动脉多支病变显著高于低HbA1c组,说明血糖水平控制不理想时,可进一步加重冠状动脉病变程度。HbA1c可对患者的血管及组织造成损伤,诱发糖尿病患者血凝、血栓形成,从而引发动脉粥样硬化,同时HbA1c水平升高可提高并发症的发生几率,并促使心、肾等多器官快速老化。据相关研究表明,蛋白糖基化修饰形成高级糖基化终末产物(AGEs)与HbA1c水平升高关系密切,AGEs可与低密度脂蛋白(LDL)发生作用,形成AGEs-LDL,从而造成血脂水平上升;同时,AGEs可对单核细胞功能造成一定影响,促使动脉粥样硬化产生[7]。白介素-1及肿瘤坏死因子-α均由单核巨噬细胞所分泌,这些炎症指标于炎症反应中发挥重要作用,可加快组织蛋白酶的分泌及合成;同时胰岛素样生长因子-1可有效刺激间质细胞,促使其生长;此外内皮细胞表明受体与AGEs相结合,可提高内皮层通透性,多种因素综合导致动脉硬化发生。hs-CRP是对于炎症反应最为敏感的急性时相蛋白,该指标于DM合并CHD患者中升高,与内皮功能障碍关系密切。当患者内皮功能发生障碍时,促使内皮细胞黏附性提高,通透性也随之提高,造成血液凝固加快,并诱导血管细胞因子、活性因子及生长因子产生,导致hs-CRP水平上升。同时,糖尿病患者胰岛素抵抗现象会加剧机体炎症反应,进一步提高内皮细胞通透性,加快损伤后多种衍化生长因子的产生,并促进平滑肌细胞分泌及释放肿瘤坏死因子-α、白介素-1等炎性因子,导致肝脏加快hs-CRP分泌[8]。
综上所述,HbA1c、hs-CRP水平可作为DM合并CHD患者诊断的重要指标,有助于提高DM合并CHD的早期诊断率,及时给予患者针对性治疗。

