云南疣粒野生稻抗白叶枯病多菌系鉴定分析
邢佳鑫 陈玲 柯学 钟巧芳 张敦宇 付坚 陈越 肖素勤 王玲仙 王波 殷富有 陈丽娟 程在全*
(1 云南农业大学农学与生物技术学院,昆明650201;2 云南省农业科学院生物技术与种质资源研究所/云南省农业生物技术重点实验室/农业农村部西南作物基因资源与种质创制重点实验室,昆明650205;*通讯作者:650205czquan-99@163.com)
水稻白叶枯病(bacterial blight)是世界范围内最严重的水稻细菌性病害,也是我国水稻三大病害之一。实践证明,水稻白叶枯病没有特效的化学防治试剂,而种植抗病品种是最为经济、安全和有效的防治措施。为了在水稻白叶枯病害常发区获得理想的水稻产量,需要不断培育携有不同抗白叶枯病基因的品种,尤其是对广谱抗病基因的发掘与利用,以抵御白叶枯病菌的变异[1]。
野生稻是现代栽培稻的始祖,由于长期处于野生状态,经受了各种灾害和不良环境的自然选择,蕴含了大量的优良基因,是天然的基因宝库[2]。全世界稻属中有22 个野生种,从中发掘可利用的抗病新基因并进行育种利用,是近年来研究的热点。迄今从野生稻中克隆的抗白叶枯病基因有 3 个,即 Xa21[3]、Xa23[4]和 Xa27(t)[5]。 另 外 ,Xa29(t)[6]、Xa30(t)[7]、Xa32(t)[8]、xa32(t)[9]和Xa35(t)[10]等5 个抗白叶枯病基因分别来自药用野生稻、普通野生稻、澳洲野生稻、疣粒野生稻和小粒野生稻。这5 个抗白叶枯病基因已被定位在不同的染色体上,但目前尚未被克隆。可见,野生稻中的抗白叶枯病基因的发掘应用还处于初级阶段,从中开发利用广谱高抗白叶枯病基因的前景广阔,对改良栽培稻抗性、扩宽其遗传基础具有重大意义。
疣粒野生稻是中国现有三种野生稻资源之一,主要分布在云南和海南,拥有许多优良性状,具有很高的利用价值。过去一些研究表明,疣粒野生稻对白叶枯病抗性良好,发现其抗性从高抗到接近免疫[11-12]。然而,程在全等[13]利用 C1、X1、BD8438 和 CN9404 共 4 个菌株鉴定云南疣粒野生稻对白叶枯病的抗性时发现,部分植株感供试菌株。可见,云南疣粒野生稻对白叶枯病菌的抗性并不一致。为了解云南疣粒野生稻对不同白叶枯病小种的抗性,尤其是对近年在云南部分稻区流行的白叶枯病菌的抗性,本研究利用本实验室从2013 年至2017 年间收集的云南不同地区水稻白叶枯病菌株,以及国内外部分标准强致病菌系,对云南疣粒野生稻12 个居群共36 份材料进行了抗性鉴定,以为开发和利用云南疣粒野生稻抗白叶枯病基因提供科学依据。
1 材料与方法
1.1 供试材料和菌株
供试的疣粒野生稻材料取自云南省不同地区的12 个居群,每个居群分别随机采样3 株,共36 份,其详细来源见表1。金刚30 为感病对照材料。所有研究材料均种植于本实验室温室中。
供试水稻白叶枯病菌株:本研究中用到的菌株包括本实验室从2013 年至2017 年间收集的18 个在云南省部分稻作区流行的白叶枯病菌,以及6 个国内外部分标准强致病菌系,共24 个,详细信息见表2。

表2 不同白叶枯病菌详细信息

表3 接种水稻白叶枯病发病程度分级标准
1.2 供试材料的培养
对选取的疣粒野生稻材料进行割茬处理,分栽到直径为20 cm、高为15 cm 的花盆中,每份材料分栽24盆,进行编号,浇透水,放置在温室阴凉处,每隔1 周浇1 次水,待植株长至孕穗期时进行接种鉴定。同时播种金刚30 种子于24 个直径为21 cm、高为21 cm 的花盆中,进行编号,放置在温室中进行正常水肥培养至孕穗期。将各材料相同编号的花盆放在一起,利于接种同一菌株。
1.3 抗病性鉴定
本研究采用剪叶接种的方法进行鉴定。接种前将在-20℃保存的菌种于NA 培养基上复壮,28℃~30℃培养48 h 后,用无菌水洗脱菌株,悬浮均匀,将菌悬液浓度调节为 3×108cfu/mL(OD600=0.5),用于接种试验。手术剪灭菌后,蘸取制备好的病菌悬浮液,将供试材料叶片叶尖剪去1~3 cm,每株植株接种3 片以上叶片,以感病水稻金刚30 作为对照,并做好标记。接种21 d 左右当参试材料的病情发展趋于稳定时,量取病斑长度,鉴定供试植株的抗病性,同时进行拍照。
1.4 数据分析
整理测量得到的数据,抗性分级参考表3。根据对照材料金刚30 的发病等级,分析水稻白叶枯病菌的致病力,并按照抗性分级标准对供试植株进行抗感分级,并利用Microsoft Excel 2010 进行常规的数据统计,采用SPSS 19.0 进行系统聚类分析疣粒野生稻的抗菌谱,以及计算众数值、最小值、最大值、求和值、均值和均值标准差,进行疣粒野生稻对白叶枯病抗性的量化分析,其中众数值是指一组数据中,出现次数最多的标志值,即为最普遍、最常见的标志值,可了解疣粒野生稻哪种抗病类型最普遍;最小值是指样本中取值最小的数据、最大值是指样本中取值最大的数据,根据最小值和最大值,可了解疣粒野生稻抗病类型的范围;求和值是指一组数据所有取值的总和,均值表示某变量所有取值的集中趋势或平均水平,根据求和值和均值,有利于挑选出抗性最优的参试材料;均值标准差(Standard Error of Mean, SE.mean)是描述这些样本均值与总体均值之间平均差异的统计量,可分析样本间抗性差异程度。
表4 感病对照材料金刚30 接菌情况
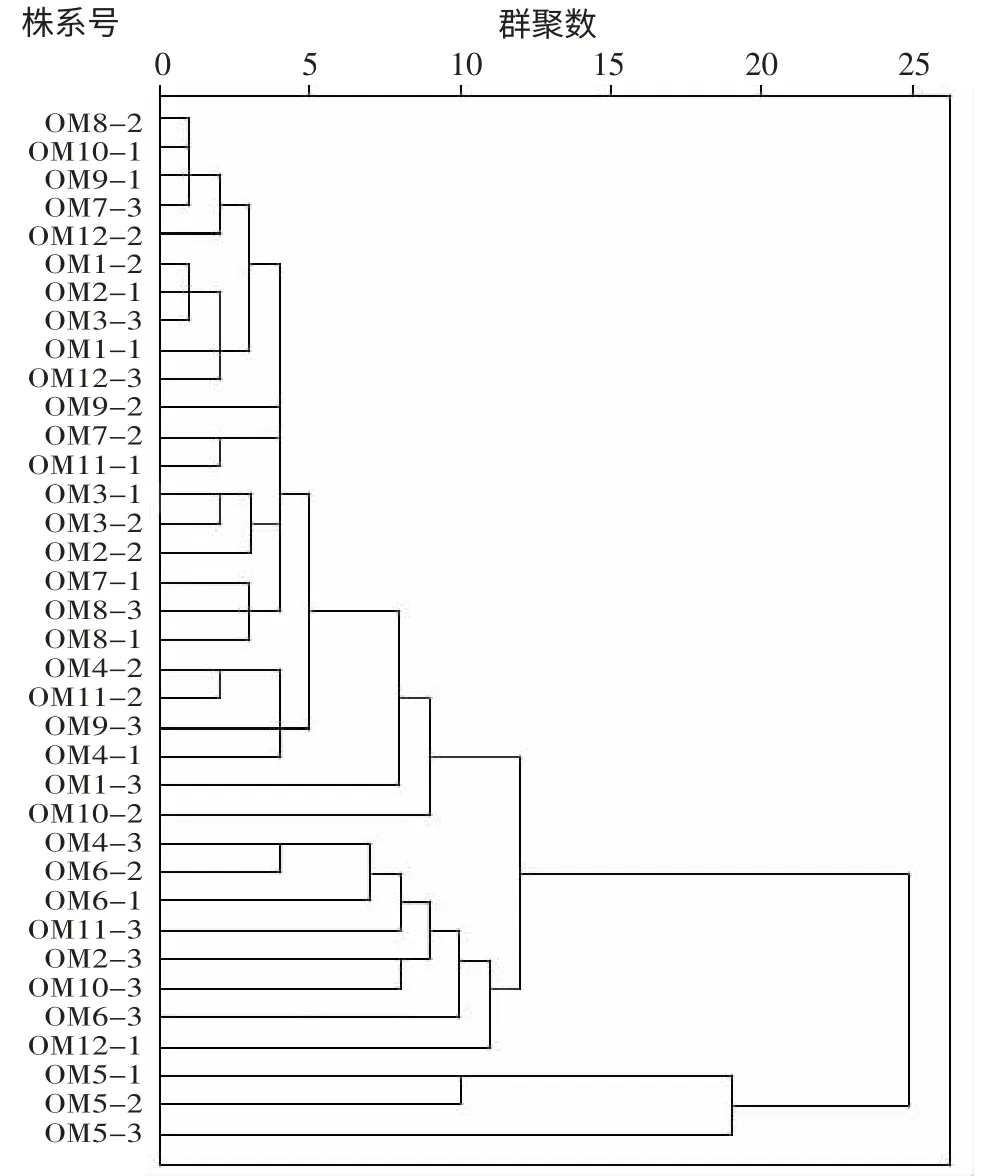
图1 36 份疣粒野生稻对白叶枯病菌抗性结果聚类分析
2 结果与分析
2.1 接种菌株致病力
根据感病对照材料金刚30 的病斑长度,对其进行抗感等级划分,由等级划分判断接种菌株致病力。接种后14~21 d,金刚30 的发病病情趋于稳定。接种后21 d调查发现,金刚30 接种24 个白叶枯病菌的植株病斑长度都超过了20 cm(表4),叶片枯黄,而未接种病菌的植株叶片没有发生任何变化,说明用于接种的白叶枯病病菌致病力没有丧失,可用于接种参试材料。
2.2 云南疣粒野生稻对白叶枯病的抗性反应
疣粒野生稻接种后第21 d,出现了3 类症状5 种病斑。第一类症状为急性症状,像开水烫伤一样,病斑有1 种,呈灰绿色。第二类症状为典型症状,病斑有4种:第1 种呈黄白色,第2 种呈淡黄白色,这两种病斑部分病菌都向下蔓延,病斑往往较长;第3 种呈黄色,少数病菌向下蔓延,病斑稍短;第4 种呈褐色,病菌不蔓延,病斑长度一般为0.00~0.30 cm。第三类无病症,症状与接种清水一样,只有一个割伤的伤口痕迹。参试的材料中大部分材料表现第二类第4 种病斑。量取病斑长度进行统计分析,根据抗性反应的鉴定标准,将36 份云南疣粒野生稻对供试菌株的抗性反应进行分级,结果显示,绝大部分野生稻对参试的24 个菌株的抗性表型基本都处于高抗到免疫程度,抗性表现良好(表5)。
2.3 云南疣粒野生稻对多菌系的抗性分析
通过系统聚类法分析36 份疣粒野生稻的抗谱,可分为抗谱宽和抗谱窄两大类,除居群5 中的3 份材料抗谱较窄之外,其余为抗谱宽类型,即相对于OM5-1、OM5-2 和OM5-3,其余33 份参试疣粒野生稻抗谱都较宽(图 1)。
根据量取的每份疣粒野生稻的病斑长度,统计参试材料分别对24 个菌株抗性反应的病斑长度的众数值、极小值、极大值、求和值、均值及均值标准差,统计结果见表6。从表6 可见,众数值最大为1.00 cm(高抗),最小为 0.00 cm(免疫),除 OM4-3、OM6-1 和OM6-2 这3 份材料众数值稍大外,大部分的参试植株众数值都为0.00 cm,说明对24 个菌株的抗性表现免疫的材料最为普遍。从最小值和最大值可知,参试材料的抗病范围有4 种,第1 种是最小值到最大值在0.00~1.40 cm 之间(I~HR),第 2 种在 0.00~3.00 cm 之间(I~R),第 3 种在 0.00~6.00 cm 之间(I~MR),第 4 种在0.00~9.00 cm 之间(I~MS),其中第 1 种类型最多(占比44.44%),第4 种类型最少(占比仅2.78%)。从均值可看出,OM5-1 抗性最差,其平均病斑最长;18 份参试材料的均值小于等于0.20 cm(I),抗性较好,进一步从求和值可看出,这18 份材料中OM2-1、OM8-2 和OM7-3的抗性表现特别突出,它们对24 个菌株抗性反应的病斑长度相加起来的总和小于等于1.50 cm,而OM2-1的求和值最小,仅为0.68 cm,说明OM2-1 的抗性最优。从标准差可看出,OM2-1 的标准差亦最小,说明OM2-1 对24 个菌株的抗性反应差异最小,结合表5 可知,该份材料除对XOO5 菌株表现为高抗之外,对其余菌株的抗性反应都为免疫,表明OM2-1 的抗谱最为广泛;反之,OM5-1 的标准差最大,说明 OM5-1 对 24 个菌株的抗性反应差异最大,抗谱最窄。

表5 疣粒野生稻对白叶枯病菌的抗感反应
综合以上结果说明,参试的疣粒野生稻对白叶枯病菌的整体抗性水平较好,44.44%野生稻对参试菌株表型处于高抗到免疫水平,并且抗病类型为免疫的表型最为普遍;OM5-1、OM5-2 和 OM5-3 这 3 份材料抗谱较窄,尤其是OM5-1,其余33 份参试材料抗谱都较宽,特别是OM2-1。
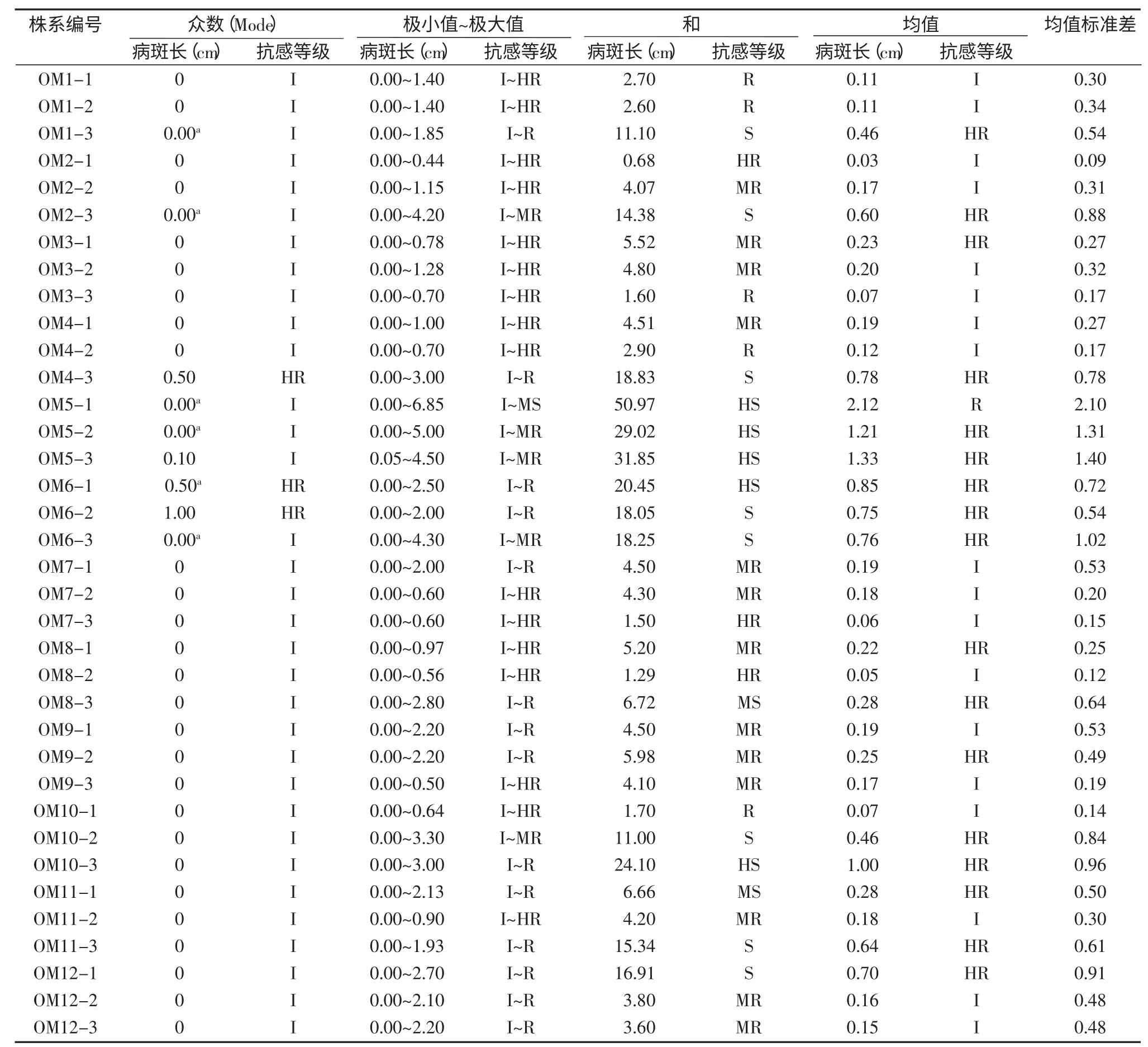
表6 参试材料对24 个菌株抗性反应的量化指标
2.4 云南疣粒野生稻对单一菌株的抗性分析
统计疣粒野生稻对单一菌株不同抗性反应类型的份数,建立柱状图(图2)。从图2 可知,无论对哪个单一菌株的抗性,I 型和HR 型材料所占比例均较大,除对XOO3 菌株HR 型材料比I 型材料多外,参试材料对其余单一菌株的抗性反应以I 型材料最多,具体表现如下:I 型材料中,免疫XOO3 菌株的材料最少,免疫XOO23 菌株的材料最多;HR 型材料中,高抗XOO23菌株的材料最少,高抗XOO3 菌株的材料最多;R 型材料中,抗XOO3 菌株材料最多,有4 个单一菌株(XOO9、XOO14、XOO23 和 XOO24)对参试材料没有 R类型的抗性反应,即对于这4 个单一菌株的抗性反应而言,R 型材料最少,为0 份;MR 型材料中,中抗XOO2 菌株稍多外,有一半以上的菌株对参试材料没有MR 类型的抗性反应;MS 型材料中,只有1 份参试材料对XOO8 菌株出现MS 类型的抗性反应。以上结果表明,参试的云南疣粒野生稻,除有1 份中感XOO8菌株外,其余参试材料对各单一菌株抗性良好,大多数达到了高抗到免疫的程度。

图2 疣粒野生稻对单一菌株抗性反应
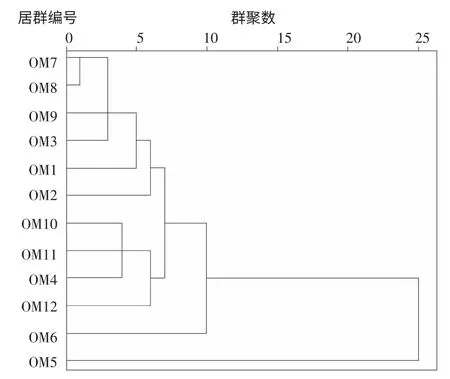
图3 不同居群的疣粒野生稻对白叶枯病菌抗性结果聚类分析
2.5 不同居群的疣粒野生稻抗性比较分析
根据每个居群中3 份植株的病斑求取平均值,依据抗性反应的鉴定标准,统计12 个居群对参试菌株的抗性反应,结果见表7。12 个居群对大多数菌株抗性都达到了高抗到免疫程度,根据其抗病特性,进一步进行系统聚类,如图 3 所示,可分为 A、B、C 和 D 四大类,其中 OM5 为 A 类,OM6 为 B 类,OM4、OM10、OM11 和OM12 为 C 类,OM1、OM2、OM3、OM7、OM8 和 OM9 为D 类。结合表7 可知,A 类的抗谱最窄,此类型对参试的白叶枯病菌的抗性表现为中抗到免疫,B 类较A 类抗谱稍宽,对参试白叶枯病菌的抗性表现为抗到免疫,C 类较A 和B 类抗谱更宽,对参试白叶枯病菌的抗性表现为高抗到免疫,D 类抗性程度虽与C 类一致,但对更多的参试菌株具有免疫能力,此类抗谱较C 类更宽,然而在D 类中,OM7 免疫的菌株更多,即OM7 的抗谱最广。
以上结果显示,除OM5 中抗部分参试菌株外,其余居群都是抗参试菌株。从表7 可见,OM5 对XOO2、XOO5、XOO8 和 XOO16 菌株中抗,病斑都在 3.1 cm 以上,其中对XOO8 菌株抗性反应的病斑最长,达4.28 cm,即XOO8 对OM5 具有一定的致病力。
野生稻植株往往是遗传杂合体,个体之间也存在遗传背景差异。本研究以标准差的大小作为考核指标,评估接种同一菌株同一居群的3 份野生稻抗病能力的差异,标准差大,说明3 株间的病斑长度差异大,则抗病能力差异大,反之亦然。从表7 可看出,除OM3 外,其余疣粒野生稻居群对菌株抗性反应的病斑长度标准差都有超过 1.0 的,其中,OM1、OM2、OM7、OM8、OM9、OM11 对1 个菌株的抗性反应标准差超过1.0;OM4 和OM6 对 2 个菌株的标准差超过 1.0;OM5、OM10 和OM12 分别对10 个、7 个和6 个参试菌株的标准差超过1.0。由此说明,OM3 纯合度高,植株之间抗病差异小,而其余11 个居群具有一定的杂合度,尤其OM5、OM10 和OM12,它们个体之间抗病能力差异较大,这3个居群杂合度相对较高。
综上所述,云南12 个居群的疣粒野生稻对大多数白叶枯病菌抗性表现较好,除OM5 和OM6 之外,其余居群对参试的24 个菌株抗性都达到了高抗到免疫程度,特别是耿马孟定(OM7)野生稻的抗性较其他居群好,景洪景讷(OM5)对在云南会泽流行的菌株(XOO8)抗性不强。同时,本研究也表明了大部分云南疣粒野生稻居群杂合度高,同一居群不同植株对白叶枯病的抗性差异大。
3 结论与讨论
3.1 云南疣粒野生稻是宝贵的抗白叶枯病资源
根据分析结果可知,无论以植株为单位还是以居群为单位,大部分疣粒野生稻对白叶枯病高抗甚至免疫,说明云南大部分疣粒野生稻携有丰富的优良白叶枯病抗性基因。特别是OM2-1 在抗性和抗谱方面都较其它供试材料好,该材料可能含有1 个甚至多个高抗白叶枯病基因。这些丰富的基因资源对遗传研究和品种改良具有重要的价值。本研究还发现,少部分疣粒野生稻中感个别菌株,这与程在全等[13]的研究结果一致,但据其报道的感病疣粒野生稻病斑长度最长为3.2
cm,若按本文的评价标准应为中抗,本文鉴定的最长平均病斑为6.85 cm,即到目前为止,未见相关文献报道疣粒野生稻病斑特别长的,为此,笔者继续同等条件种植培养管理,进行接种,发现该份疣粒野生稻的病斑长度变化不大,推测温室种植可能使疣粒野生稻自身的抗病能力下降,后续还需将该材料种植于室外,经过多年种植之后再进行接种鉴定,了解其是否感病。
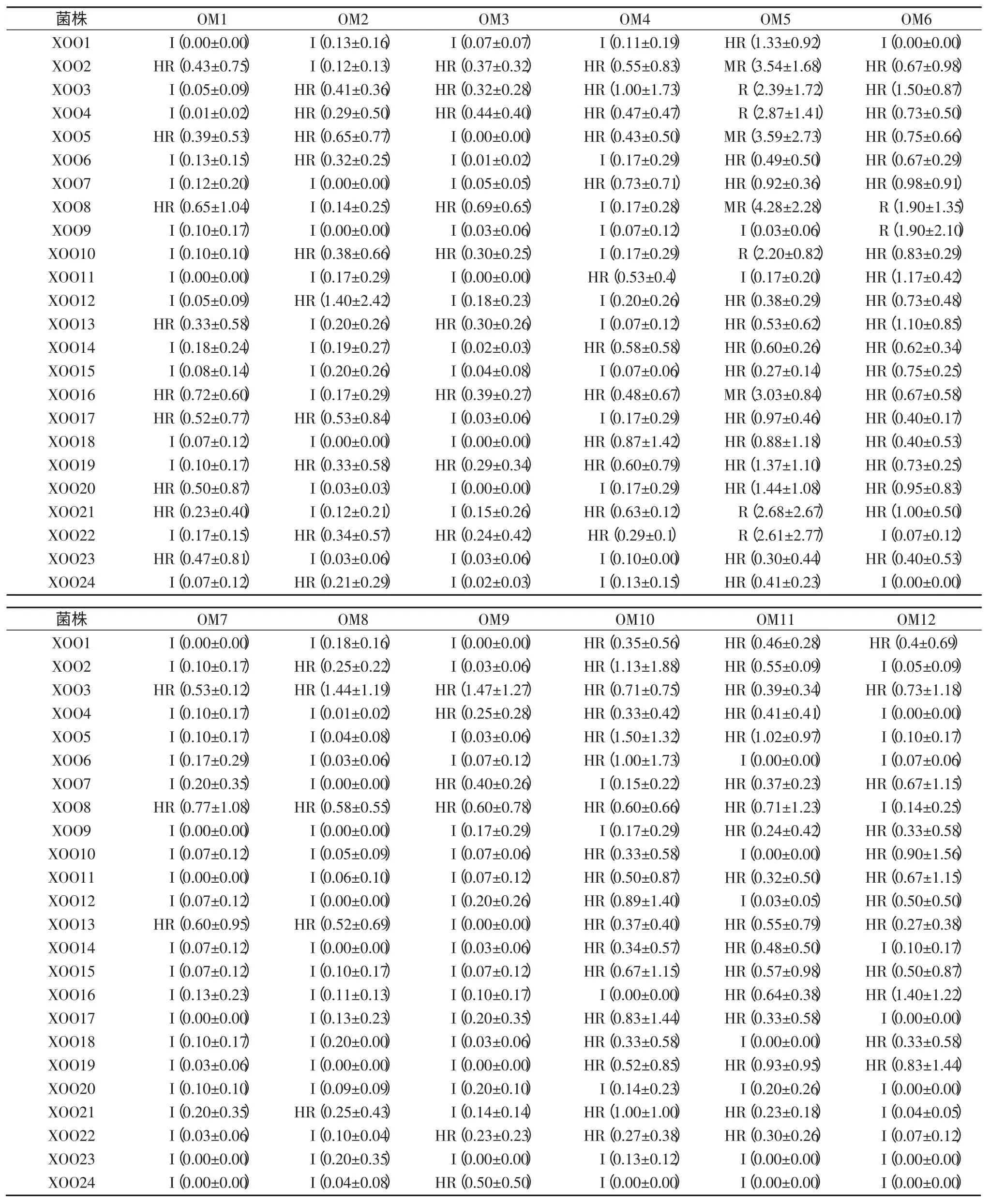
表7 云南疣粒野生稻不同居群对24 个菌株的抗感反应
3.2 评价疣粒野生稻抗性存在的问题
由于寄主与病原菌之间存在互作关系,互作关系为亲和关系时,植物寄主表现感病,互作关系为非亲和关系时,植物寄主表现抗病[14]。所以,评价寄主抗性时,应采用不同的生理小种进行鉴定,以便最大限度鉴定出抗相应小种的抗源,同时能较清楚抗源的抗谱,为充分发掘抗病基因奠定基础。野生稻含有优良的抗性基因,为了筛选出广谱抗性基因,本研究选用不同的生理小种评价疣粒野生稻的抗性,从中筛选出多份广谱高抗白叶枯病抗源。寄主与病原菌之间还存在协同进化的关系,当一个新的抗病品种大量推广后,病菌方面就有相应的新小种产生和流行,并导致抗病品种的抗性“丧失”,因而监测抗病品种的抗性也必须坚持不懈地进行[15]。疣粒野生稻对过去的菌株处于高抗到免疫的程度,了解疣粒野生稻是否对最近几年流行的小种具有抗性尤其重要。从本研究结果可见,值得庆幸的是,云南疣粒野生稻对目前在云南流行的小种基本都还处于非亲和关系。
目前,疣粒野生稻的抗性评价标准存在争议。章琦等[12]认为,病斑占叶面积百分率较能反应试材的实际抗性水平,然而疣粒野生稻同一株叶片长短差异较大,短的才5 cm 左右,长的有20 cm 左右,若病斑都是2 cm,对于短的叶片来说就是高感,对于长的叶片就是中抗,那很难判定其抗感性。程在全等[13]以病斑长度为3 cm 作为抗感界限评价疣粒野生稻抗性,而其文中的病斑最长才3.2 cm,就被认为感病。所以,笔者认为,疣粒野生稻抗性评价标准还是应以国际分级标准更为合理,即病斑长度小于0.2 cm 为免疫,0.2~1.5 cm 为高抗,1.6~3.0 cm 为抗,3.1~6.0 cm 为中抗,6.1~9.0 cm 为中感,9.1~20.0 cm 为感,大于 20.0 cm 为高感,同时应在对照品种的病情发展趋于稳定时进行调查。然后,根据相应结果优先选取高抗的材料用于遗传研究和品种改良,从而最大限度避免以上存在的问题。
本研究发现,云南疣粒野生稻对白叶枯病的抗性与地理位置无关,同一居群的材料有高抗甚至免疫的材料,也存在抗性稍差的材料。其余野生稻,如普通野生稻也存在类似情况[12,16],可能因为大多数的野生稻柱头大而外露,异交结实率较高,造成同一地点采集的材料并不是1 个抗性纯合体[12]。这提示我们,在野生稻接种鉴定时,同一居群应选取3 株以上进行考察,或首先应对参试材料进行亲缘关系分析,分类之后再开展抗性鉴定试验,从而充分的发掘出新的抗源。

