2型猪链球菌河南株的生物学特性研究
王治方,徐引弟,张青娴,朱文豪,焦文强,李海利,许 峰,王克领,张 彬,娄治国
(1.河南省农业科学院畜牧兽医研究所,河南 郑州 450002;2.河南省畜禽繁育与营养调控重点实验室,河南 郑州 450002)
猪链球菌病是由猪链球菌引起的一类急性、热性传染性疾病,属于国家规定的二类动物传染病,临床上主要引起猪的败血症、脑膜炎、关节炎等病症,是世界范围内养猪业最常见的细菌性疾病之一[1]。
猪链球菌血清型较多,基于猪链球菌荚膜多糖抗原的不同,猪链球菌一度被分为35个血清型,分别是1~34和1/2型。2005年,Hill等[2]进一步验证,32型和34型并不是猪链球菌,猪链球菌划分为 33个血清型(1/2型、1~31型、33型);而有最新的研究报告指出,血清型20型、22型、26型和33型属于其他新的物种,应该从猪链球菌中分离出来[3]。因此,目前认为猪链球菌有29个血清型,其中猪链球菌2型毒力最强、流行最广,能够引起人类的感染发病和死亡,是国内防控猪链球菌病的主要血清型之一,在畜牧业和公共卫生方面意义重大。
近年来,随着我国养猪业集约、规模化的发展,猪链球菌病的发生呈现上升趋势,而且经常作为主要病原继发于猪伪狂犬病、猪繁殖与呼吸综合征、猪圆环病毒病等病毒性疾病,给猪场临床疾病诊疗控制带来不小的困难,给养猪企业造成不小的经济损失。试验于2019年5—8月在河南省农业科学院畜牧所动物传染病研究室进行,通过对河南省豫东某规模化猪场疑似猪链球菌病例采集病料,进行实验室的分离纯化、病原及血清型鉴定为2型猪链球菌,同时对该株猪链球菌做了动物试验、药敏试验、毒力基因和耐药基因检测研究,旨在为2型猪链球菌病的防控提供参考依据。
1 材料
1.1 病料
2019年5月河南省豫东某规模化猪场保育猪群发生呼吸困难、关节肿大,部分猪只有神经症状的病例,剖检濒死期病猪,采集脑、肺脏、肝脏、血液和关节液等病料。
1.2 主要试剂
胰蛋白大豆琼脂(TSA)和胰蛋白大豆肉汤(TSB)购自美国Difco公司;新生牛血清购自郑州益康生物工程有限公司;革兰氏染液试剂盒购自珠海贝索生物技术有限公司;抗生素药敏纸片购自杭州天和微生物试剂有限公司;微生物微量生化鉴定管购自杭州天和微生物试剂有限公司;微生物DNA提取试剂盒、DL 2 000 DNA Marker、Lording buffer、2×Taq Master Mix等均购自宝生物(大连)工程有限公司;相关引物均由生工生物工程(上海)股份有限公司合成。
1.3 试验动物
体重20 g左右的健康小白鼠5只,购自郑州大学实验动物中心。
2 方法
2.1 病原的分离、纯化
无菌采集的脑、肺脏、肝脏、血液和关节液分别划线接种于TSA平板(含5%的新生牛血清),放置于培养箱37℃培养18~24 h后,挑选可疑菌落纯化、革兰氏染色镜检。
2.2 可疑菌PCR检测和血清型检测鉴定
2.2.1 引物设计 通过聚合酶链式反应(PCR)对纯化好的可疑菌株进行鉴定和血清型分型鉴定。参照文献[4-6]设计合成猪链球菌通用引物和33种血清型引物,引物序列和扩增片段长度见表1。

表1 猪链球菌PCR分型引物序列及相关信息

表1 猪链球菌PCR分型引物序列及相关信息(续)
2.2.2 PCR检测鉴定 DNA提取:取上述TSB液体培养物1 mL于离心管中,10 000 r/min离心5 min,弃上清液收集菌体沉淀;按照DNA提取试剂盒说明书提取菌体DNA,以提取可疑菌的DNA为模板,进行PCR扩增鉴定。
PCR 反应体系(25 μL):2×Taq Master Mix 13 μL,上、下游引物各 1 μL,ddH2O 8 μL,模板 DNA 2 μL。PCR反应条件:95℃ 5 min;95℃ 30 s,56℃ 30 s,72 ℃30 s,40个循环;72℃延伸5 min;4℃保存备用。
电泳:取10 μL PCR扩增产物于1%的琼脂糖凝胶电泳跑胶检测,紫外透射分析仪观察结果,比照DL 2 000 DNA Marker确定条带大小。阳性PCR扩增产物送生工生物工程(上海)股份有限公司测序,测序结果进行BLAST软件比对。
2.3 毒力基因检测
2.3.1 引物设计 参考文献[7-9]设计合成了3对猪链球菌毒力基因(胞外因子epf基因、溶血素sly基因、溶菌酶释放蛋白mrp基因)引物,各对引物序列和扩增片段长度见表2。
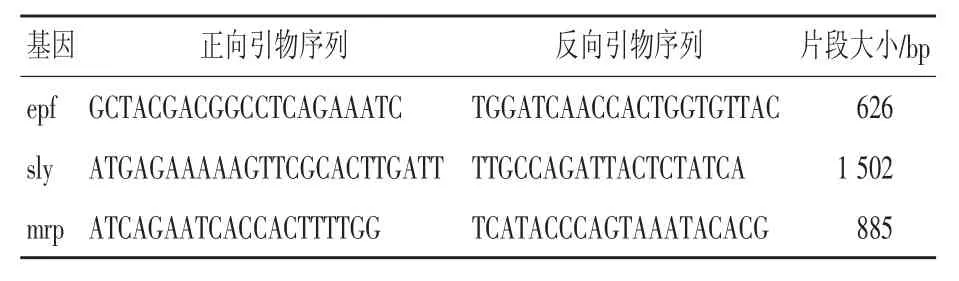
表2 毒力基因引物序列及相关信息
2.3.2 DNA提取及毒力基因检测 DNA提取方法同上述2.2.2。
PCR 反应体系(25 μL):2×Taq Master Mix 13 μL,上、下游引物各 1 μL,ddH2O 8 μL,模板 DNA 2 μL。PCR反应条件:95℃预变性5 min,进入循环:95℃1 min,57℃ 1 min,72℃ 30 s,共35个循环,最后72℃延伸10 min,PCR产物4℃保存备用。电泳:取10 μL PCR扩增产物于1%的琼脂糖凝胶电泳跑胶检测,紫外透射分析仪观察结果,比照DL 2 000 DNA Marker确定条带大小。
2.4 致病性试验
挑选纯化好的单个菌落接种于TSB(含5%的新生牛血清)液体培养基中,放置于培养箱37℃培养18 h后,计数并用生理盐水稀释菌数约为1×108CFU/mL,腹腔注射小白鼠3只,0.2 mL/只,作为试验组;同时准备小白鼠2只腹腔注射生理盐水0.2 mL/只,作为空白对照组。接种后观察记录每组发病情况,并对发病小鼠进行细菌分离鉴定。
2.5 药物敏感性试验
药敏试验采用琼脂扩散法(K-B法)[10-12]。挑取已纯化过的TSA平板上若干单个菌落,置于0.9%灭菌生理盐水中,制成菌悬液,浓度为0.5麦氏单位(比色仪比色),取200 μL用灭菌棉拭子均匀涂抹于TSA平板(含5%的新生牛血清)上,涂抹4个平板。挑取临床上常用的抗生素药敏片,用灭菌镊子把药敏片均匀贴在涂有菌液的平板上,于37℃培养24 h,取出观察记录药敏片抑菌圈直径,判断标准参照美国临床实验室标准化委员会(NCCLS)2005版。
2.6 耐药基因检测
2.6.1 引物设计 参考文献[13-15],设计5大类24个耐药基因包括β-内酰胺类(blaTEM、blaOXA-1、blaCTX-M-2、blaSHV、blaIMP-1、blaDHA-1)、氨基糖甙类[aadA1、aadA2、strA、strB、aadB、aacC2、aac(3)-IV、aphA1]、四环素类[tet(A)、tet(B)、tet(C)、tet(D)、tet(G)]、喹诺酮类(gyrA、parC) 和磺胺类(sul1、sul2、sul3)基因的引物,用于本菌株的耐药基因的检测扩增,5大类24对耐药基因引物序列及相关信息见表3。
2.6.2 耐药基因PCR扩增 模板DNA的提取方法同上述2.2.2。用表3中24对耐药基因的引物进行扩增检测。
反应体系为 25 μL:2×Taq Mix 12.5 μL,10 μM/L 上下游引物各 1 μL,模板 DNA 1 μL,加ddH2O 至25 μL。反应条件:95 ℃预变性 5 min,进入循环:95℃ 1 min,57 ℃ 1 min,72 ℃ 30 s,共 35个循环,最后72℃延伸10 min,PCR产物4℃保存。取10 μL扩增产物电泳,紫外光下观察结果,阳性产物测序。

表3 不同种类抗生素耐药基因的引物序列及相关信息
3 结果
3.1 细菌分离培养纯化
在接种病死猪脑组织的TSA平板(含5%的新生牛血清)上,形成均一的表面光滑湿润、边缘整齐、圆形的半透明、略带蓝色荧光的小菌落;其他样品接种的TSA平板(含5%的新生牛血清)上未见可疑细菌生长。挑取单个菌落革兰氏染色镜检为革兰氏阳性,菌体呈球形或卵圆形,呈单个、成对或短链存在(图1)。
3.2 菌株鉴定和血清型检测
通过用猪链球菌通用引物对分离菌株进行PCR鉴定,结果分离菌株和猪链球菌标准株均在500~750 bp之间的689 bp出现目的条带(图2),与预期片段一致。
通过用33对猪链球菌血清型引物对分离菌株进行血清型分型鉴定,结果分离菌株在猪链球菌2型引物扩增阳性,出现目的条带557 bp(图3、图4),测序与猪链球菌LSM102株(GenBank No.:CP016175.1)99%同源,证明所分离菌株为血清型2型猪链球菌。
3.3 毒力基因
用3对毒力基因引物对分离菌株进行PCR扩增检测,结果分别扩增出626 bp、885 bp、1 502 bp大小3个片段,结果见图5,证明该猪链球菌分离菌株携带有胞外因子(epf)、溶菌酶释放蛋白(mrp)和溶血素(sly)毒力基因。
3.4 致病性试验结果
在攻毒15 h后,试验组3只小白鼠相继发病,先后出现转圈、共济失调及抽搐等症状,攻毒24 h后试验组3只小白鼠相继死亡,立即剖检用心血、肝脏触片,革兰氏染色镜检,均发现有革兰氏阳性球菌,呈单个、短链状排列。同时无菌采集试验组死亡小白鼠的心血、肝脏接种TSA平板(含5%的新生牛血清,1/10万的NAD),37℃培养18 h后,经鉴定,均获得和接种菌株相一致的单一细菌。攻毒48 h后,对照组健康,未见任何临床症状。
3.5 药敏结果
挑选5类18种抗生素对猪链球菌分离菌株作了药物敏感性试验,参照药敏片说明书判断敏感性,结果见表4。药敏结果显示,该株猪链球菌对β-内酰胺类(头孢噻呋、头孢他啶、阿莫西林、氨苄西林、青霉素)、喹诺酮类(左氟沙星、氧氟沙星、恩诺沙星、环丙沙星)、磺胺类(复方新诺明)和氨基糖苷类的壮观霉素敏感;对氨基糖苷类(卡那霉素、阿米卡星)、大环内酯类(阿奇霉素、替米考星)和四环素类(强力霉素、四环素、土霉素)耐药。
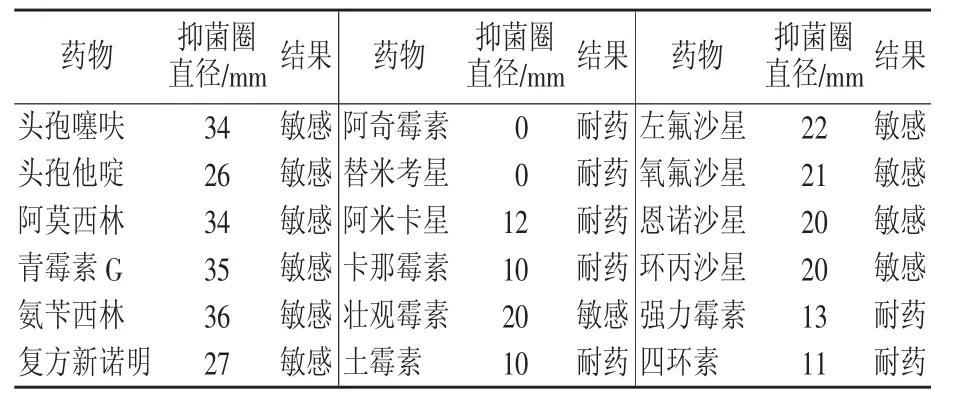
表4 药敏试验结果
3.6 耐药基因检测
用24对耐药基因引物对该猪链球菌分离菌株进行耐药基因扩增检测,结果blaTEM和strB基因扩增出现目的条带(857 bp和509 bp),与预期条带大小一致(图6),证明该猪链球菌分离株携带有β内酰胺类耐药基因blaTEM和氨基糖苷类耐药基因strB。
4 讨论
猪链球菌病仍是养猪行业的重要细菌性疾病,常常单独发生或作为继发病原继发感染于病毒病之后,给养猪行业造成不小的经济损失。猪链球菌血清型较多,其中血清型1/2、1型、2型、7型、9型致病性较强[4,16],临床检出率较高,常常引起猪的败血症、脑膜炎、关节炎及心内膜炎等病症,2型猪链球菌病更能引起人的感染发病或死亡。本试验从病死猪脑组织中分离得到一株猪链球菌,通过血清型分型鉴定和测序比对,证实该临床分离菌株为2型猪链球菌。
猪链球菌菌株的致病性强弱与其携带的毒力基因密切相关,一般把胞外因子(epf)、溶菌酶释放蛋白(mrp)、溶血素(sly)作为猪链球菌毒力指示蛋白用来区分菌株毒力的强弱,epf+/mrp+/sly+常被认为与高致病性菌株相关[3,17]。通过毒力基因检测结果表明,该2型猪链球菌分离菌株同时携带胞外因子(epf)、溶菌酶释放蛋白(mrp)和溶血素(sly)3种毒力基因,证明该菌株是高致病性菌株,致病性试验结果再次印证了该菌株的毒力。
通过药敏试验结果表明,该株2型猪链球菌对头孢噻呋、头孢他啶、阿莫西林、氨苄西林、青霉素、复方新诺明、左氟沙星、氧氟沙星、恩诺沙星、环丙沙星、壮观霉素敏感,而对卡那霉素、阿米卡星、阿奇霉素、替米考星、四环素、强力霉素、土霉素表现出高度耐药,说明该株猪链球菌对大部分氨基糖苷类、大环内酯类和四环素类药物产生较为广泛的耐药性。与国内的有关研究报道[18-19],国内猪链球菌对环丙沙星、阿奇霉素、四环素、磺胺类等药物耐药严重有一定不同。治疗该株猪链球菌引发疾病首选药物还是β-内酰胺类药物,考虑到临床有脑炎神经症状,应当配合磺胺类药物联合使用,该发病猪场临床实践用药效果证实了联合用药效果。对该株猪链球菌进行24个耐药基因检测,只检测出β-内酰胺类的blaTEM基因和氨基糖苷类的strB基因,对比表型耐药结果,再次说明耐药菌株耐药基因的检测结果和表型耐药结果的不一定符合性,进一步说明细菌耐药性产生机理的复杂性,需要进一步进行深入研究和探索。
喝咖啡可延年益寿
【美联社美国芝加哥7月2日电】新的研究显示,咖啡可能有助于延长寿命,即使是那些每天饮用至少8杯的人也是如此。
在一项对英国近50万名成年人进行的研究中发现,喝咖啡者的死亡风险比坚决不喝者略低。
这种延年益寿的效果对于速溶、研磨和脱因的咖啡来说都有效。美国进行的研究也是相同效果。这是第一次有大型研究表明,即使对于那些有基因缺陷、影响到机体摄取咖啡因的人来说,喝咖啡也是有好处的。
总体而言,在为期10年的跟踪研究中,喝咖啡者比坚决不喝者的死亡风险低10%到15%。
并未参与这项研究的美国塔夫茨大学营养专家艾丽斯·利希滕斯坦说,这个结果并不能证明咖啡壶就是“不老泉”,也不应成为不喝咖啡者开始喝咖啡的理由。但她说,这些结果印证了此前的研究,并给喝咖啡者提供了额外的信心。
利希滕斯坦说:“很难相信我们那么喜欢的一个东西对我们来说有这么大的好处。或者说,至少不是坏事。”
这项研究结果今天发表在《美国医学会杂志·内科学卷》双周刊上。
目前尚不完全清楚喝咖啡是如何影响寿命的。
研究负责人、美国国家癌症研究所研究员埃丽卡·洛夫特菲尔德说,咖啡含有1 000多种化合物,其中包括有助于保护细胞免受损伤的抗氧化物。
其他研究表明,咖啡中的物质可以减轻炎症并改善人体对胰岛素的用法,从而降低患糖尿病的几率。
咖啡因可导致血压短期升高。一些较小规模的研究表明,咖啡因可能与高血压有关。不过,在英国进行的这项研究表明,喝咖啡者并不比不喝者在心脏病和其他与血压有关的疾病方面风险更高。
和以前的研究一样,喝咖啡者比不喝咖啡者更有可能饮酒和抽烟,但即使研究人员考虑了这些因素,喝咖啡似乎也能抵消掉这些因素。
(转自 参考消息[N],2018-07-04)

