小麦吸浆虫保幼激素酯酶和保幼激素环氧水解酶基因的克隆及在滞育和变态发育过程中的表达动态
王晶晶, 梁婷婷, 成卫宁,*, 朱克岩
(1. 西北农林科技大学, 农业部西北黄土高原作物有害生物综合治理重点实验室, 陕西杨凌 712100; 2. Department of Entomology, Texas A&M University, Texas 77843, USA)
保幼激素(juvenile hormone, JH)是最重要的一类昆虫激素,不仅具有调控昆虫发育和翅型分化(Ayoadeetal., 1999; Zhaoetal., 2017)、阻止幼虫变态(Riddifordetal., 2010; Jindraetal., 2013)、促进卵子成熟等功能(Riddiford, 2012; Royetal., 2018),对滞育也具有重要的调节作用。滞育是昆虫抵御不良环境,延续种族发展的重要生态对策。大量研究表明,不仅海藻糖、山梨醇、甘油三酯等化学物质在昆虫滞育前后发生变化(朱芬等, 2008; 刘洋等, 2016),与滞育维持和滞育后的发育恢复相关,JH在幼虫滞育的诱导和维持(Yin and Chippendale, 1973; Yagi and Akaike, 1976; Sieber and Benz, 1977; Eizaguirreetal., 1998, 2005; Munyiri and Ishikawa, 2004; Jiangetal., 2011)以及成虫滞育的终止过程中也发挥重要作用(Vermuntetal., 1997; Smykaletal., 2014; Liuetal., 2016)。
昆虫血淋巴中JH的滴度是通过合成与代谢共同维持和平衡的(李胜等, 2004),其滴度的精确调控对发挥其功能至关重要。已知的两条JH代谢途径分别由保幼激素酯酶(juvenile hormone esterase, JHE)和保幼激素环氧水解酶(juvenile hormone epoxide hydrolase, JHEH)催化。其中JHE被认为是大多数昆虫中最主要的代谢酶,该酶属于羧酸酯酶(carboxylesterases, COEs)家族,主要分布在昆虫的血淋巴、中肠和脂肪体中,能够高度识别并分解与保幼激素结合蛋白结合的或游离的JH为保幼激素酸,促进或抑制其活性能扰乱昆虫体内的JH水平,影响昆虫蜕皮、化蛹和生殖,使昆虫发育紊乱,丧失生活能力或降低生殖力(Wogulisetal., 2006; 杨文佳等, 2010; EI-Sheikhetal., 2016),从而达到间接杀虫的目的。最近研究发现,在一些昆虫JH代谢中,JHEH与JHE同时发挥作用,甚至比JHE更重要。例如,在烟草天蛾Manducasexta和赤拟谷盗Triboliumcastaneum的幼虫阶段以及褐飞虱Nilaparvatalugens的翅型分化中,JHEH的降解是JH代谢的主要途径(Halarnkaretal., 1993; Tsubotaetal., 2010; Zhaoetal., 2017)。
小麦吸浆虫Sitodiplosismosellana是我国乃至世界小麦生产上最重要的害虫(Miaoetal., 2013; Shrestha and Reddy, 2019)。该虫一年发生1代,每年4月小麦抽穗后成虫盛发并产卵,幼虫孵化后危害正在发育的籽粒,小麦黄熟后3龄老熟幼虫脱离麦穗落入土中,在土壤中结茧进入滞育,直至12月后大部分个体终止滞育并进入滞育后静息期,翌年3月小麦拔节后才恢复发育(王越等, 2015; Chengetal., 2017),即以滞育状态存在长达10个月,属典型的专性幼虫滞育昆虫。前期研究表明,JH在小麦吸浆虫滞育诱导、维持及滞育后静息状态维持中发挥重要作用(Chengetal., 2020),但其滴度的代谢调控是由JHE还是JHEH或者二者共同作用尚不清楚。为探讨小麦吸浆虫滞育和变态发育过程中JH滴度的代谢调控机理,本研究利用RT-PCR和RACE技术克隆小麦吸浆虫JHE和JHEH基因,并利用qPCR技术检测两个基因在滞育和发育进程的表达模式,为明确JH调控因子在小麦吸浆虫生命活动中的功能及利用其打破体内JH代谢平衡控制危害提供参考。
1 材料与方法
1.1 供试昆虫
供试昆虫为小麦吸浆虫生活史中除卵外的所有发育阶段,获得方法如下: 2016年5月上旬,在陕西省周至县小麦吸浆虫发生严重的麦田采集正在灌浆的感虫麦穗,在解剖镜下剥穗分离1和2龄幼虫,虫龄依据虫体大小、颜色和Y型剑骨片区分(Gagne and Doane, 1999);2016年5月下旬大量采集被害麦穗,保存部分3龄麦穗幼虫作为滞育前样本,其余放入西北农林科技大学校内养虫圃(34°16′N, 108°4′E),让老熟幼虫自然落土进入滞育,然后于入土后1个月至翌年2月,每月淘土采集结茧幼虫,翌年3月幼虫破茧恢复活动后至4月上旬采集滞育后发育幼虫,随后依次采集预蛹、初蛹、中蛹、后蛹及雌雄成虫,蛹发育程度依据复眼和翅芽颜色划分(武予清等, 2011)。样本收集后每50(1-2龄幼虫)或20头(1-2龄外的其他虫态)分装于1.5 mL离心管,液氮快速冷冻后-80℃保存备用。
1.2 小麦吸浆虫JHE和JHEH基因cDNA全长序列的克隆
取20头小麦吸浆虫滞育前幼虫,参考RNA Simple Total RNA Kit试剂盒(TIANGEN, 北京)操作说明提取总RNA,用1%琼脂糖凝胶电泳和核酸蛋白测定仪检测后,以1 μg总RNA为模板,按照PrimeScriptTMRT Reagent Kit with gDNA Eraser试剂盒(TaKaRa, 大连)说明书操作,反转录获得cDNA第1链。
根据前期获得的小麦吸浆虫幼虫转录组中JHE和JHEH基因保守区片段,利用Primer Premier 5.0软件设计特异引物(表1)。以获得的cDNA为模板,根据2×Taq Master Mix试剂盒(康为世纪,北京)扩增目的片段,PCR扩增产物用1%琼脂糖凝胶电泳进行检测后,用DNA纯化回收试剂盒(TIANGEN,北京)纯化,然后与pMDTM-19T克隆载体连接,转化到大肠杆菌EscherichiacoliDH5α感受态细胞,接种到含Ampicillin, IPTG和X-Gal的培养基培养。经蓝白斑筛选后,挑取白色菌落扩大培养,最后将鉴定的阳性克隆菌液送往上海英俊公司进行测序,每个基因测定3个阳性克隆。
根据以上获得的JHE和JHEH基因保守区片段序列设计5′和3′ RACE引物(表1)。RACE-PCR扩增反应按照3′ Full RACE Core Set with PrimerScriptTMRTase和5′ Full RACE Kit with TAP(TaKaRa, 大连)试剂盒操说明进行。其中5′RACE Outer和Inner扩增程序: 94℃预变性5 min; 94℃变性40 s, 54℃退火40 s, 72℃延伸40 s, 32个循环;72℃延伸7 min。3′RACE Outer 扩增程序: 94℃ 3 min; 94℃ 30 s, 55℃ 30 s, 72℃ 90 s, 25个循环;72℃ 10 min; Inner 扩增程序同Outer PCR(除循环数为35外)。 PCR产物按照上述步骤经过电泳检测、连接、转化和测序验证后,应用DNAMAN 6.0软件将获得的中间序列及5′和3′末端序列进行组装,然后根据拼接序列设计引物(表1)进行 PCR扩增。反应体系(25 μL): 2×Taq MasterMix 12.5 μL,上下游引物(10 μmol/L)各1 μL, cDNA模板1.5 μL, ddH2O 9 μL。扩增程序: 94℃预变性7 min; 94℃变性 30 s, 58℃退火 30 s, 72℃ 延伸30 s, 35个循环;72℃ 终延伸5 min。反应结束后对扩增产物进行克隆和测序验证。
1.3 序列分析和系统树构建
利用ORF Finder在线工具(http:∥www.ncbi.nlm.nih.gov/gorf/gorf.html)对克隆获得的小麦吸浆虫JHE和JHEH基因进行开放阅读框鉴定;编码蛋白的分子量和等电点应用ExPASy数据库(http:∥www.expasy.org/Protparam)进行预测,使用SignalP 5.0软件(http:∥www.cbs.dtu.dk/services/SignalP/)进行信号肽预测,根据已报道昆虫JHE(Wardetal., 1992; Kamita and Hammock, 2010)和JHEH序列(Zhangetal., 2005)推导目标蛋白特异保守模块;氨基酸序列一致性分析采用Blastp软件(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)。使用MEGA 6.0软件中的邻接法(neighbor-joining method, NJ method),进行1 000次bootstrap构建系统发育进化树。
1.4 小麦吸浆虫JHE和JHEH基因在滞育和变态发育进程中的mRNA表达分析
按照1.2节中方法分别提取小麦吸浆虫滞育不同时期3龄幼虫及不同发育阶段(1-2龄幼虫、预蛹、初蛹、中蛹和后蛹以及雌雄成虫)样本总RNA,并反转录成cDNA,其中1龄和2龄幼虫每处理分别用200和100头试虫,其他各阶段为20头。每处理重复3次。
以合成的cDNA为模板,按照SYBR Premix EX TaqTMII(TaKaRa, 大连)试剂盒说明书, 在ABI7500实时荧光定量PCR系统上检测JHE和JHEH基因在不同滞育和发育阶段样本中mRNA的转录水平。JHE和JHEH及内参基因GAPDH(GenBank登录号: KR733066)定量引物见表1。qPCR反应体系(20 μL): 2×SYBR Green Premix EX TaqTMII 10 μL, cDNA模板2.0 μL, 上下游引物(10 μmol/L)各0.8 μL, 50×ROX Reference Dye 0.4 μL, 其余为超纯水。扩增程序: 95℃预变性30 s; 95℃变性 5 s, 60℃退火 30 s, 72℃延伸 30 s, 共40个循环。反应结束后读取Ct值,每样品重复测定3次。

表1 本研究所用引物Table 1 Primers used in this study
1.5 数据分析
分别以小麦吸浆虫滞育前的3龄幼虫和1龄幼虫中的基因表达量为基准,对1.4节获得的数据采用2-ΔΔCt法计算不同滞育和发育阶段SmJHE和SmJHEH基因相对表达水平。采用SPSS 22.0统计软件(Chicago, IL., 美国)对数据进行单因素方差分析(P<0.05),Tukey氏法进行多重比较。
2 结果
2.1 小麦吸浆虫JHE和JHEH基因的克隆与序列分析
以小麦吸浆虫转录组中JHE和JHEH序列设计特异引物,通过RT-PCR和RACE技术,成功获得了cDNA全长分别为3 102和1 980 bp的小麦吸浆虫JHE基因(SmJHE)(GenBank登录号: MG876768)和JHEH基因(SmJHEH)(GenBank登录号: MG876769)(图1)。 ORF Finder预测显示,SmJHE和SmJHEH的ORF长度分别为1 740 bp和1 371 bp,分别编码579和456个氨基酸残基,预测的蛋白分子量分别为65.67和51.65 kD,理论等电点分别为5.76和8.66。两个基因的起始密码子均为atg,分别位于第733-735 bp和291-293 bp处;终止密码子均为taa,分别位于第2 472-2 474 bp和1 661-1 663 bp处;3′非编码区均具有真核生物典型的多聚腺甘酸信号(aataa)和PolyA结构。
SignalP5.0软件分析发现,SmJHE和SmJHEH基因推导的氨基酸序列N末端分别存在一个长度为22和18个氨基酸残基组成的信号肽序列(图1)。氨基酸序列(图1)分析发现,SmJHE蛋白包含昆虫保幼激素酯酶5个典型功能基序,即一个长疏水结合域GxSxG,是COEs的关键组成部分;其他4个基序分别为RF(第67-68位氨基酸)、DQ(第187-188位氨基酸)、E(第347位氨基酸)和GxxHxxE(第466-472位氨基酸);其中S215, E347和H469被预测形成催化三联体(Wardetal., 1992; Kamita and Hammock, 2010)。SmJHEH蛋白包含JHEH家族组成阴氧离子洞的两个Tyr299和Tyr374残基和HGWP花样结构(第155-158位氨基酸)以及形成催化三联体的氨基酸残基,但组成催化三联体的1个氨基酸发生了变异,即在多数昆虫JHEH中为Asp, Glu和His(Zhangetal., 2005; Mackertetal., 2010),但SmJHEH中为Asp228, Asp404和His431。赤拟谷盗T.castaneum、马铃薯甲虫Leptinotarsadecemlineata等JHE也利用Asp替代Glu作为催化三联体(Tsubotaetal., 2010; Lüetal., 2015)。

图1 小麦吸浆虫SmJHE (A)和SmJHEH (B)核苷酸及推导的氨基酸序列Fig. 1 Nucleotide and deduced amino acid sequences of SmJHE (A) and SmJHEH (B) from Sitodiplosis mosellana起始密码子atg和终止密码子taa用方框标注,N端的信号肽用双下划标注,多聚腺甘酸信号(aataa)用单下划线标注。JHE的5个保守结构域RF, DQ, GASAG, E和GVSHADE和组成JHEH的催化三联体的Asp228, Asp404和His431氨基酸残基用及组成阴氧离子洞的Tyr299和Tyr374残基以及HGWP花样结构用黑色阴影标注。The initiation codon atg and the termination codon taa are boxed. The N terminal signal peptides are indicated by double underline. The putative polyadenylation signals (aataa) are indicated by single underline, and five conserved motifs of JHE including RF, DQ, GASAG, E and GVSHADE, as well as acidic residues consisting of the conserved catalytic triad including Asp228, Asp404 and His431, and the potenital oxyanion hole including Tyr299 and Tyr 374 and HGWP motif of JHEH are in black shade.
2.2 SmJHE和SmJHEH蛋白序列一致性和系统进化分析
蛋白氨基酸序列一致性分析(图2)表明,SmJHE与同目同亚目(双翅目长角亚目)昆虫达氏按蚊Anophelesdarling、埃及伊蚊Aedesaegypti、白纹伊蚊Aedesalbopictus和冈比亚按蚊AnophelesgambiaeJHE的氨基酸序列一致性较高,为49%~51%,其次为与家蝇Muscadomestica、厩螫蝇Stomoxyscalcitrans、丝光绿蝇Luciliacuprina、牵牛花果蝇Drosophilaelegans、地中海实蝇Ceratitiscapitata、桔小实蝇Bactroceradorsalis和浆果实蝇Rhagoletiszephyria等同目短角亚目昆虫JHE的氨基酸序列一致性为45%~48%,与其他3个目(鳞翅目、膜翅目和鞘翅目)7种昆虫同源蛋白的氨基酸序列一致性为40%~42%。SmJHEH与12种双翅目昆虫JHEH的氨基酸序列一致性为51%~53%,与鳞翅目、膜翅目和鞘翅目7种昆虫JHEH的氨基酸序列一致性为47%~49%。用MEGA 6.0中的邻接法进行系统进化分析(图2)发现,双翅目、鳞翅目、膜翅目和鞘翅目昆虫JHE和JHEH完全被分开,SmJHE和SmJHEH均与长角亚目昆虫对应蛋白的亲缘关系最近,与昆虫传统分类结果一致。

图2 邻接法构建的基于氨基酸序列的小麦吸浆虫与其他昆虫JHE (A)和JHEH (B)的系统进化树Fig. 2 Phylogenetic tree of JHE (A) and JHEH (B) from Sitodiplosis mosellana and other insectsbased on amino acid sequence by the neighbor-joining method分支上的数字为1 000次重复的自举检验值。Numbers on the branches are the bootstrap values based on 1 000 replicates.
2.3 小麦吸浆虫滞育不同阶段幼虫SmJHE和SmJHEH表达水平分析
为探讨SmJHE和SmJHEH在小麦吸浆虫滞育中可能的作用,采用qPCR技术分析了两个基因在3龄幼虫滞育前、滞育期、滞育后静息和发育恢复后不同阶段的mRNA表达水平。结果表明,二者在滞育进程中表达水平均存在显著差异(P<0.05)。SmJHE在滞育前和滞育期(2016年6-11月)基本恒定,但11月即向滞育后的过度期和静息阶段的早期(12月)表达量最低,为滞育前的46%~61%,随后逐渐升高,恢复发育后达到最高,尤其发育的后期(2017年4月),表达水平为滞育前的4.58倍,显著高于滞育前、滞育期和滞育后静息期(图3: A)。
与SmJHE一样,整个滞育进程中,SmJHEH在2016年11月和滞育后静息期表达水平低于其他时期。不同的是,SmJHEH在翌年1月表达水平最低,为滞育前的56%,发育恢复后表达量有升高,但随后又逐渐降低(图3: B)。
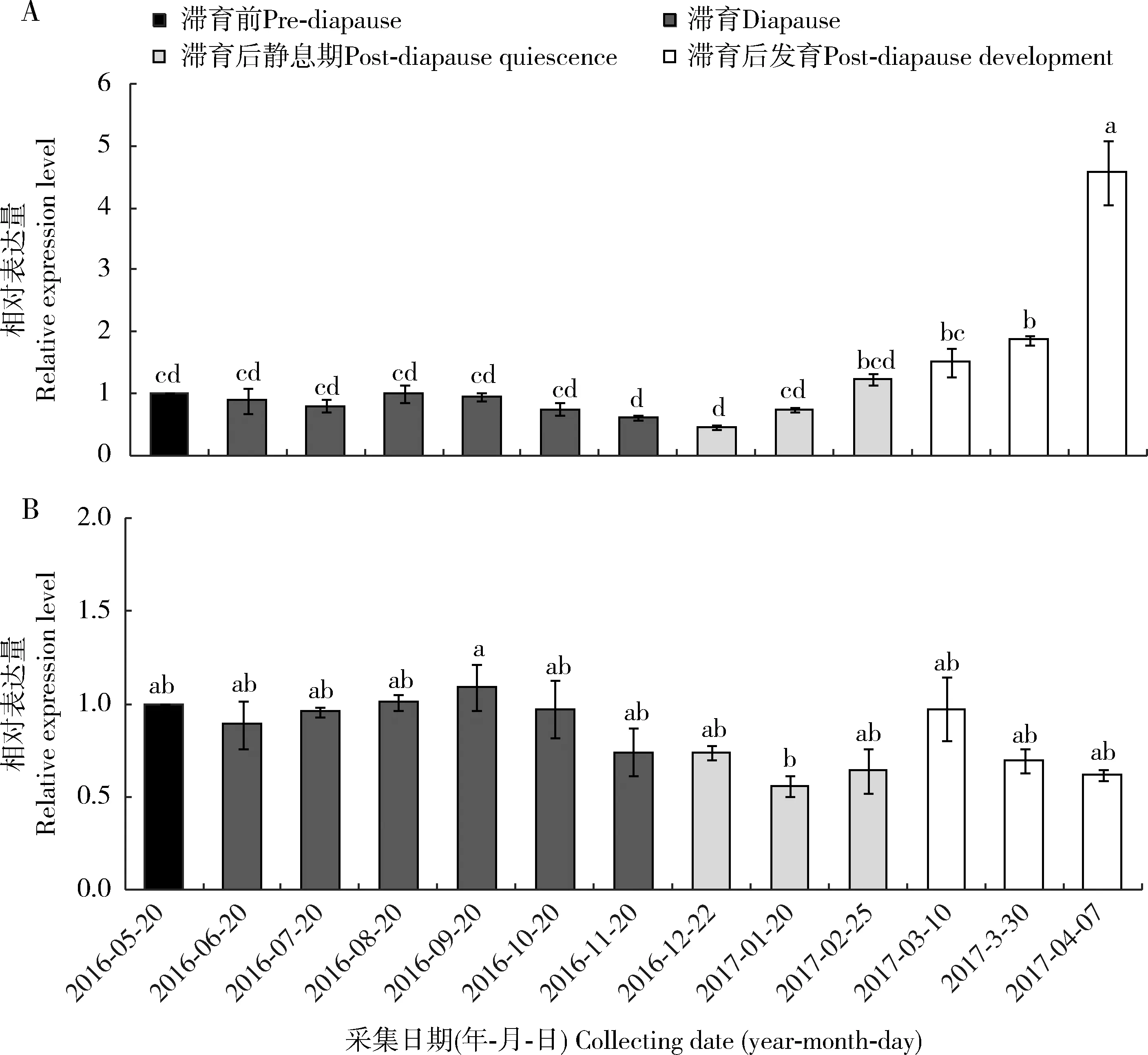
图3 小麦吸浆虫滞育前后及滞育期3龄幼虫中SmJHE (A)和SmJHEH (B)的相对表达水平Fig. 3 Relative expression levels of SmJHE (A) and SmJHEH (B) in the 3rd instar larvae ofSitodiplosis mosellana at the pre-diapause, diapause and post-diapause quiescence stages图中数据为平均值±标准误,柱上不同字母表示经Tukey氏多重比较后差异显著(P<0.05)。Data in the figure are mean±SE. Different letters above bars indicate significant difference by Tukey’s multiple range test (P<0.05). 图4同The same for Fig. 4.
2.4 小麦吸浆虫不同发育阶段SmJHE和SmJHEH表达水平分析
由图4可知,小麦吸浆虫不同发育阶段SmJHE和SmJHEH表达水平均存在差异显著(P<0.05)。SmJHE在1龄到3龄幼虫早期表达水平较低且差异不显著(P>0.05),发育到3龄幼虫后期表达量显著升高,预蛹时达到最高,为1龄幼虫中的8.6倍,化蛹后表达水平显著下降,其中中蛹和后蛹中的表达量显著低于初蛹期的(P<0.05);雄成虫中的表达水平与中、后蛹中的差异不显著(P>0.05),但显著高于雌成虫(P<0.05)(图4: A)。
与SmJHE不同,整个发育过程中,SmJHEH在预蛹期表达水平最低,仅为1龄幼虫中的35%;在雌成虫中表达水平为在1龄幼虫中的1.6倍,显著高于雄成虫和其他所有虫态的表达水平(P<0.05)。幼虫期各阶段SmJHEH表达水平基本恒定,化蛹后表达水平逐渐升高,但各时期(初蛹、中蛹和后蛹)的表达水平差异未达显著水平(P>0.05)(图4: B)。
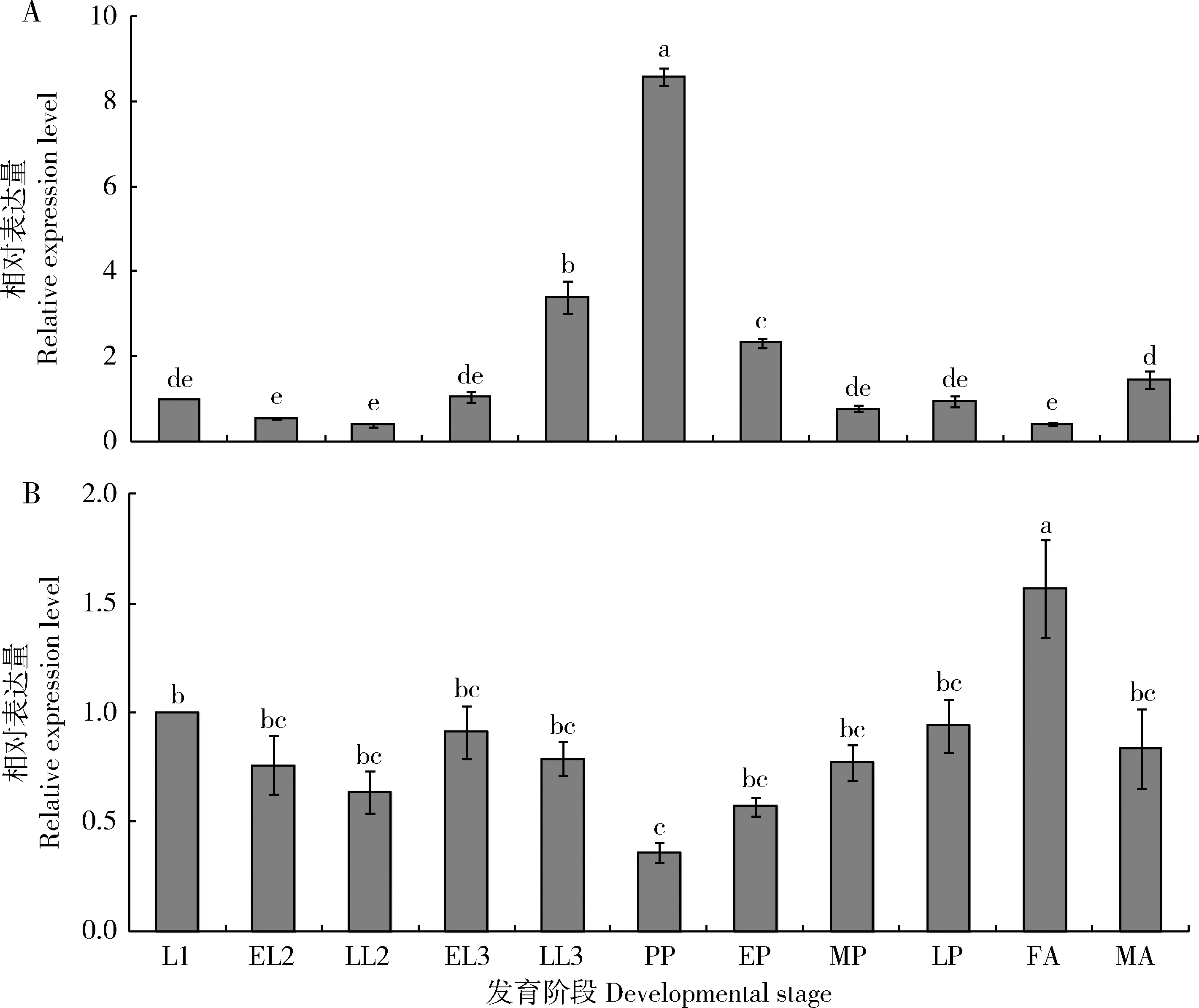
图4 小麦吸浆虫不同发育阶段SmJHE (A)和SmJHEH (B)的相对表达水平Fig. 4 Relative expression levels of SmJHE (A) and SmJHEH (B) at different developmental stages of Sitodiplosis mosellanaL1: 1龄幼虫1st instar larva; EL2: 2龄幼虫早期Early 2nd instar larva; LL2: 2龄幼虫后期Late 2nd instar larva; EL3: 3龄幼虫早期Early 3rd instar larva; LL3: 3龄幼虫后期Late 3rd instar larva; PP: 预蛹Prepupa; EP: 初蛹Early pupa; MP: 中蛹Middle pupa; LP: 后蛹Late pupa; FA: 雌成虫Female adult; MA: 雄成虫Male adult.
3 讨论
JHE和JHEH是在昆虫生命活动中调控JH滴度的重要降解酶(李胜等, 2004)。本研究克隆得到小麦吸浆虫SmJHE和SmJHEH基因全长cDNA序列,两个基因编码的蛋白不仅与已报道的同目长角亚目昆虫同源蛋白的氨基酸序列一致性较高,亲缘关系最近,而且与已报道的绝大多数昆虫JHE和JHEH一致(图1和2),N端包含一个由18~22个氨基酸组成的疏水性信号肽序列(徐素平等, 2014; Zhuetal., 2017)。研究表明,昆虫JHEs包含RF, DQ, GxSxG, E和GxxHxxD/E 5个保守结构域(Kamita and Hammock, 2010),其中GxSxG和GxxHxxD/E基序中的S和H以及E基序是最保守的,它们被预测形成催化三联体,而RF和DQ基序中的R和D残基是JHE发挥作用所必需的(Wardetal., 1992)。本研究结果显示SmJHE蛋白包含以上所有特征结构域,表明其在进化过程中功能高度保守,即在小麦吸浆虫体内JH的降解代谢中发挥作用。值得指出的是,SmJHE基因编码的GxSxG模块为GASAG,与绝大多数昆虫典型序列GQSAG相比第2位氨基酸发生了突变。类似现象也在西方蜜蜂Apismellifera(Mackertetal., 2008)、烟粉虱Bemisiatabaci(龙楚云等, 2013)、大猿叶甲Colaphellusbowringi(Zhuetal., 2017)等其他昆虫JHEs中发现。Mackert等(2008)认为保守结构域的突变可能代表激素信号通路的调整,说明JHE在不同昆虫体内的作用途径可能存在差异。尽管大多数昆虫JHEHs组成催化三联体和阴氧离子洞的氨基酸残基高度保守(Zhangetal., 2005; Mackertetal., 2010),但小麦吸浆虫SmJHEH中构成催化三联体的氨基酸发生了小的变异,即SmJHEH中构成催化三联体的Asp在多数昆虫中为Glu。类似现象也在赤拟谷盗T.castaneum、马铃薯甲虫L.decemlineata等JHE中发现,而且在赤拟谷盗JHE中也证明Glu突变为Asp后同样具有高效降解JH的能力(Tsubotaetal., 2010; Lüetal., 2015),据此推测SmJHEH也具有该功能。
前期研究表明,JH在小麦吸浆虫滞育诱导及滞育和滞育后静息状态的维持中发挥重要作用(Chengetal., 2020),据此推测,如果代谢途径在小麦吸浆虫滞育诱导期间JH滴度的调控中起主导作用,SmJHE和SmJHEH在滞育前的3龄早期幼虫中的表达量应低于在2龄幼虫中的,且进入滞育后维持较低水平。事实上,黄斑星天牛Psacotheahilaris幼虫进入滞育后JHE活性显著降低且在滞育期间维持较低水平(Munyiri and Ishikawa, 2004)。然而与预期不同,SmJHE和SmJHEH在3龄早期幼虫中的表达量与1和2龄幼虫中的差异不显著,且进入滞育后至10月的滞育维持期间一直维持平稳水平;而JH合成途径限速酶3-羟基-3-甲基戊二酰辅酶A还原酶基因SmHMGR在滞育诱导和维持中表达变化与JH滴度及其信号传导途径相关基因SmMet和SmKr-h1(李英梅等, 2006; 刘禹含等, 2019; Chengetal., 2020)完全一致。因此认为,是JH合成而不是降解途径对麦红吸浆虫滞育诱导过程中JH滴度起主要调节作用。类似结果也在蛀茎夜蛾Sesamianonagrioides(Schafellneretal., 2008)和大猿叶甲C.bowringi(Zhuetal., 2017)滞育研究中发现。有趣的是,小麦吸浆虫滞育后静息阶段的当年12月至翌年1月,SmJHE和SmJHEH的表达水平均为滞育进程中的最低,而此时JH滴度达到最高(李英梅等, 2006; Chengetal., 2020),说明二者表达水平的降低利于JH的累积,从而使虫体维持静息状态。
众所周知,全变态类昆虫末龄幼虫JH滴度显著降低、蜕皮激素(molting hormone, MH)滴度急剧升高时引起变态(Bhaskaranetal., 1986; Kinjohetal., 2007; Ureaetal., 2016; Kayukawaetal., 2017),而在此过程中JH降解酶扮演着重要角色。例如,黄斑星天牛P.hilaris5龄幼虫变态发育过程中JHE活性与JH滴度变化呈明显的负相关,化蛹前JH滴度降到最低而JHE活性达到最高(Munyiri and Ishikawa, 2004);苜蓿夜蛾HeliothisdipsaceaJHE在预蛹中的表达量显著高于其他阶段(张欢等, 2015);家蚕JHE基因敲除后末龄幼虫期延长,化蛹推迟(Zhangetal., 2017)。本研究中,小麦吸浆虫3龄后期SmJHE表达量逐渐升高,预蛹期达到最高(图4: A),而此时MH滴度显著升高,JH信号传导相关基因SmMet和SmKr-h1表达量明显降低(成卫宁等, 2009; Chengetal., 2020),说明高水平的SmJHE表达刺激酶活性提高,促进JH降解,利于幼虫到蛹的变态。然而与SmJHE不同,SmJHEH在预蛹期的表达量反而降到最低(图4: B),说明在幼虫变态过程中,该酶对JH的降解贡献不大。
有研究表明,JH对昆虫生殖活动的调控与JHE有关。例如,烟粉虱B.tabaci和西方蜜蜂A.mellifera生活史中卵黄原蛋白基因和JHE基因表达水平一致,二者均与JH滴度呈负相关(Mackertetal., 2008; 龙楚云等, 2013)。本研究中SmJHE在雌成虫中表达量显著低于雄成虫,与JH信号传导相关基因SmMet和SmKr-h1表达呈负相关(Chengetal., 2020),据此推测该基因可能参与小麦吸浆虫生殖力的调控。
综上所述,SmJHE和SmJHEH参与小麦吸浆虫的滞育调控,二者在滞育进程中表达量的降低为滞育后静息阶段JH的累计提供了保障;SmJHE在发育过程中表达量的升高可能参与了幼虫到蛹的变态,在雌成虫中表达量低于雄成虫可能与JH调控的生殖发育有关。这说明SmJHE不仅在小麦吸浆虫滞育后静息状态维持,而且在其变态发育和生殖中均发挥作用。

