基于COⅠ序列的海南岛8个弹涂鱼群体遗传多样性研究
柯宏基,李向民,陈傅晓,3,樊佳伟,王永波,3,谭 围,3
(1.上海海洋大学水产科学国家级实验教学示范中心,上海 201306; 2.海南省海洋与渔业科学院,海口 571126; 3.热带海洋生物资源利用与保护教育部重点实验室,海南三亚 572022)
弹涂鱼(Periophthalmusmodestus)栖息于海边滩涂处及红树林等区域[1],其肉质细嫩,味道鲜美,营养价值丰富[2],不仅具有较高的经济价值,其作为沿海滩涂特色小型鱼类还具有独特的生态研究价值 。近年来由于海域环境的恶化,弹涂鱼的生存环境受到影响,资源数量下降,因此保护弹涂鱼资源势在必行。
COⅠ基因是线粒体氨基酸编码基因,具有结构简单、进化速率适中、母系遗传等特点,广泛应用于遗传多样性、遗传结构、物种鉴定等方面的研究[3-4]。李瑜等[5]采集广东省珠海市淇澳岛的青弹涂鱼(Scartelaoshistophorus)、大弹涂鱼(Boleophthalmuspectinirostris)和大鳍弹涂鱼(Periophthalmusmagnuspinnatus),分析这些物种个体的核基因RAG1以及线粒体基因COⅠ的序列,得出种间遗传距离最大的是大鳍弹涂鱼与青弹涂鱼,大鳍弹涂鱼相比大弹涂鱼和青弹涂鱼遗传多样性最高。廖健等[6]基于COⅠ和D-loop区序列分析了雷州半岛红树林海区2种野生弹涂鱼的遗传变异,结果表明弹涂鱼种群遗传多样性高于大弹涂鱼,目前海南岛弹涂鱼的相关研究较少[7]。本研究拟通过对海南岛8个不同群体的弹涂鱼COⅠ基因序列进行分析,以期揭示不同群体之间的遗传多样性及遗传结构差异,为弹涂鱼遗传多样性保护等工作提供依据。
1 材料与方法
1.1 样品来源及扩增测序
弹涂鱼群体于2018—2019年分别在海口(简称HK)、澄迈(简称CM)、临高(简称LG)、儋州(简称DZ)、昌江(简称CJ)、东方(简称DF)、乐东(简称LD)、三亚(简称SY)野外人工捕捉。样本活体运输至海南省海洋与渔业科学院琼海科研基地,取背部肌肉组织于75%的乙醇中保存24 h,更换为 95%乙醇保存 24 h,最后于无水乙醇中常温保存。采用TAKARA DNA提取试剂盒提取8个群体236尾弹涂鱼的基因组 DNA,其中海口30尾、澄迈30尾、临高30尾、儋州30尾、昌江30尾、东方29尾、乐东30尾、三亚27尾。DNA样品经 1%的琼脂糖凝胶电泳检测后,保存于-20 ℃冰箱中备用。弹涂鱼线粒体COⅠ基因扩增所用引物序列如下[8]:cox F:5′-TCAACCAACCACAAAGACAATGGCAC-3′;cox R:5′-TAGACTTCTGGGTGGCCAAAGAATCA-3′,扩增程序为:94 ℃ 预变性1 min 20 s;94 ℃ 变性30 s,55 ℃退火 30 s,72 ℃延伸 50 s,30个循环,72 ℃下延伸 5 min。PCR 产物经电泳检测后,送至广州艾基生物技术有限公司进行双向测序。

图1 采样点示意图Fig.1 Map of sampling locations
1.2 数据分析
测序完成后,用SeqMan拼装校对COⅠ基因序列。通过 MEGA 7.0软件对测序结果进行比对分析。采用软件DNASP 6.0计算序列变异位点数、单倍型数目、单倍型多样性和核苷酸多样性等遗传参数;利用MEGA 7.0软件分析序列的碱基组成,基于Kimura 2-parameter模型计算群体内及群体间的遗传距离,采用邻接法 (neighbor-joining,NJ)构建弹涂鱼单倍型邻接关系进化树[9],节点支持率采用 Bootstrap 1 000 次重复检验置信度;利用 Arlequin 3.11软件计算两两群体间的遗传分化指数(Fst) ,并进行分子方差分析(analysis of molecular variance,AMOVA),用于遗传变异和地理结构特点研究;使用核苷酸不配对分析(mismatch distribution) 和中性检验(neutrality tests) 来检测海南弹涂鱼的种群历史动态,利用 Network 5.0软件构建单倍型网络图,分析单倍型之间的进化关系。种群扩张时间(T) 利用公式τ=2ut进行估算,其中t表示种群扩张至今所经历的代数,T=t×代时,代时为研究对象的生殖周期;τ为扩张时间参数;u=μk,μ为线粒体COⅠ基因变异速率;k表示序列长度。
2 结果与分析
2.1 序列分析
实验共获得236条弹涂鱼COⅠ基因片段序列,序列长度为621 bp,序列组成显示平均 A、T、G、C碱基含量分别为 31.2% 、26.3%、26.0%、16.4%,A+T(57.5%)含量高于G+C(42.4%)的含量,236个样本检测到59个单倍型,发现了54个变异位点(表1),占总位点数的8.7%,25个单变异位点,29个为简约信息位点。
2.2 弹涂鱼遗传多样性
各地理群体的单倍型数、多态位点数、单倍型多样性和核苷酸多样性数据结果见表1,8个群体的单倍型数在12~15种,其中以HK、CM、LG、DF 4个群体单倍型最多,有15种单倍型,单倍型数从高到低依次为 HK、CM、LG、DF群体(15种)、CJ群体(14种)、LD、SY群体(13种)、DZ群体(12种)。
单倍型多样性指数在0.805~0.919 之间,核苷酸多样性指数在 0.003 23~0.006 15 之间。平均核苷酸差异数为2.002~3.813,其在DF群体中最多为 3.813个,在DZ群体中最少为 2.002个。总体单倍型多样性为0.861±0.019;由单倍型参数可知,DF群体的单倍型多样性最为丰富,单倍型多样性为0.919±0.030;LD群体单倍型多样性最低,单倍型多样性为0.805±0.070;8个群体的单倍型多样性均大于0.500,属于高水平。总体核苷酸多样性为0.004 39±0.000 24;由核苷酸参数可知,DF群体的核苷酸多样性最为丰富,核苷酸多样性为0.006 15±0.000 65;DZ群体核苷酸多样性最低,核苷酸多样性为0.003 23±0.000 57;8个群体只有DF和CM两个群体的核苷酸多样性大于0.005 00,其余群体均小于0.005 00,属于低水平。结果显示,8个群体中DF和CM群体具有较高的遗传多样性,其余群体遗传多样性相对较低。
2.3 单倍型在群体中的分布
在236条弹涂鱼COⅠ基因片段序列中共检测到59个单倍型(表2),其中17个为共享单倍型,其余42个为独有单倍型。单倍型Hap1和Hap4为所有群体的共享单倍型,Hap1出现频次最高,分布于80个样本中,占总样本数的33.9%。Hap6为7个群体共享(HK、CM、 LG、DZ、CJ、DF、LD),Hap10为7个群体共享(HK、CM、 LG、DZ、CJ、DF、LD),Hap3为6个群体共享(HK、CM、CJ、DF、LD、SY),Hap19为5个群体所共享(CM、CJ、DF、LD、SY),Hap5为4个群体所共享(HK、LG、DZ、LD),Hap12为4个群体共享(HK、LG、DZ、SY),Hap14为4个群体共享(HK、CM、LG、CJ),其余共享单倍型分别为2~3个群体共享。在独有单倍型中HK群体有6个(Hap2、Hap8、Hap9、Hap11、Hap13、Hap15),CM群体有6个(Hap16、Hap18、Hap20、Hap21、Hap22、Hap24),LG群体有7个(Hap25、Hap26、Hap27、Hap28、Hap29、Hap30、Hap32),DZ群体有5个(Hap33、Hap34、Hap35、Hap37、Hap38),CJ群体有3个(Hap39、 Hap40、Hap42),DF群体有6个(Hap44、Hap45、Hap46、Hap48、Hap49、Hap50),LD群体有4个(Hap51、Hap52、Hap53、 Hap54),SY群体有5个(Hap55、Hap56、Hap57、Hap58、Hap59)。
2.4 遗传分化
利用 Network5.0 软件分析弹涂鱼单倍型之间的进化关系(图2):单倍型没有按不同地理群体形成独立的分支,而是星形放射状结构。单倍型在各群体的分布状况如图2所示,共享单倍型约占所有单倍型的28.8%(17/59), 其中 Hap1和Hap4 由8个群体共享。
8个弹涂鱼群体的种内和种间遗传距离见表3所示。从表3中可以看出,弹涂鱼群体内的遗传距离为0.003~0.006,群体间的遗传距离为0.003~0.006,CM和DF以及CJ和DF群体的遗传距离最大(0.006),其余群体之间的遗传距离在0.004~0.005之间。
群体间Fst分析结果显示:两两群体间的Fst值在 -0.023 54~0.060 42之间(表4),除了SY与LG、DF群体Fst大于0.05且小于0.15(SY与LG群体差异极显著,SY与DF群体差异显著),其余群体Fst均小于0.05。基因流均大于4或小于0 。
8个弹涂鱼地理群体的AMOVA结果(表5)显示,群体间的遗传变异仅占所有遗传变异的极少部分,绝大部分的遗传变异(99.36%)来源于群体内部;Fst为0.006 37,基因流为77.992 94,表明群体间基因交流频繁,不存在明显的遗传分化。
2.5 弹涂鱼的种群历史动态
中性检验结果(表6)表明全部群体Tajima’sD值均为负值,其中LG、DZ、SY群体差异显著;Fu’sFS值均为负值,DF群体差异显著,其余群体差异极显著。基于Arlequin核苷酸不配对分析图表明,HK、DZ、CJ、SY群体为单峰状(图4)。DZ群体SSD (sum of square deviations)检验显著,其他群体SSD和r(Harpending’s raggedness index)这两个统计检验不显著(表7)。

表2 弹涂鱼单倍型的地理分布Tab.2 Distribution of haplotypes of 8 Periophthalmus modestus populations from the Hainan Island

图2 弹涂鱼 mtDNA COⅠ单倍型网络结构图Fig.2 Haplotype network of Periophthalmus modestus based on COⅠ of mtDNA

表3 基于 COⅠ基因序列的弹涂鱼群体遗传距离Tab.3 Genetic distances within/among Periophthalmus modestus populations based on COⅠ
注: 对角线表示群体内遗传距离,对角线下为群体间遗传距离。HK:海口; CM:澄迈; LG:临高; DZ:儋州; CJ:昌江; DF:东方; LD:乐东; SY:三亚
Note: The diagonal stands for the genetic distance within populations and genetic distance among populations is below the diagonal. HK:Haikou; CM:Chengmai; LG:Lingoao; DZ:Danzhou; CJ:Changjiang; DF:Dongfang; LD:Ledong; SY:Sanya
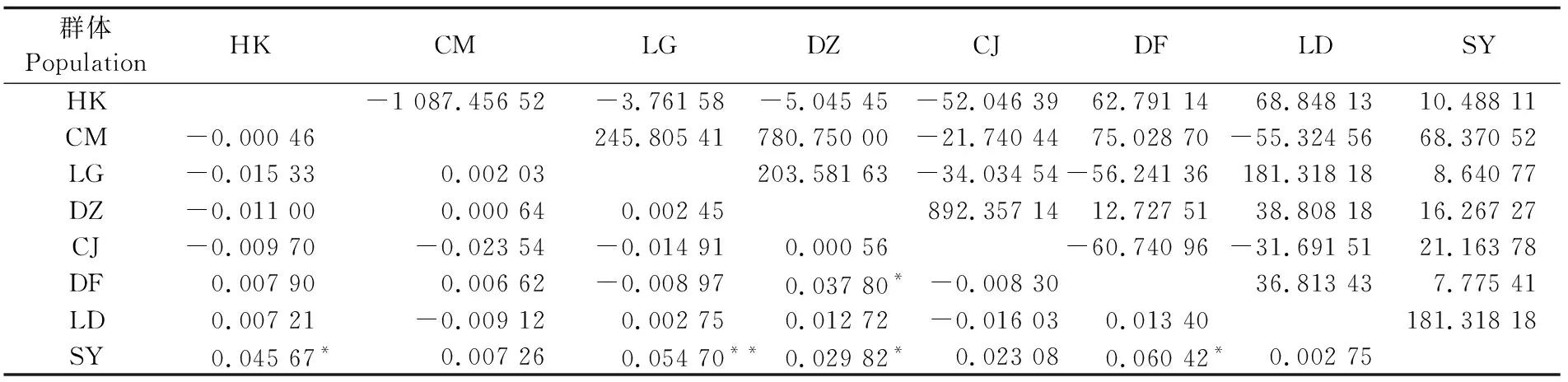
表4 弹涂鱼遗传分化指数(对角线下方)和基因交流值(对角线上方) Tab.4 Matrix of pairwise Fst (below diagonal) and Nm (above diagonal) among populations of Periophthalmus modestus
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。HK:海口; CM:澄迈; LG:临高; DZ:儋州; CJ:昌江; DF:东方; LD:乐东; SY:三亚
Note:*means significant differences (P<0.05);**means extremely significant differences (P<0.01). HK:Haikou; CM:Chengmai; LG:Lingoao; DZ:Danzhou; CJ:Changjiang; DF:Dongfang; LD:Ledong; SY:Sanya
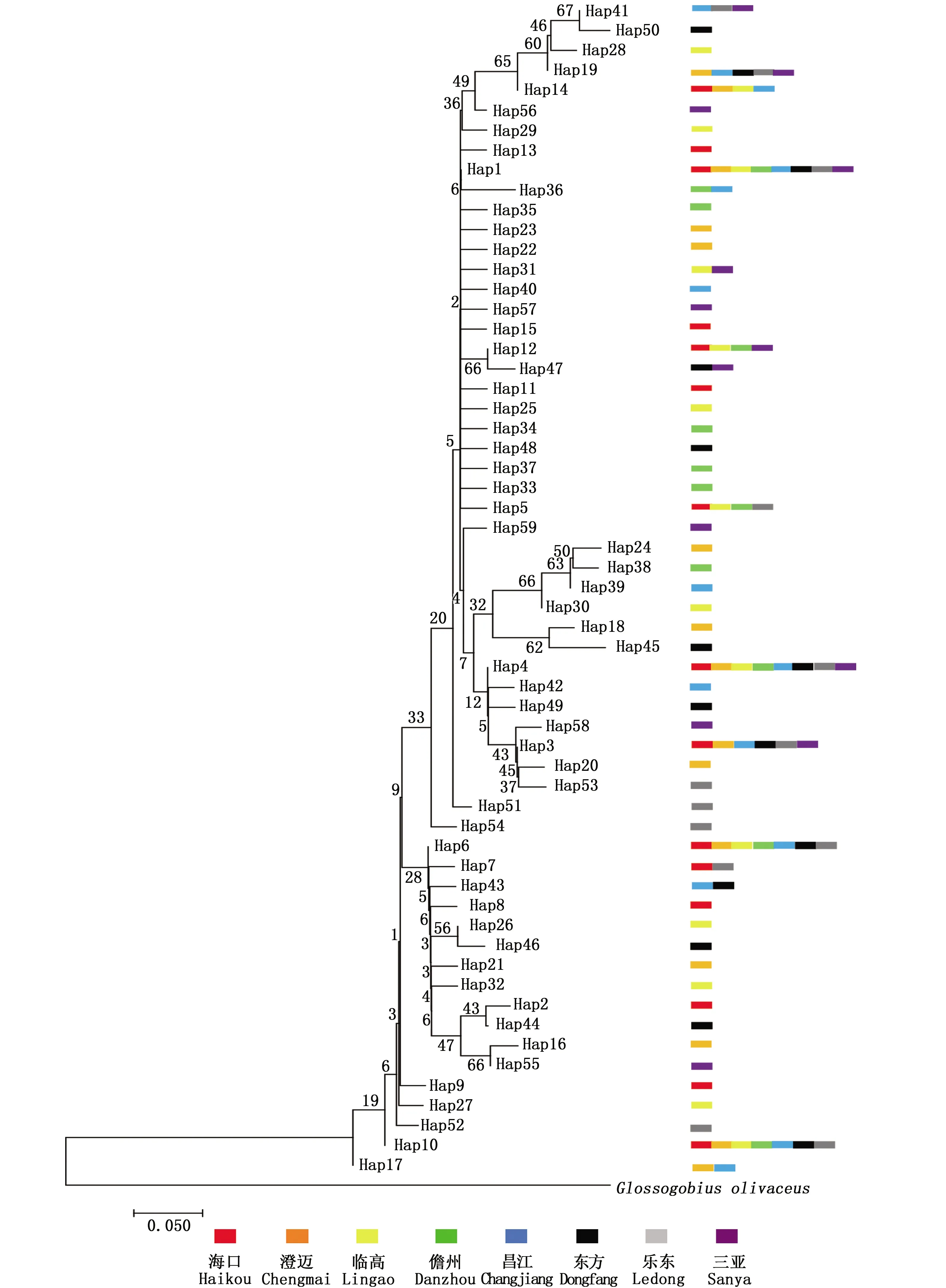
图3 弹涂鱼COⅠ单倍型邻接系统发育树Fig.3 Neighbor-joining tree for COⅠ haplotypes of Periophthalmus modestus

表5 弹涂鱼群体遗传差异的AMOVA分析Tab.5 Analysis of molecular variance (AMOVA) among populations of Periophthalmus modestus
注:Va:群体间方差组分;Vb:群体内方差组分
Note: Va:variance components among populations;Vb:variance components within populations

表6 中性检验Tab.6 Neutrality tests
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。HK:海口; CM:澄迈; LG:临高; DZ:儋州; CJ:昌江; DF:东方; LD:乐东; SY:三亚
Note:*means significant differences (P<0.05);**means extremely significant difference (P<0.01). HK:Haikou; CM:Chengmai; LG:Lingoao; DZ:Danzhou; CJ:Changjiang; DF:Dongfang; LD:Ledong; SY:Sanya
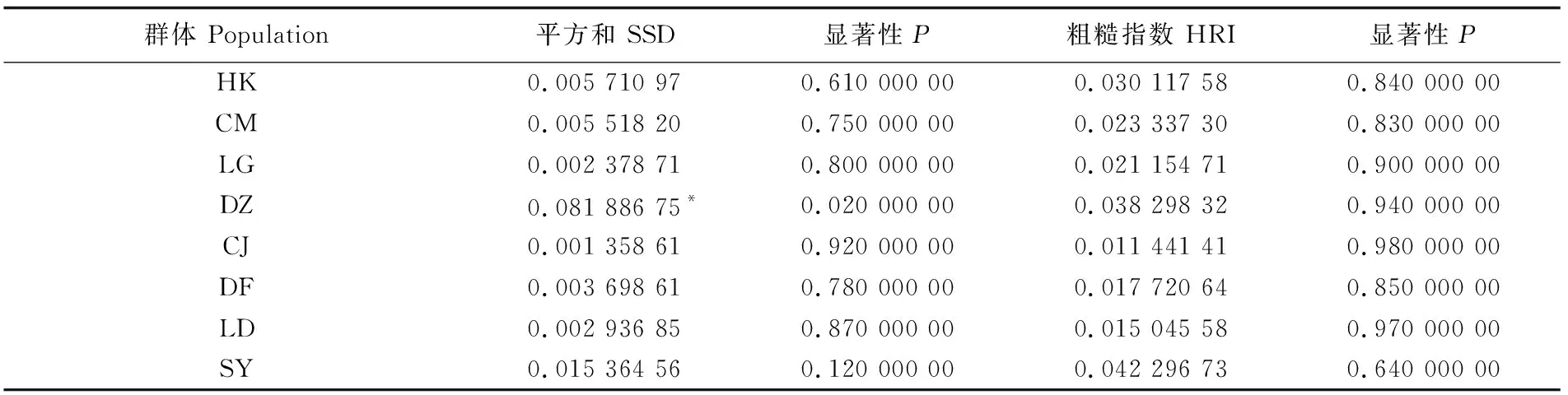
表7 吻合度检验Tab.7 Goodness-of-fit test
注:*表示差异显著(P<0.05)。HK:海口; CM:澄迈; LG:临高; DZ:儋州; CJ:昌江; DF:东方; LD:乐东; SY:三亚
Note:*means significant differences (P<0.05). HK:Haikou; CM:Chengmai; LG:Lingoao; DZ:Danzhou; CJ:Changjiang; DF:Dongfang; LD:Ledong; SY:Sanya
3 讨论
本研究中,8个弹涂鱼群体的单倍型多样性指数在0.805~0.919之间,核苷酸多样性指数在0.003 23~0.006 15 之间,总体单倍型多样性指数为0.861,核苷酸多样性指数为0.004 39。单倍型多样性指数和核苷酸多样性指数都是用来说明遗传多样性的重要指标。这两者的临界值在0.5(单倍型多样性指数)和0.005(核苷酸多样性指数),越大表明遗传多样性越高。根据GRANT和BOWEN[10]提出的4种模式,海南岛8个弹涂鱼群体分为两个类型:一是单倍型多样性高、核苷酸多样性低,表明在群体瓶颈后快速增长和突变积累;二是单倍型多样性及核苷酸多样性都高,表明群体规模足够大,长期进化历史中十分稳定,或包含了两个不同世系的次级结构[11]。海南岛群体总体与雷州半岛群体[6]及东海群体[12]对比表明:海南岛的单倍型多样性指数和核苷酸多样性指数均低于雷州半岛群体以及东海群体。目前海南岛弹涂鱼不是主要的经济食用鱼种,影响其生存的主要威胁并非过度捕捉。根据走访调查发现,沿海环境的恶化以及人为活动导致弹涂鱼原有的生存环境发生改变,而栖息地的退化和消失,使得弹涂鱼的分布区域不断减少,这可能是弹涂鱼种质资源下降的主要原因,因此需要采取相应的保护措施,防止弹涂鱼资源进一步退化。
遗传分化系数Fst是反映群体间遗传分化程度的重要指标,较高水平的Fst表明其具有较高水平的遗传分化,当Fst为0~0.05时无分化,0.05~0.15为中度分化,0.15~0.25为高度分化[13]。群体间基因交流值(Nm)一般用来评估两两群体间的基因交流是否频繁。两个群体频繁地随机交配时,出现Nm< 0 或Nm>4;当两群体达到中等程度分化时,Nm值范围约为 1~4;当两群体间基因交流较为匮乏,如隔离的产生使基因交流受阻严重时,Nm值范围约在 0~1 之间[14]。本文群体间Fst分析结果显示:两两群体间的Fst值在 -0.023 54~0.060 42之间,除了SY与LG、DF群体0.05 中性检验结果表明,8个群体Tajima’sD值均为负值,其中LG、DZ、SY群体P﹤0.05;Fu’sFS值均为负值,DF群体差异显著,其余群体差异极显著。基于Arlequin不配对分布表明HK、DZ、CJ、SY群体为单峰状。DZ群体SSD检验显著,其他群体SSD和r这两个统计检验不显著。由于目前缺乏关于弹涂鱼性成熟年龄的准确数据,本研究以与弹涂鱼相近的大弹涂鱼种类为参考[17],大弹涂鱼性成熟的年龄为1龄,线粒体COⅠ基因进化速率参考为每百万年 1% ~3%[18],推算HK群体扩张时间为8.05~2.60万年前,LG群体扩张时间为24.2~8.1万年前,DZ群体扩张时间为7.2~2.4万年前,CJ群体扩张时间为30.6~10.2万年前,SY群体扩张时间为14.5~4.8万年前。30.6~2.4万年前在第四纪,这期间也有其他海洋生物发生扩张[19],主要经历了中国倒数第二次冰期、末次间冰期、末次冰期。第四纪时期海面随冰期-间冰期的交替而升降变化,寒冷时期大陆冰川发展,大量淡水结冰停留在陆地冰川中,海面下降;气候转暖,冰川溶解,海面升高[20]。这些气候变化会给生物生存环境带来各方面的影响,弹涂鱼群体可能受到这些方面的影响从而发生群体扩张。 本研究对海南岛8个弹涂鱼群体的分析结果表明,海南岛弹涂鱼整体遗传分化程度不高,是一个随机交配的群体。海南岛部分群体经历过种群扩张,整体遗传多样性较低,应加强资源保护。调查中发现,海南岛弹涂鱼资源分布区域基本同海南省近岸海域生态保护红线划定重叠,因此,严格遵守生态保护红线和环境质量底线,对今后弹涂鱼等生物资源的保护将发挥重要作用。

