几种植物浮床+仿生植物系统对污染物的去除效果
扶咏梅 刘盼 郭一飞 顾效纲 刘彪 郭佳 贺攀


摘要:为了研究由不同水生植物与仿生植物构建的组合型生态浮床对水中污染物的去除效果,将风车草、再力花、美人蕉、梭鱼草、菖蒲与仿生植物组合构建成生态浮床,分析几种组合型生态浮床对水中污染物的去除效果。结果表明,各处理系统(5种水生植物+仿生植物)对水中氨态氮(NH+4-N)、硝态氮(NO-3-N)、亚硝态氮(NO-2-N)、总磷(TP)、高锰酸盐指数(CODMn)具有很好的去除效果,平均去除率分别达到93.12%、88.10%、100.00%、95.00%、30.00%,明显高于空白对照组,略优于仿生植物对照组,可见合理的植物+仿生植物组合系统可以实现对污染水体的强化净化,同时可以有效抵抗植物衰亡对系统带来的冲击,确保复合系统的长期稳定运行。
关键词:生态浮床;仿生植物;强化净化;去除效果
中图分类号:X52文献标志码: A
文章编号:1002-1302(2020)07-0285-05随着我国工业化进程的加快,环境问题日益突出,尤其是以水体黑臭和水體富营养化为代表的水环境问题。截至2017年,全国有黑臭水体2 100个,水体面积达1 484.727 km2,24.6%的重点湖泊呈富营养状态。黑臭水体及水体富营养化现象导致水体的自净功能严重退化,不仅对河流水质产生了较大影响,还会影响周边的水环境和人文景观,甚至会通过给水系统危害人类健康[1]。
为了解决水体富营养化问题,国内外学者提出了许多技术,主要有物理化学法、生物法和生态法等[2]。改善水体富营养化采用的具体方式主要有控源截污、内源治理、疏浚活水、人工充氧、稳定塘[3-4]等。这些方法在应用过程中存在工程量大、成本高、水体污染防治受地域限制、污染易反弹等缺点,生态浮床由于具有安全、经济、实用、系统化、可实现原位修复、净化效果好等诸多优点[5],近年来受到国内外研究者的广泛关注。多项研究结果表明,浮床植物主要通过植物的吸收作用及根系微生物的降解来去除污染物,从而改善水质,但是对于污染严重的河道,植物地上部分往往生长旺盛,地下部分短小,影响了根系微生物附着,从而影响了水质净化效果,这是限制该项技术应用的主要障碍。仿生植物的出现很好地解决了这一瓶颈问题,其原理是通过各种纤维填料模仿植物根系,为微生物的附着提供充足的空间,可以促进微生物聚集、繁殖、生长、代谢,从而提高了污染物的去除效果,实现水质净化的目的[1-2]。汪松美等采用空心菜浮床+仿生植物系统研究重污染河道的污染物去除情况,结果表明,空心菜浮床+仿生植物复合系统相比于单独的空心菜浮床,总氮(TN)、氨态氮(NH+4-N)、总磷(TP)、高锰酸盐指数(CODMn)的去除率分别提高了28.50%、20.03%、33.43%、18.02%;通过野外挂膜和室内控制试验发现,当pH值为7~8、初始氨氮浓度为20 mg/L时,仿生植物系统具有较高的氨氮去除效能[6]。戴谨微等研究了复合型生态浮床系统对污水厂尾水的净化效能,结果发现,在合适的水力停留时间(HRT)下,复合型生态浮床系统对NH+4-N、TN、TP的去除率分别达到98.69%、20.56%、91.80%[7],可见复合型生态浮床系统在水体净化方面具有可行性和高效性。
近年来的研究和实践发现,复合生态浮床系统植物种类过于单一,而关于不同植物与其仿生植物组合而成的复合生态浮床系统的研究鲜有报道。鉴于此,本研究采用5种不同浮床植物与其对应的仿生植物,通过室内控制试验,探讨不同仿生植物复合系统对富营养化水体中NH+4-N、硝态氮(NO-3-N)、亚销态氮(NO-2-N)、TP、CODMn等多项水质指标的净化性能,以期为新型生态浮床系统的构建提供有益参考,通过分析各种污染物的去除机制,还可以为富营养化水体的原位修复及强化净化提供技术支持与理论指导。
1 材料与方法
1.1 浮床植物
本研究采用的5种浮床植物分别为风车草、再力花、美人蕉、梭鱼草、菖蒲,本试验所用植株是由上述5种植物的根置于水中发芽生根得到的,待根部生根发芽后,再将植株移植入事先备好的盛土花盆中,置于污染河道的污水中进行驯化培养。
1.2 试验材料
制作仿生植物的原材料采用组合填料,用尼龙扎带固定,仿生植物及辅助单元的制作方法与汪松美等的试验方法[6]类似,野外挂膜场所为河南城建学院校内的人工湖,挂膜周期约为180 d,待挂膜成功后,用无菌剪刀分别从对应培养有仿生植物的浮床植物上剪下仿生植物样品,用无菌袋封存,置于实验室-20 ℃冰箱中备用。试验用水箱规格为90 cm×60 cm×60 cm,水样体积为110 L,用聚苯乙烯泡沫板模拟生态浮床,试验水箱放置于实验室靠窗位置,设置6个试验组(5种植物与1种单独的仿生植物)和1个空白对照组,每个处理组设3组平行,选取生长状况良好、长势均匀的风车草、再力花、美人蕉、梭鱼草、菖蒲野生种植株,移入试验用塑料箱中并固定在聚苯乙烯泡沫板上。
1.3 试验设计
试验分为7组,分别为1号(风车草+仿生植物)、2号(再力花+仿生植物)、3号(美人蕉+仿生植物)、4号(梭鱼草+仿生植物)、5号(菖蒲+仿生植物)、6号(单独的仿生植物)、7号(空白)。试验用水均取自河南城建学院人工湖,将驯化培养于人工湖中的浮床植物及对应的仿生植物分别移植于水箱中,在移植植物前对各水箱进行5 min的曝气,确保良好的溶解氧环境。分别对7组生态浮床进行为期2个月的连续监测试验。分别在试验后0、2、6、12、18、24、30、36、42、48、54、60 d取样测定水质情况,测试指标有CODMn、TN、TP、NH+4-N、NO-3-N、NO-2-N、pH值、溶解氧含量。根据各种指标的去除率,探讨植物/仿生植物体系对水体中各种污染物的去除机制。在连续监测期间,随着取样的进行,水箱中的水随之减少,为了确保水箱中的水量均匀,实时从人工湖取水补充,蒸发水用重蒸馏水补充。
1.4 样品的采集与分析
在试验期间,每次按3点法虹吸取水方式从水面下20 cm处各取100 mL水,混合均匀后成1个待测样品,随后立即进行水质指标的分析。待测水样的NH+4-N浓度采用纳氏试剂法测定;TN浓度采用碱性过硫酸钾消解-紫外分光光度法测定;TP浓度采用钼酸铵分光光度法测定;NO-3-N浓度采用酚二磺酸光度法测定;NO-2-N浓度采用N-(1-萘基)-乙二胺光度法测定;COD采用高锰酸盐指数法测定;pH值采用PHS-3C pH计测定;溶解氧含量、温度采用YSI-55型溶解氧仪测定。
1.5 数据分析
试验数据用Origin 8.0进行处理。
2 结果与分析
2.1 对水体氮素去除效果的分析
由图1可知,1~6号组合系统对NH+4-N具有良好的去除效果,在试验初期(0~6 d),NH+4-N质量浓度急剧下降,分别由最初的1.174、0.631、1.285、0.714、0.616、0.870 mg/L降至0.053、0.043、0.103、0.007、0.020、0.154 mg/L,分别降低了1.121、0.588、1.182、0.707、0.596、0.716 mg/L,去除率分别达到95.49%、93.19%、91.98%、99.02%、96.75%、82.30%,与对照组(去除率为58.5%)之间差异明显。在随后的10~60 d,NH+4-N 质量浓度均在较低的范围内波动,在36 d时,各复合系统的NH+4-N质量浓度有略微升高,为0.09 mg/L,这可能由于氮元素的转化是一种可逆的过程,在试验前期,植物大量吸收NH+4-N,而在试验后期,水中的氨氮质量浓度过低,植物又将已吸收但未来得及供其生长的氮元素重新以NH+4-N 的形式释放到水中。综上可见,几组复合系统对NH+4-N的去除率均呈现出先迅速上升后略微下降的趋势,42 d以后,NH+4-N的质量浓度持续降低,并维持在较低的范圍。以上结果表明,各组合系统在试验前期对水体中的氨氮均有良好的去除效果,随后在短时间内有略微下降;后期各组合系统中的氨氮质量浓度维持在较低的范围。可见,由于仿生植物的存在,各组合系统具有良好的抗干扰能力。
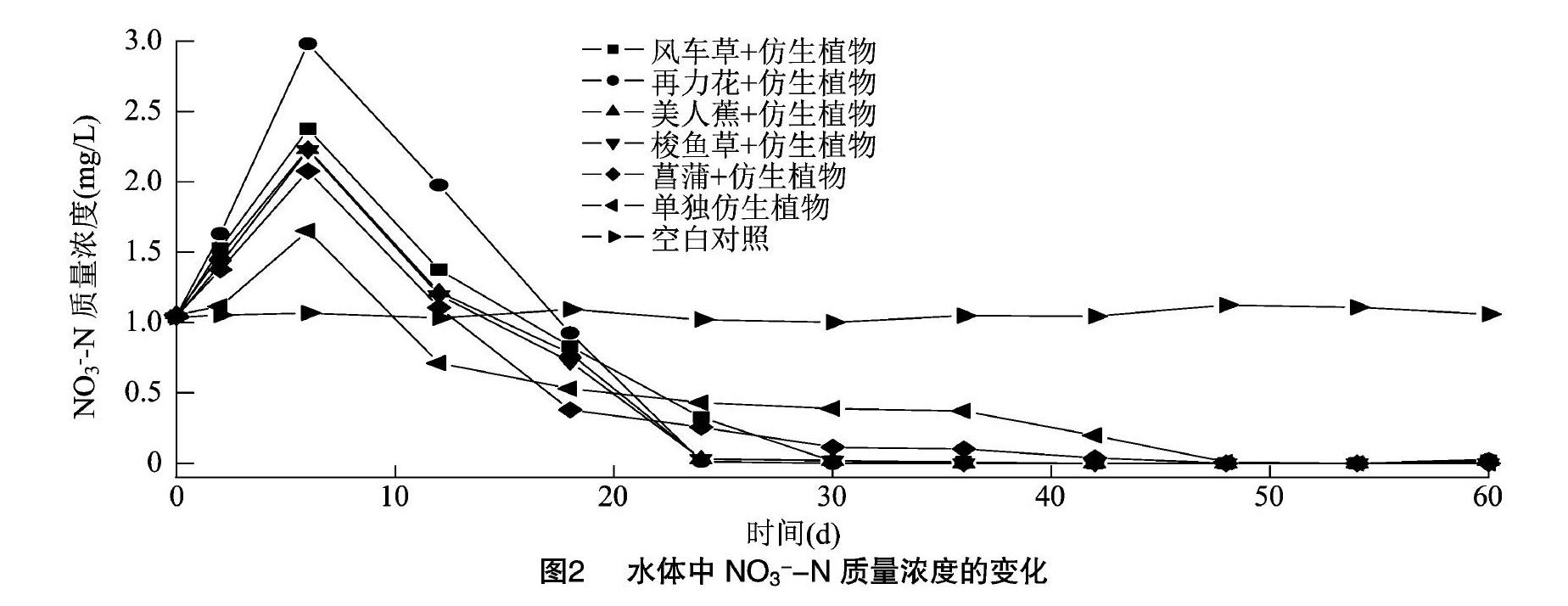
硝态氮主要是由水中本来含有的NO-3-N及硝化菌通过硝化反应生成的NO-3-N组成的, 水体中NO-3-N的去除依靠植物吸收和微生物的反硝化作用[8]。由图2可以看出,在试验初期(0~6 d),除空白对照组外,其他组的NO-3-N质量浓度均有不同程度的上升,而单独仿生植物组NO-3-N质量浓度的上升速率要明显小于其他复合系统,这可能是因为硝化作用需要消耗大量氧气,而单独的仿生植物缺少植物的释氧作用,使得水中溶解氧不足,硝化作用有限[9]。各组合系统的NO-3-N 质量浓度在试验前期均有不同程度的升高,可能是由于微生物的硝化作用远远大于植物的吸收与微生物的反硝化作用而造成NO-3-N质量浓度降低,这与图1中NH+4-N质量浓度在试验前期由于硝化作用迅速下降的规律一致。试验进行到10 d以后,NO-3-N质量浓度开始下降,试验进行到30 d时,除菖蒲+仿生植物的4种组合系统中的NO-3-N已经达到较低质量浓度,维持在0.081~0.151 mg/L,对NO-3-N质量浓度的削减量分别达到0.882、0.936、0.971、0.989 mg/L,效果明显好于单独的仿生植物及空白组,说明组合系统中植物吸收和微生物的反硝化速率远远大于微生物的硝化速率,菖蒲组合系统及单独仿生植物对NO-3-N质量浓度的去除速率相对缓慢,试验进行到50 d时,NO-3-N质量浓度降至检测限以下。综上可见,几种组合系统对NO-3-N的去除效果排序为菖蒲+仿生植物>梭鱼草+仿生植物>美人蕉+仿生植物>风车草+仿生植物>再力花+仿生植物>单独仿生植物>空白对照。
水体中的NO-2-N主要来源于天然存在的NO-2-N以及亚硝化菌的亚硝化反应。由图3看出,系统中的NO-2-N质量浓度始终保持在较低水平,变化趋势不明显,在试验初期有略微上升,这可能是由水体中亚硝化菌的亚硝化反应造成的;6 d以后,水体中的NO-2-N质量浓度开始下降,水中的硝化细菌将NO-2-N转化为NO-3-N;试验进行到12 d以后,NO-2-N质量浓度由最初的0.01~0.03 mg/L降低到0.003 mg/L以下(未检测出),各组合系统对NO-2-N 的去除率接近100.00%。
2.2 对水体中TP去除效果的分析
一般来说,浮床系统对磷的去除主要包括植物的吸收、沉降、拦截与基质的吸附、微生物的固定等[6]。如图4所示,各试验组对TP的去除效果变化明显。在0~36 d内,各组合系统的TP质量浓度持续下降,分别由最初的[KG*3]0.12~0.21[KG*3]mg/L降至0.006 mg/L以下,平均去除率达到95%以上,相对于初始质量浓度,降低了0.094~0.204 mg/L。分析其原因可能有以下几点:(1)植物根部可吸收TP,并将其转化为自身的营养物质;(2)仿生植物中的聚磷菌吸收并同化了一部分TP;(3)基质填料的特殊结构可以吸附颗粒性磷,相比于其他组合系统,单独的仿生植物对TP的去除效果只是去除速度相对缓慢,最终的去除率基本相当,说明植物+仿生植物系统对水体中TP的去除主要是仿生植物起主导作用。在随后的37~48 d内,各系统的TP质量浓度略微升高,其原因可能有3个方面:(1)试验后期植物有不同程度的衰亡,影响了植物根部对TP的吸收;(2)后期水中溶解氧浓度降低,水体呈厌氧环境,可能发生了厌氧释磷现象;(3)水中pH值降低,聚磷菌在厌氧条件下受pH值的影响很大,因为pH值降低后,有利于磷的释放[10]。总体看出,TP浓度的变化趋势与郑立国等研究组合型生态浮床对水体中氮磷的吸收能力得出的结论[11]相似。
2.3 对水体中CODMn去除效果的分析
污水中的污染物是通过微生物的降解和植物根系的截留来去除的,其中微生物降解起主导作用。由图5可知,各试验组对CODMn的去除率变化趋势一致,起初都不稳定,60 d时,各组合系统对CODMn的去除率维持在30%左右,各组间的差异不明显,单独仿生植物与其他复合系统相比无明显差异,进一步验证了微生物在COD去除上的主导作用,这与王郑等的研究结果[12]相吻合。
2.4 其他水质指标的变化情况
用YSI-55型溶解氧仪对溶解氧量的测定结果显示,试验水中的溶解氧质量浓度变化不大,呈逐渐降低的趋势。试验开始前,对每个水箱分别进行曝气,溶解氧质量浓度维持在4.26~6.49 mg/L,经过60 d的试验,溶解氧质量浓度降低至2.54~2.98 mg/L,此溶解氧环境不太利于反硝化脱氮的进行,这与试验过程中发现TN质量浓度几乎无变化的试验结果保持一致。采用PHS-3C pH计测定试验过程中的pH值变化,结果表明,各试验组的pH值变化不明显,总体呈略微下降的趋势,这是因为试验过程中的NH+4-N质量浓度逐渐降低,化学平衡NH+4+H2O→NH3·H2O+H+向右移动,H+质量浓度增加,导致pH值降低。
3 结论
各复合系统对水体中污染物有较好的处理效果,并且处理效率明显高于仿生植物对照组和空白对照组,经过60 d的运行,5种水生植物+仿生植物处理组对NH+4-N、NO-3-N、NO-2-N、TP、CODMn的平均去除率分别达到了93.12%、88.10%、100.00%、95.00%、30.00%,可见仿生植物在污染物的去除中起主导作用。各种浮床植物在污染物去除中的总体趋势一致,但是不同植物在去除不同污染物的过程中有略微差异,在NH+4-N和CODMn的去除過程中,各种植物对应的浮床系统去除效应差异不明显,但在NO-3-N、NO-2-N和TP的去除过程中,菖蒲+仿生植物的效果最好,降解速度最快,因此菖蒲+仿生植物复合系统可以作为复合型生态浮床系统的首选。
植物和仿生植物的结合,不但充分发挥了水生植物和微生物各自的优势,可明显提高污染物的降解效率,实现水中各类污染物的快速降解,且投资低、运行成本低、环境效益好,还兼具一定的景观效果,具有很好的应用价值。
参考文献:
[1]李亚娟. 组合生态浮床设计及强化水体污染物降解试验研究[J]. 水资源开发与管理,2018(9):33-38.
[2]贾锐珂,王晓昌,宋 佳. 多元组合系统净化富营养化水体的示范工程[J]. 环境工程学报,2018,12(3):975-984.[HJ2.12mm]
[3]Zhu L D,Li Z,Ketola T. Biomass accumulations and nutrient uptake of plants cultivated on artificial floating beds in Chinas rural area[J]. Ecological Engineering,2011,37(10):1460-1466.
[4]Zhu B,Fitzgerald D G,Mayer C M,et al. Alteration of ecosystem function by zebra mussels in Oneida Lake:impacts on submerged macrophytes[J]. Ecosystems,2006,9(6):1017-1028.
[5]Zhao F L,Shu X,Yang X E,et al. Purifying eutrophic river waters with integrated floating island systems[J]. Ecological Engineering,2012,40(3):53-60.
[6]汪松美,周晓红,储金宇,等. 空心菜浮床+仿生植物系统对污染物去除效果[J]. 环境科学与技术,2013,36(3):79-82.
[7]戴谨微,陈 盛,曾歆花,等. 复合型生态浮床净化污水厂尾水的效能研究[J]. 中国给水排水,2018,34(3):77-81.
[8]徐秀玲,陆欣欣,雷先德,等. 不同水生植物对富营养化水体中氮磷去除效果的比较[J]. 上海交通大学学报(农业科学版),2012,30(1):8-14.
[9]段金程,张毅敏,高月香,等. 复合强化净化生态浮床对污水中N、P的去除效果[J]. 生态与农村环境学报,2013,29(4):422-427.
[10]陈丽丽,李秋华,高廷进,等. 模拟生态浮床种植6种水生植物改善水质效果研究[J]. 水生态学杂志,2012,33(4):78-83.
[11]郑立国,杨仁斌,王海萍,等. 组合型生态浮床对水体修复及植物氮磷吸收能力研究[J]. 环境工程学报,2013,7(6):2153-2159.
[12]王 郑,崔康平,许为义,等. 组合型生态浮床处理农家乐污水[J]. 环境工程学报,2016,10(1):455-460.

