河蟹土池生态育苗敞池培养褶皱臂尾轮虫Brachionus plicatilis的技术
邵力 肖佳华 宋小平 闵元棋 杨家新
摘要:土池生态育苗是目前江苏沿海河蟹育苗的主导模式。通过敞水池塘开放式培养天然饵料(微藻-轮虫)达到生产河蟹苗种的目的。敞池培养海水褶皱臂尾轮虫(Brachionus plicatilis)即在生物饵料培育过程中,通过添加培育天然饵料微藻和补充外源性饵料按照一定配比提高轮虫生产密度,延长轮虫高峰期持续时间,实现河蟹“饵料微藻-轮虫-河蟹幼苗”的土池生态育苗良性生产。通过在露天培育土池中,加入经过发酵的酵母悬液和无机氮肥(尿素)溶解液的方式,使轮虫的高峰期(>1 200 ind./mL)时间维持5~6 d,最大密度达到3 320±35.78 ind./mL,比对照池最大密度(1 023±53.30 ind./mL)高出近2倍,由此可见,酵母加无机肥培养生物饵料的方式能相对缩短褶皱臂尾轮虫达到峰值的时间,并能明显提高种群的密度和延长轮虫高峰期时间。
关键词:河蟹;育苗;微藻;褶皱臂尾轮虫;酵母;尿素;密度
中图分类号: S963.21+4文献标志码: A
文章编号:1002-1302(2020)07-0198-05
褶皱臂尾轮虫(Brachionus plicatilis)多数分布在盐度较高的河口和近海区域,具有适应力强、生长快、游动缓慢等特点,适合大规模人工培养作为水产动物的开口生物饵料。由于轮虫在水体中分散性好、营养价值高、无残饵污染,能显著提高育苗成活率和改善苗种品质,褶皱臂尾轮虫是海产动物育苗不可或缺的开口饵料之一[1-2]。
江苏是我国中华绒螯蟹(Eriocheir sinensis)育苗和养殖大省,大眼幼体产量占全国年总产量的60%以上[3]。中华绒螯蟹人工育苗技术的突破始于土池育苗,20世纪90年代中后期,以赣榆模式为代表的集约化育苗占据主导地位[4],但缺乏成熟的生物饵料生产技术作为保障,受多种因素影响,集约化育苗模式重新被土池生态育苗技术所替代。生物饵料(轮虫)的生产技术仍然是河蟹土池生态育苗的共性关键技术难题。主要表现如下:
(1)池塘资源占用过大。江苏省是我国河蟹苗种的主要产区之一,土池生态育苗规模稳定在2 000~2 600 hm2左右,生产上一般需按面积比2 ∶1配置生物饵料池(主要是轮虫饵料池),其中用于生物饵料的池塘约1 300~2 000 hm2。
(2)粗放生产,产量波动大。河蟹土池育苗是利用滩涂土池露天生产大眼幼体。饵料微藻来源于天然海水自带的藻类,轮虫主要来源于土池底泥沉积物中的休眠卵自然萌发,因此,生产过程无固定的优势种(饵料微藻)。目前,绝大部分企业均采用较为粗放的靠天收模式生产生物饵料[5]。这种模式的缺点在于:饵料池轮虫进入高峰期后一次采收,之后轮虫种群无法再次进入高峰期,育苗期间,对生物饵料大量需求的时间段集中在10~20 d,具有较强的时效性。因此,尽管已经配置了专门饵料生产池,粗放式生产提供的生物饵料依然难以满足生产所需。
(3)潜在环境风险突显。目前,使用发酵鸡粪作为基肥,利用海水天然饵料微藻生产轮虫是育苗企业最常见的生产模式[6]。该模式最大的问题是鸡粪携带的病原菌加入育苗水体以及畜禽养殖中抗生素的药物残留可能会通过食物链传递至蟹苗,給河蟹育苗甚至整个河蟹产业带来巨大的潜在风险。同时,饵料池的尾(废)水的排放与目前环境优先的政策相悖。
因此,针对江苏河蟹土池生态育苗中共性关键技术,笔者于2018年4—5月在江苏省射阳县蟹苗养殖基地试验初探并取得初步成果,现将试验的主要技术要点和过程总结如下。
1 池塘条件
2口池塘分别作为对照池和试验池,塘口均位于射阳东海海岸线,旁呈东西走向,水量充沛可靠,水质清新且无农药等污染源。土为黏性土壤。池塘呈锅底形,平均深度2 m,水深最深处达3 m,每口池塘的面积约1 hm2。
1.1 基肥
先对池塘进行清塘处理,方法为使用漂白粉30~50 g/m3,搅拌底泥,暴露于漂白粉环境处理3 d;待消毒处理结束后引进新鲜过滤海水,海水经过鸡粪堆积口注入池塘,鸡粪作为基肥一同注入轮虫池进行肥水,鸡粪使用量为60 m3/hm2;之后,分别在对照池和试验池中接入等量的海水小球藻培养。
1.2 轮虫接种
镜检,待藻类密度达到约1×106 ind./mL时,分别在对照池和试验池中接入褶皱臂尾轮虫,接种密度约400 ind./mL。
1.3 培养管理
试验池培育过程使用尿素(主要成分为碳酰胺,江苏晋煤恒盛化工股份有限公司生产)作为追肥肥料,并补充活化处理的酵母悬液(安琪酵母股份有限公司生产)。
培养期间,根据池塘浮游生物变化特点,使用尿素追肥1次,尿素使用量为90 kg/hm2左右,溶解后全池泼洒。之后,为防止饵料微藻不足,利用活化酵母补充,酵母用量60 kg/hm2左右,酵母活化按质量比100 ∶10 ∶1的比例添加水、酵母和红糖,激活10 h,摇匀,静置后取上清液泼洒,全池泼洒。在试验期间未施用其他肥料,通常不换水,2个池塘不相通。
2 样本采集与数据分析
采样时间为每天08:00,在池塘四角和中间设置采水点,使用YSI水质分析仪现场测定理化因子。用13号和25号浮游生物网采集浮游植物和轮虫进行定性定量分析,每个采水点采集的10 L水样过滤浓缩至50 mL,用福尔马林溶液固定并带回室内镜检,检测方法参照《淡水浮游生物研究方法》[7],试验周期为8 d。
采用SPSS 16.0中的单因素方差(one-way ANOVA)对数据进行统计分析,并进行多重比较,同时采用SigmaPlot 10作图。
3 结果与分析
3.1 溶氧量、盐度、电导率变化
3.1.1 溶氧量变化
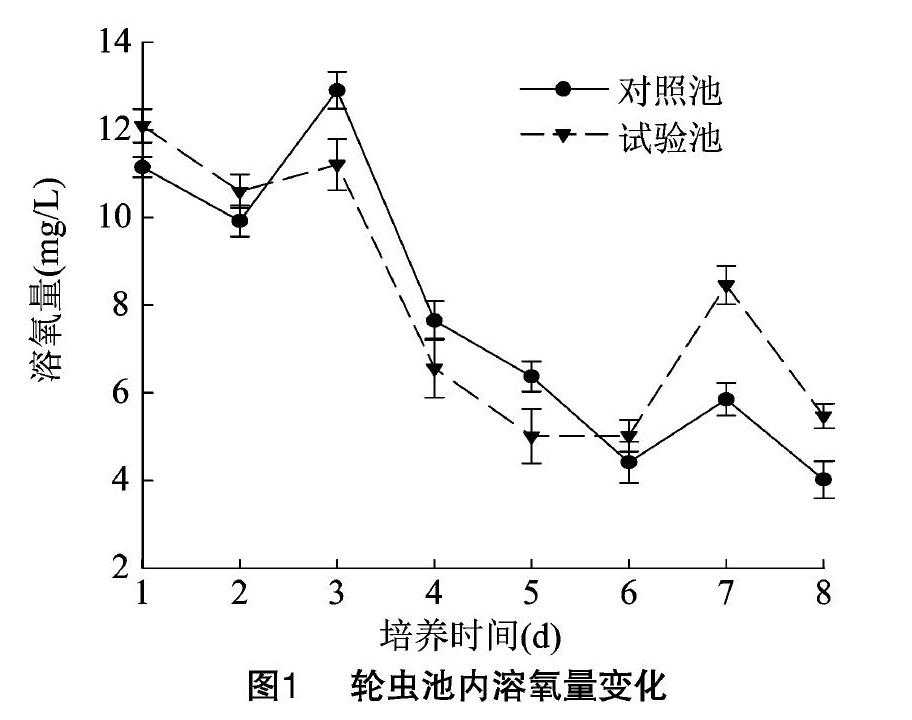
试验期间,对照池和试验池的溶氧量变化趋势基本一致,分别在培养3、1 d达到峰值[(12.90±0.42) mg/L 和(12.09±0.38) mg/L],但试验池溶解氧明显低于对照池。高峰期过后从培养6 d 开始试验池的溶氧量高于对照池(图1)。
3.1.2 盐度变化
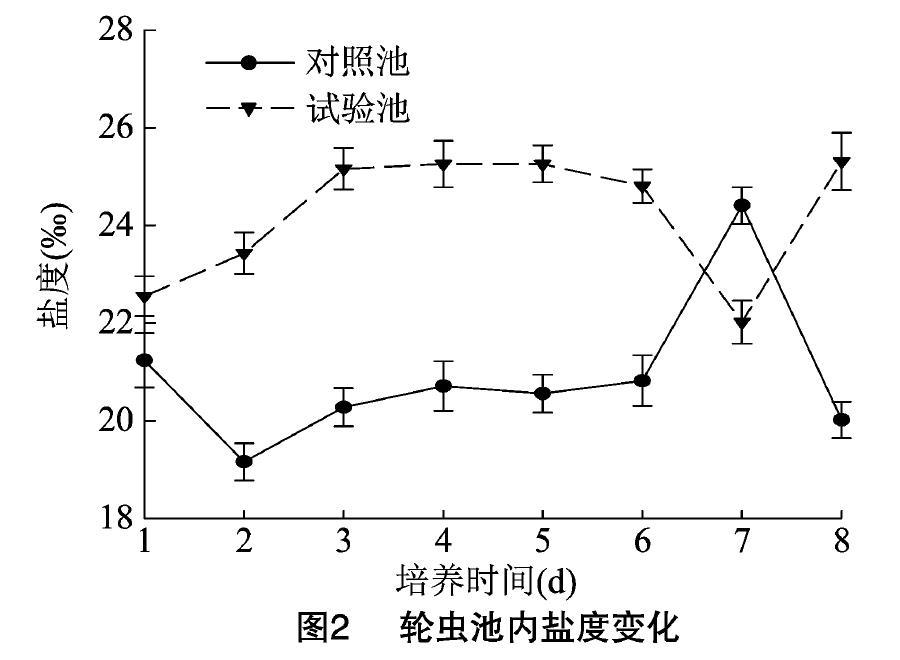
如图2所示,对照池和试验池盐度差异明显,除培养7 d时对照池高于试验池外,其他时间对照池均低于试验池。对照池和试验池分别在培养7、8 d达到最大值[(24.41±0.38)‰和(25.31±0.59)‰],试验池的盐度在试验时间较对照组变化更为稳定。
3.1.3 电导率变化
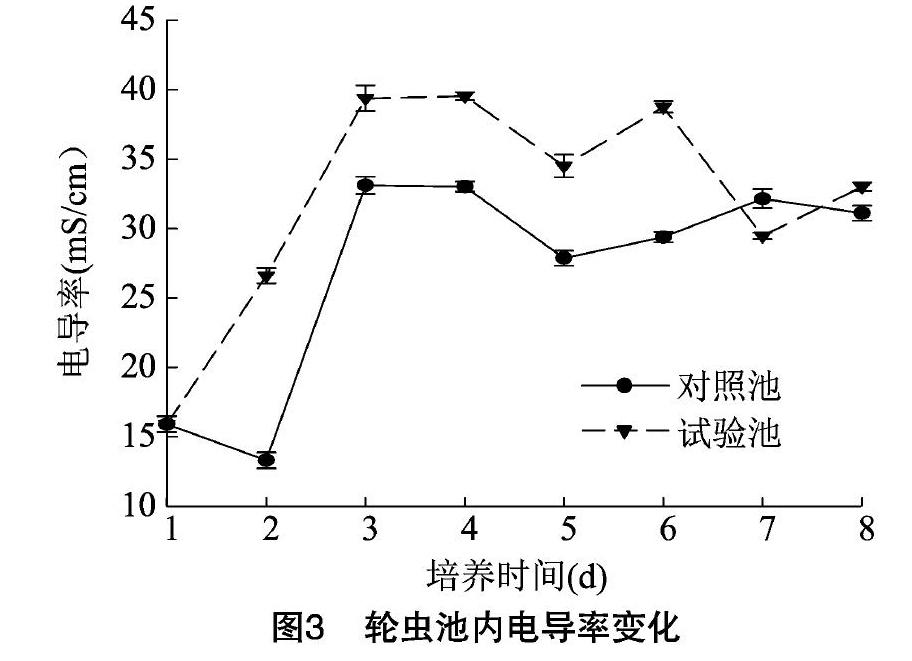
试验池前6 d的电导率均高于对照池,且2组之间差异明显。对照池电导率3 d达到最高值33.11±0.63 mS/cm,试验池4 d达到最高值39.53±0.28 mS/cm,对照池仅在培养7 d时电导率高于试验池(图3)。
3.2 微藻种类组成
在试验的8 d时间内,共检测到常见藻类21种,添加尿素和酵母的试验池的微藻不同種类出现的频率明显多于对照池。培养8 d时对照池和试验池的藻类种类数量达到最大值,对照池11种、试验池18种,藻类组成均以绿藻门为主,硅藻门次之。微藻种类出现频率如表1所示。
3.3 浮游植物生物量和叶绿素含量动态变化
如图4所示,2池浮游植物生物量的变化趋势基本一致。对照池和试验池培养3 d浮游植物生物量均达到最大值[(9.27±0.43) g/L和(10.33±0.51) g/L],且试验池植物生物量远高于对照池。2池在前2 d生物量增长速度最快,且试验池明显快于对照池。2池分别在6 d生物量骤然下降至(2.06±0.33) g/L和(1.16±0.46) g/L。
试验池的叶绿素含量在增速和峰值上明显高于对照池,对照池和试验池分别在培养2、3 d达到叶绿素含量的峰值[(187.1±9.36) g/L 和(209.56±4.10) g/L]。在培养6~8 d,2池的叶绿素变化趋势与浮游植物生物量变化趋势密切相关(图5)。
3.4 轮虫密度
由图6可以看出,接种后,到培养6 d,轮虫密度呈现指数增长,且试验池培养6 d达到高峰期[(3 320±35.78) ind./mL]。对照池滞后,在培养7 d达到峰值(1 023±53.30) ind./mL,试验池轮虫高峰期早于对照池,密度明显高于对照池。在试验的8 d时间内,试验组轮虫在培养4 d开始出现爆发性增长,之后的4 d内,轮虫密度均明显高于对照池,且密度维持在1 000 ind./mL以上,持续时间达5 d,对照组整个试验期间密度维持在1 023 ind./mL 以下。
4 讨论与结论
4.1 尿素和发酵酵母添加对水质及微藻种类的影响
在河蟹育苗过程中,微藻不仅可以作为河蟹早期幼体和轮虫的食物,而且对调节水质也具有重要作用,微藻的种类和密度常是河蟹育苗成功与否的关键[8]。本研究表明:轮虫培养期间,在原有基肥基础上,添加尿素作为追肥,利用活化酵母作为轮虫饵料补充时,会对水体理化因子产生一定影响。通过浮游植物生物量和叶绿素含量分析可以得出,添加尿素追肥可促进土池中藻类的生长。同时,通过藻类组成变化可以看出,微藻种类以及优势种亦随添加无机肥和酵母而发生改变,试验池培养5~8 d微藻的种类明显多于对照组,可能是因为氮是浮游植物细胞内蛋白质、核酸等活性物质的重要组成成分,尿素的添加可以补充氮元素,从而引起微藻生长特性和生化组成的变化。有研究表明,藻类能利用各种形态的氮,如硝酸盐、铵盐、尿素[9-12],但以尿素为氮源最好,硝酸钠次之,氯化铵较差[13]。桑敏等的研究证明,适当增加氮的浓度可以促进微藻的生长,提高微藻产量[14]。磷则作为底物或调节物直接参与植物光合作用[15]。张青田等研究了尿素对几种海洋微藻生长的影响情况,结果表明,尿素对球藻、硅藻等微藻的生长影响极显著,但最适生长的浓度值均不同;同时他们还对N/P值的情况进行了探讨,提出该比值可能和氮态有关[16]。这些研究都表明,尿素的添加会产生一系列的影响,这些影响包括理化因子的变化及其导致的池内微藻种类和优势种的变化。
本研究结果显示,在轮虫池内添加适量的尿素能增加微藻种类多样性,适宜性微藻能促进轮虫的生长繁殖,因此建议在轮虫生产中可以添加适量的尿素。
4.2 尿素和发酵酵母添加对轮虫密度的影响
生物饵料的质量是决定河蟹溞状幼体成活率和生长发育的关键因素之一。褶皱臂尾轮虫是海水鱼类和虾蟹育苗的重要生物饵料,吴学军等认为,由于褶皱臂尾轮虫自身不能合成不饱和脂肪酸,通过酵母可以进行营养强化,而强化的轮虫投喂的溞状幼体在Z5-M阶段的成活率也会更高[17]。
有关酵母对轮虫生长的促进作用也已有相当多的研究,Ricci等的研究表明:在活藻喂食试验中,微藻能促进轮虫的成熟和产卵,而酵母饲料能有限维持轮虫的繁殖状态下及生长;酵母喂食试验中,他们证实除了微藻类,轮虫的食物也可考虑酵母,但单独喂养酵母会导致营养缺乏,而以1 ∶1的方式提供酵母和拟微绿球藻可以使得轮虫的生长速率与全部投喂拟微绿球藻的生长速率基本相同,在没有足够的藻类喂养轮虫时,酵母是有效的轮虫食物替代物[18]。王金秋等的研究也表明酵母和藻类搭配投喂对萼花臂尾轮虫种群的增长速度有较大幅度的提高[19-21],在褶皱臂尾轮虫中也有相似的表现[22-24]。在本研究中,添加尿素和酵母的试验池的轮虫数量远远高于对照池,由此证明:发酵的酵母对轮虫种群密度的增长有明显的促进作用且轮虫的高峰期(>1 200 ind./mL)可维持5~6 d,最大密度可达到(3 320±35.78) ind./mL,比对照池最大密度[(1 023±53.30) ind./mL]高出近2倍。
值得关注的是本试验的3个理化因子(溶氧量、盐度和电导率)。对照池的溶氧量高于试验池,可能是由于试验池轮虫密度远远大于对照池,大量的轮虫需要更多的氧气进行呼吸作用从而导致溶氧量值较低。在盐度方面,徐海龙等认为,盐度在30‰左右时,褶皱臂尾轮虫的种群密度和增殖率最大,盐度超过30‰时,褶皱臂尾轮虫和总种群密度呈下降趋势,而处于15‰~30‰时,轮虫密度也随盐度的升高而升高[25-27]。在本试验中,由于添加了无机肥尿素和酵母,盐度值明显增高,且明显高于对照池(盐度低于30‰),轮虫种群密度相应增大,试验池轮虫密度远高于对照池,二者呈正相关关系,这与之前的研究成果一致。电导率能反映水体整体的营养水平,鸡粪、尿素和酵母的添加使水体整体呈富营养化特征,水电导率处于较高水平。王魏根等人认为,在水体整体稳定的情况下,高电导率说明营养盐多,有利于水体浮游生物的繁殖,轮虫的密度也会增加[28-31]。本试验中试验池的电导率明显高于对照池,轮虫密度也明显高于对照池,与之前的研究结果一致。
因此,本研究的结果显示,在露天池塘培育轮虫时,在原有基肥基础上,添加尿素作为追肥,利用发酵酵母作为轮虫饵料补充的方式能相对缩短褶皱臂尾轮虫达到峰值的时间,并能明显提高种群密度和延长高峰期时间。
综合比较对照池和试验轮虫池的各种理化因子、微藻种类动态变化、轮虫密度等,笔者认为:发酵酵母结合无机肥(尿素)培养生物饵料的方式能够调节水质,促进微藻种类多样化和轮虫的生长,能够有效維持轮虫的高峰期且降低环境负荷,符合当期集约化生产和河蟹育苗的需要和未来发展的趋势。
参考文献:
[1]杨宇晴,刘 苏,张海发,等. 海水轮虫高密度培养技术[J]. 海洋与渔业,2017(7):66-67.
[2]罗永巨. 海水轮虫高密度培养技术[J]. 广西水产科技,1997(1):12-15.
[3]王倩倩. 江苏省河蟹养殖业竞争力研究[D]. 上海:上海海洋大学,2012:3-5.
[4]陈 威,黄金田. 江苏河蟹土池生态育苗关键技术点[J]. 中国水产,2017(12):79-81.
[5]汤海燕. 露天土池二级培育河蟹苗技术[J]. 水产养殖,2000(6):7-8.
[6]李色东,刘 涛. 饵料微藻在南美白对虾育苗中的应用[J]. 海洋与渔业,2014(11):62-63.
[7]章宗涉,黄祥飞. 淡水浮游生物研究方法[M]. 北京:科学出版社,1991.
[8]李信书. 微藻在河蟹工厂化育苗中的意义及应用[J]. 苏盐科技,2001(2):18-18.
[9]丁彦聪,高 群,刘家尧,等. 环境因子对小球藻生长的影响及高产油培养条件的优化[J]. 生态学报,2011,31(18):5307-5315.
[10]张李荣,杨海明,王志跃. 益生菌对蛋雏鸡生长性能、血清生化指标、免疫器官指数的影响[J]. 中国饲料,2017(11):18-21.
[11]郑维发,王雪梅,王义琴,等. 四种营养盐对舟形藻(Navicula) BT001生长速率的影响[J]. 海洋与湖沼,2007,38(2):157-162.
[12]Fan C,Glibert P M,Burkholder J M. Characterization of the affinity for nitrogen,uptake kinetics,and environmental relationships for Prorocentrum minimum in natural blooms and laboratory cultures[J]. Harmful Algae,2003,2(4):283-299.
[13]陆德祥,张 敏,王小红. 不同氮源对球等鞭藻增殖的影响[J]. 水产养殖,2004,25(3):21-23.
[14]桑 敏,刘健晖,张成武,等. 尿素浓度对粉核油球藻生长和二十碳五烯酸积累特性的影响[J]. 中国海洋药物,2011(2):34-38.
[15]李 斌,欧林坚,吕颂辉. 不同氮源与海洋卡盾藻生长和硝酸还原酶活性的影响[J]. 海洋环境科学,2009,28(3):264-267.
[16]张青田,胡桂坤,董双林. 尿素对三种海洋微藻生长影响的初步研究[J]. 海洋通报,2004(5):92-96.
[17]吴学军,杨家新,姜爱兰. 六株海洋微藻强化的酵母轮虫对中华绒螯蟹溞状幼体的影响[J]. 水产养殖,2009,30(10):55-58.
[18]Ricci C,Snell T W,King C E . Rotifer symposium V[M]. Springer Netherlands,1989:12-15.
[19]王金秋,李德尚. 酵母及与藻类搭配对萼花臂尾轮虫饵料效果的研究[J]. 应用生态学报,1998,9(3):301-304.
[20]王金秋. 影响萼花臂尾轮虫种群增长的生态学因子的研究──温度和饵料密度的影响[J]. 海洋湖沼通报,1995(4):21-27.
[21]王金秋,李德尚,曹吉祥. 5种淡水浮游藻对萼花臂尾轮虫饵料效果的比较研究──藻的最适投喂密度及轮虫相应的种群增长[J]. 海洋与湖沼,1998,29(1):15-21.
[22]王金秋,潘连德,郭 新. 酵母及藻类对褶皱臂尾轮虫培养效果的比较研究[J]. 水产科技情报,2002,29(3):99-102.
[23]田景波,孙广德,张庆文,等. 不同饵料对褶皱臂尾轮虫种群生长繁殖的影响[J]. 中国水产科学,1998(4):38-42.
[24]Yong F,Hada A,Yamashita T,et al. Development of a continuous culture system for stable mass production of the marine rotifer Brachionus[J]. Hydrobiologia,1997,358(1/2/3):145-151.
[25]徐海龙,马志华,郭 立,等. 光照、pH及盐度对褶皱臂尾轮虫培养效果的影响[J]. 水产科学,2013,32(2):85-88.
[26]王 堉,梁亚全. 褶皱臂尾轮虫(Brachionus Plicatilis O.F. Müller,1786)繁殖培养的研究[J]. 渔业科学进展,1980(1):27-48.
[27]李洪武,宋培学. 海洋浮游生物学[M]. 合肥:中国科学技术大学出版社,2012:21-22.
[28]王魏根,李永民,陈 杰. 沙颍河阜阳段轮虫群落结构及其周年变化[J]. 新余学院学报,2018(1):19-24.
[29]王家楫. 中国淡水轮虫志[M]. 北京:科学出版社,1961:13-15.
[30]葛慕湘,朱文进,苏咏梅,等. 盐度突降对褶皱臂尾轮虫存活及休眠卵形成的影响[J]. 水利渔业,2008,28(4):46-47,54.
[31]陈 婕,张 波. 温度、盐度、pH值对褶皱臂尾轮虫休眠卵孵化率的影响[J]. 水产科学,2009,28(2):100-102.

