一株拮抗水稻条斑病菌的蜡样芽孢杆菌的分离和鉴定
李生樟 刘昭 杨瑞环 陈颖 钟佑宁 陈路生 屈伊凝 陈功友 邹丽芳

摘要:水稻条斑病菌(Xanthomolias oryzae pv. oryzicola,Xoc)侵染水稻,引起细菌性条斑病(bacterial leaf streak,简称BLS),严重威胁水稻的安全生产。为筛选防治BLS的生防细菌,以Xoc的模式菌株RS105为靶标菌,采用平板稀释和抑菌圈法,从大白菜根际土壤中分离筛选到具有拮抗活性的细菌菌株512。通过形态学、生理生化特征以及16S rDNA和gyrB序列分析,鉴定菌株512为蜡样芽孢杆菌,命名为Bacillus cereus 512。抑菌试验显示,B. cereus 512对黄单胞菌属不同种细菌的拮抗活性存在较大差异,其中对水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae,简称Xoo)的拮抗效果最强。发酵液的稳定性试验表明,抑菌活性物质对高温和蛋白酶不敏感,耐强碱不耐强酸。在原丰早水稻品种上,针对水稻条斑病防治的初步试验结果显示,B. cereus 512对Xoc在水稻叶片上引起的水渍症状的扩展具有明显的抑制作用。综上所述,B. cereus 512能够拮抗Xoc和Xoo,在BLS的生物防治中将具有较大的应用潜力。
关键词:水稻条斑病菌;水稻白叶枯病菌;蜡样芽孢杆菌;生物防治;拮抗活性
中图分类号: S435.111.4+9文献标志码: A
文章编号:1002-1302(2020)07-0127-09
水稻条斑病菌(Xanthomolias oryzae pv. oryzicola,简称Xoc)是水稻黄单胞菌种下的变种,能侵染水稻,引起水稻细菌性条斑病(bacterial leaf streak,简称BLS)[1]。在我国南方水稻产区,条斑病已逐渐成为水稻上的第四大病害,每年造成10%~30%的减产,严重威胁水稻的安全生产[2-3]。Xoc与水稻的互作不符合基因对基因关系,一些含有xa5[4]、Xa23[5]和Xa21[6]等抗性基因的水稻品种对白叶枯病菌(X. oryzae pv. oryzae,简称Xoo)具有较好抗性,但对Xoc均表现为感病。我国的一些杂交水稻品种对Xoc表现为感病,其中有些为高度感病[7]。目前,BLS的防治主要依赖于化学药剂,如噻唑类杀菌剂等[8]。这些化学药剂的使用容易使病原菌产生抗药性,且可破坏生态环境[9]。近年来,随着生物防治措施的提倡和推广,从农业生态环境中筛选拮抗微生物来防治BLS的研究成为热点。
目前,应用最广泛的生防细菌主要包括链霉菌(Streptomyces spp.)、假单胞杆菌(Pseudomonas spp.)以及芽孢杆菌(Bacillus spp.)等[10],其中芽孢杆菌因具有良好的抗逆性和抗菌活性物质多样性被广泛应用于植物病害的生物防治。蜡样芽孢杆菌(Bacillus cereus)是一种需氧的芽孢杆菌,主要分布于水、土壤、植物根围、动物肠道等环境中,是引起食物污染和食物中毒的主要病原菌。目前有研究表明,B. cereus是土壤中的优势菌,能促进植物生长,可作植物根际促生菌(plant growth promoting rhizobacteria,简称PGPR)[11-12]。B. cereus能分泌多种拮抗真菌、细菌和线虫的活性物质,被广泛应用于植物病害的生物防治[13]。在真菌病害的防治中发现,B. cereus具有广谱的抗菌活性,能够有效抑制小麦全蚀病菌(Colletotrichum acutatum)[14]、番茄灰霉病菌(Botrytis cinerea)[15]、枇杷果实炭疽病菌(Colletotrichum gloeosporioide)[16]、玉米穗腐病菌(Fusarium verticillioides)[17]、百合叶枯病菌(Botrytis elliptica)[18]、苜蓿腐烂病菌(Phytophthora medicaginis)[19]等多种病原真菌的生长。在线虫病害的防治中发现,B. cereus能够产生2种拮抗南方根结线虫(Meloidogyne incognita)的活性物质,同时,能够诱导番茄植株产生系统获得抗性[20-21]。目前,关于B. cereus对水稻黄单胞菌具有拮抗作用的报道较少。
本研究从大白菜根际土壤中分离筛选对Xoc具有拮抗作用的生防菌并对其进行鉴定,分析其对2种水稻黄单胞菌的拮抗作用以及拮抗活性物质的稳定性,初步确定其在水稻组织中是否能够抑制Xoc引起的水渍状病斑的扩展,以期为BLS的生物防治以及后续生物农药的研制提供理论基础。
1 材料与方法
1.1 菌株
本研究所用的菌株512是从福建省三明市尤溪县西滨镇西洋村大白菜根际土壤中分离得到的。供试的Xoo、Xoc菌株由本试验收集或者从各省水稻病样中分离获得;其他植物病原黄单胞菌为笔者所在实验室保存的菌株(表1),这些菌株在营养琼脂(NA)培养基上和营养肉汤(NB)培养基中,于温度为28 ℃条件下培养。
1.2 拮抗细菌的分离和鉴定
每份土样称取10 g,置于三角錐形瓶中,加入90 mL灭菌水和少许钢珠,在28 ℃、200 r/min条件下振荡培养20 min,室温静置10 min,制成土壤菌悬液。吸取1 mL菌悬液,依次稀释成10-3、10-4、10-5 3个浓度梯度[22]。吸取100 μL菌液,均匀涂布在已加入200 μL指示菌株RS105的NA培养基平板上,28 ℃培养24 h后,观察抑菌圈的形成情况,挑出对RS105具有抑菌活性的菌落,纯化为单菌落。吸取50 μL单菌落培养后的菌液,调整其浓度,使其D600 nm(在600 nm处的吸光度)为2.0,进行抑菌活性复筛试验,保存抑菌圈直径大于4 cm的菌落,进行后续菌株的鉴定。菌株512是从编号为51的土样中获得的,土样于2018年2月21日采集自福建省三明市尤溪县西滨镇西洋村大白菜根际土壤。
将菌株512送至中国典型培养物保藏中心(武汉大学)进行形态学观察和生理生化特性测定。根据《常见细菌系統鉴定手册》[23]对其产酸产气、柠檬酸利用、糖醇类发酵、色氨酸脱氨酶活性等生理生化特性进行分析。提取菌株512的基因组DNA,采用细菌16S rDNA基因的特异性引物27F和1492R以及持家基因gyrB的引物进行PCR扩增。PCR产物纯化后,送至铂尚生物技术(上海)有限公司进行测序分析。利用NCBI网站的BLAST功能对所测的16S rDNA和gyrB序列进行同源性分析,确定亲缘关系,最后使用MEGA(6.0)软件的近邻(neighbor_joining)法[24]构建系统发育树。
1.3 B. cereus 512对黄单胞菌拮抗活性的分析
采用牛津杯法测定B. cereus 512对15株Xoc菌株、12株Xoo菌株以及9株其他黄单胞菌属病菌菌株的拮抗效果。将各供试黄单胞菌单菌落接种于NB培养基中,在温度为28 ℃条件下培养24 h后,调节菌液浓度,使其D600 nm 为2.0,吸取200 μL菌液加入到冷却至45 ℃ 左右的NA培养基中,充分混合。向牛津杯中加入50 μL B. cereus 512发酵液,每个处理设3次重复,置于温度为28 ℃条件下培养24 h,测量和统计抑菌圈直径大小。数据采用Excel 2010和SPSS 22.0软件进行统计分析。
1.4 抑菌活性物质的稳定性分析
将B. cereus 512单菌落接种于3 mL NB中,在28 ℃、180 r/min摇床中培养24 h,得到发酵液,调节菌液浓度,使其D600 nm 为2.0。在检测蛋白酶培养基平板中央放置1个牛津杯,向牛津杯中注入50 μL B. cereus 512发酵液,在28 ℃培养箱中正向培养2 d后观察结果,并测定酶解圈的直径,试验重复3次。
将B. cereus 512单菌落接种于3 mL NB中,在温度为28 ℃、转速为180 r/min摇床中培养24 h,得到发酵液。根据参考文献[26]、[27]的方法分别检测发酵液经过蛋白酶、酸碱和热处理后的抑菌活性。向发酵液中分别加入胰蛋白酶、胃蛋白酶和蛋白酶K,使酶的最终浓度为1 mg/mL,37 ℃ 反应1 h,测定不同蛋白酶处理后发酵液对RS105的抑菌活性,以不加入酶的发酵液为空白对照,测量抑菌圈直径。调节菌液的pH值为7.0,在此基础上,用1 mol/L NaOH和1 mol/L HCl调节发酵液的pH值为1、3、5、9、11和13,静置3 h后测定不同酸碱处理后发酵液对RS105的抑菌活性,测量抑菌圈直径。将发酵液分别在40、50、60、70、80、90、100 ℃等 7个不同温度下水浴30 min后立即冷却至室温。用牛津杯法测定不同高温处理后发酵液对RS105的抑菌活性,测量抑菌圈直径,空白对照为未经高温处理(25 ℃)的发酵液。
1.5 对病害的抑制活性
将Xoc野生型菌株RS105和B. cereus 512单菌落接种至5 mL NB中,在温度为28 ℃条件下培养24 h,调节RS105的菌液、B. cereus 512菌液浓度使其D600 nm分别为0.3、1.0。采用2种接种方式进行接种,治疗处理的接种法:利用无针头的注射器将RS105菌液(D600 nm=0.3)注射入水稻叶片中,2 h后再注射B. cereus 512菌液(D600 nm=1.0);预防处理的接种法:先将B. cereus 512菌液(D600 nm=1.0)注射入水稻叶片中,2 h后再注射接种RS105菌液(D600 nm=0.3)。每种方法接种大约10张叶片,连续7 d观察水渍状病斑的形成情况,7 d后统计病斑的长度。其中水稻品种为高感Xoc的原丰早,由湖南农业科学院植物保护研究所肖友伦博士提供,种植于上海交通大学水稻温室中,生长2周左右的水稻苗用于上述接种试验。
2 结果与分析
2.1 水稻条斑病菌拮抗细菌的分离和鉴定
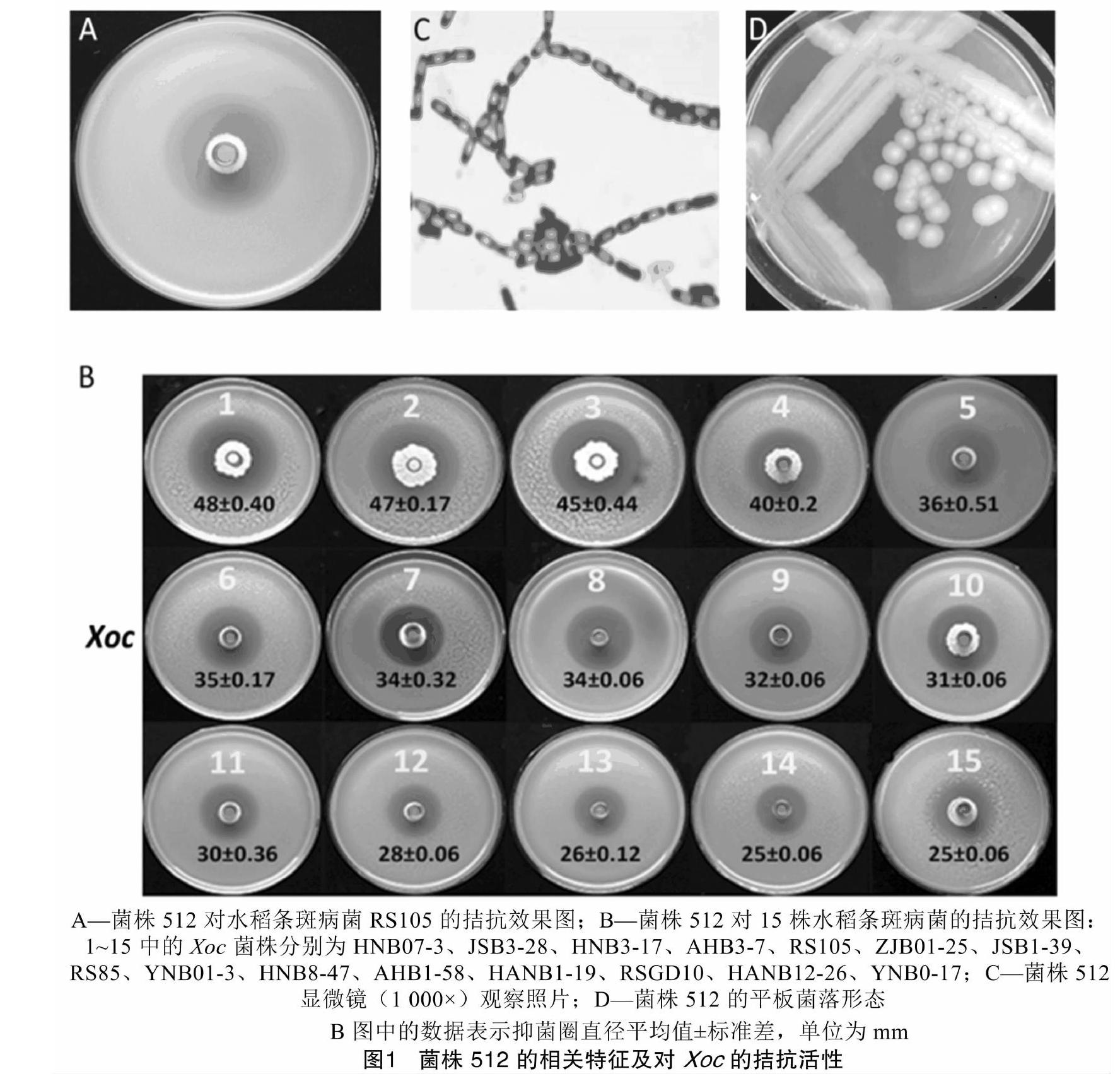
为从植物根际土壤中筛选出能够拮抗Xoc的细菌,从全国各省(市、区)收集了107份土样,以Xoc的模式菌株RS105为指示菌。按照常规的筛选流程筛选了50份土样,获得66株具有拮抗活性的细菌,发现菌株512对RS105的拮抗效果非常明显(图1-A)。为明确菌株512对Xoc的拮抗活性,选取15株具有代表性的Xoc菌株进行测定,结果发现,菌株512对这些菌株都具有拮抗活性(图1-B)。
革兰氏染色反应结果(图1-C)表明,菌株512为革兰氏阳性细菌,细胞呈短杆状,能够产生椭圆形的芽孢,且能运动。在NA培养基上,菌株512能形成乳白色的菌落,菌落表面粗糙、边缘不规则、不透明(图1-D)。进一步生理生化特征分析结果(表2)显示,菌株512能够利用柠檬酸,且能够利用硫代硫酸钠产生H2S、利用丙酮酸盐产生乙酰甲基甲醇,能分泌精氨酸双水解酶、明胶酶;在碳源利用反应中,菌株512能够利用核糖、葡萄糖、果糖、甘露糖、淀粉、糖原等多种碳源。根据《常见细菌系统鉴定手册》,这些生理生化特性与芽孢杆菌具有相似性。将菌株512的16S rDNA序列在NCBI网站上进行BLAST分析,发现其与Bacillus cereus、B. wiedmannii、B. albus等菌株的16S rDNA序列具有100%的同源性,系统进化树分析结果(图2-A)显示,它们具有较高的亲缘关系。进一步选取持家基因gyrB进行分析,序列比对结果显示,菌株512的gyrB与蜡样芽孢杆菌(B. cereus)的gyrB同源性为99%,据其构建的系统发育树结果(图2-B)显示,菌株512与蜡样芽孢杆菌亲缘关系最近。因此,结合菌株的形态、生理生化特征及分子鉴定结果将菌株512确定为蜡样芽孢杆菌(B. cereus),命名为蜡样芽孢杆菌512(B. cereus 512)。
2.2 B. cereus 512对水稻白叶枯病菌及其他黄单脆菌属病菌的拮抗活性
Xoc和Xoo为水稻黄单胞菌的2个致病变种,为检测B. cereus 512是否对Xoo也具有拮抗活性,选取12株Xoo菌株进行分析,结果(图3-A)发现,B. cereus 512对Xoo菌株的拮抗活性非常明显,且明显强于对Xoc菌株,其中对YC7和XZ35的拮抗效果最明显,平均抑菌圈直径分别达到了65、59 mm。这表明B. cereus 512对Xoo和Xoc都具有抑制活性。
为明确B. cereus 512是否对其他植物病原黄单胞菌也具有拮抗活性,选取9株代表菌株进行测定,结果(图3-B)发现,B. cereus 512对香蕉枯萎病菌(X. campestris pv. musacearum,简称Xcm)、豇豆细菌性疫病菌(X. axonopodis pv. vignicola,简称Xav)、[KG*3]辣椒斑点病菌(X.campestrispv.vesicatoria,简称Xcv)以及核桃黑斑病菌(X. campestris pv. juglandis,简称Xcj)具有明显的拮抗活性,对棉花角斑病菌(X. campestris pv. malvacearum)和菜豆细菌性疫病菌(X. campestris pv. phaseoli)具有微弱的拮抗活性,对洋葱细菌性叶枯病菌(X. axonopodis pv. allii)、甘蔗流胶病菌(X. axonopodis pv. vasculorum)和大豆斑疹病菌(X. axonopodis pv. glycines)不存在拮抗活性。这些结果表明,B. cereus 512对黄单胞菌属不同种细菌的拮抗活性存在较大差异,其中对水稻黄单胞菌Xoo和Xoc的效果最为明显。
2.3 B. cereus 512抑菌活性物质的特性分析
进一步分析B. cereus 512抑菌活性物质的稳定性,结果(图4)发现,B. cereus 512能够分泌水解牛奶的蛋白酶,将其发酵液经过蛋白酶K、胰蛋白酶和胃蛋白酶处理后,仍具有拮抗Xoc的活性,据此推测,B. cereus 512拮抗Xoc的活性物质可能不是蛋白类物质。pH值为7时,发酵液具有较好的拮抗活性,在此基础上进行酸碱调节,当pH值为1时,发酵溶液拮抗Xoc的活性显著降低,在pH值为3、5的酸性环境以及pH值为9、11、13等碱性条件下,发酵溶液仍具有较好的抑制Xoc的活性。将发酵液进行40、50、60、70、80 ℃等5种不同高温处理后,其拮抗Xoc的活性与室温(25 ℃)下相比没有明显的变化,在90 ℃和100 ℃ 2种温度处理下,发酵液的拮抗活性丧失。综上所述,B. cereus 512的抑菌活性物质能耐碱不耐强酸,具有热稳定性,能耐90 ℃以下的高温。
2.4 B. cereus 512对BLS水渍症状的抑制作用分析
为测定B. cereus 512对Xoc的抑制效果,利用高感Xoc的原丰早水稻品种,采用苗期注射接种法,在水稻叶片中同时接种B. cereus 512和RS105菌株。接种5 d后发现,野生型RS105、B. cereus 512治疗处理(RS105/512)和预处理(512/RS105)的水稻叶片出现水渍状病斑(图5-A);接种7 d后,与野生型RS105处理相比,预防接种(512/RS105)引起的水渍状病斑长度显著变短(图5-A和图5-B)。这表明B. cereus 512含有的抑菌活性物质在水稻组织中能够有效抑制Xoc引起的水渍状病斑的扩展。
3 讨论
本研究从大白菜根际土壤中筛选得到1株蜡样芽孢杆菌B. cereus 512,该菌株对Xoc和Xoo具有明显的拮抗活性,其发酵液能够耐高温和蛋白酶降解,为水稻黄单胞菌的生物防治提供了新的微生物资源。
根据形态、生理生化特征将菌株512鉴定为芽孢杆菌。利用16S rDNA序列進行分析发现,其与B. cereus、B. wiedmannii和B. albus等菌株16S rDNA的序列具有100%的同源性,无法有效确定其分类地位。进一步选取持家基因gyrB进行分析发现,菌株512和B. cereus gyrB基因的同源性为99%;系统发育树分析结果表明,两者亲缘关系最近。因此,结合形态、生理生化特征及分子鉴定将512确定为B. cereus,命名为蜡样芽孢杆菌512(B. cereus 512)。很多芽孢杆菌如B. velezensis很容易被鉴定为B. subtilis或者B. amyloliquefaciens[28]。在利用分子技术进行鉴定时,除了考虑16S rDNA序列之外,也需要结合一些持家基因(例如gyrA或者gyrB)进行同源性分析。
已有研究显示,B. cereus能够促进植物生长、抗真菌[18]和线虫[20-21],且能够产生超氧化物歧化酶(superoxide dismutase,简称SOD),诱导植物的系统抗病性[16],对于病原真菌如轮枝镰刀菌(Fusarium verticillioides)[17]、葡萄炭疽病菌(Colletotrichum gloeosporioides)[29]以及引起花生仁产后腐烂的曲霉真菌(Aspergillus flavus)[30]等具有明显的抑制作用,已成功应用于生产实践。但关于B. cereus对植物病原黄单胞菌具有拮抗活性的报道较少。本研究发现,B. cereus 512可以抑制Xcm、Xav、Xcv和Xcj的生长,对于Xoo和Xoc的抑制效果最明显。张荣胜等曾利用解淀粉芽孢杆菌(B. amyloliquefaciens)LX-11菌株来防治BLS,防治效果可达60.2%[31]。本研究发现,B. cereus 512在水稻叶片中能够抑制Xoc的生长,限制条斑病症状的扩展。这预示着B. cereus 512也具有防治BLS的潜力,但是在田间是否具有生防潜力,还需要进一步的试验论证。
菌株512的发酵液虽具有蛋白酶活性,但抑制Xoc的活性物质能耐蛋白酶解和高温,在pH值为3~13之间都能够维持稳定的抑菌活性。这表明,B. cereus 512拮抗Xoc的活性物质不是蛋白类和常见的脂肽类化合物,是否为新的化合物还有待于进一步分析。
参考文献:
[1]Ou S H. Rice diseases[M]. 2nd ed. Kew:Commonwealth Mycological Institute,1985.
[2]裴俊国,邹丽芳,邹华松,等. 水稻条斑病菌xopQ1_(Xoc)在病程中功能的初步研究[J]. 中国农业科学,2010,43(17):3538-3546.
[3]Nio-Liu D O,Ronald P C,Bogdanove A J. Xanthomonas oryzae pathovars:model pathogens of a model crop[J]. Molecular Plant Pathology,2006,7(5):303-324.
[4]Suh J P,Jeung J U,Noh T H,et al. Development of breeding lines with three pyramided resistance genes that confer broad-spectrum bacterial blight resistance and their molecular analysis in rice[J]. Rice,2013,6(1):5.
[5]Wang C L,Fan Y L,Zheng C K,et al. High-resolution genetic mapping of rice bacterial blight resistance gene Xa23[J]. Molecular Genetics and Genomics,2014,289(5):745-753.
[6]Chen S,Lin X,Xu C J,et al. Improvement of bacterial blight resistance of ‘Minghui 63,an elite restorer line of hybrid rice,by molecular marker-assisted selection[J]. Crop Sci,2000,40:239-244.
[7]岑贞陆,黄思良,李容柏,等. 稻种材料抗细菌性条斑病性鉴定[J]. 安徽农业科学,2007,35(22):6850-6851,6853.
[8]邢家华,何荣林,张纯标,等. 20%噻森铜悬浮剂对水稻白叶枯病和细菌性条斑病的田间防效[J]. 浙江农业科学,2007(5):567-568.
[9]周明国,马忠华,党香亮,等. 对噻枯唑具有抗性的水稻白叶枯病菌菌株的性质[J]. 植物保护学报,1997,24(2):155-158.
[10]程 亮,游春平,肖爱萍. 拮抗细菌的研究进展[J]. 江西农业大学学报,2003,25(5):732-737.
[11]Chauhan A K,Maheshwari D K,Kim K,et al. Termitarium-inhabiting Bacillus endophyticus TSH42 and Bacillus cereus TSH77 colonizing Curcuma longa L.:isolation,characterization,and evaluation of their biocontrol and plant-growth-promoting activities[J]. Canadian Journal of Microbiology,2016,62(10):880-892.
[12]Zhao L F,Xu Y J,Sun R,et al. Identification and characterization of the endophytic plant growth prompter Bacillus cereus strain mq23 isolated from Sophora Alopecuroides root nodules[J]. Brazilian Journal of Microbiology,2011,42(2):567-575.
[13]管 珺,胡永紅,杨文革,等. 蜡样芽孢杆菌防治植物病虫害的研究进展[J]. 现代农药,2007,6(4):7-10.
[14]王 刚,沈永红,王俊芳,等. 蜡样芽孢杆菌B3-7菌株对小麦全蚀病菌的抑制作用[J]. 河南大学学报(自然科学版),2005,35(1):62-64.
[15]唐容容,杨文革,胡永红,等. 蜡样芽孢杆菌CGMCC4348菌株防治番茄灰霉病的效果及机理研究[J]. 湖北农业科学,2013,52(8):1817-1820.
[16]Wang X L,Wang L,Wang J,et al. Bacillus cereus AR156-induced resistance to Colletotrichum acutatum is associated with priming of defense responses in loquat fruit[J]. PLoS One,2014,9(11):e112494.
[17]Martínez-lvarez J C,Castro-Martínez C,Sánchez-Pea P,et al. Development of a powder formulation based on Bacillus cereus sensu lato strain B25 spores for biological control of Fusarium verticillioides in maize plants[J]. World Journal of Microbiology & Biotechnology,2016,32(5):75.
[18]Huang C J,Wang T K,Chung S C,et al. Identification of an antifungal chitinase from a potential biocontrol agent,Bacillus cereus 28-9[J]. Journal of Biochemistry and Molecular Biology,2005,38(1):82-88.
[19]Silo-Suh L A,Lethbridge B J,Raffel S J,et al. Biological activities of two fungistatic antibiotics produced by Bacillus cereus UW85[J]. Applied and Environmental Microbiology,1994,60(6):2023-2030.
[20]Gao H J,Qi G F,Yin R,et al. Bacillus cereus strain S2 shows high nematicidal activity against Meloidogyne incognita by producing sphingosine[J]. Scientific Reports,2016,6:28756.
[21]Xiao L,Wan J W,Yao J H,et al. Effects of Bacillus cereus strain Jdm1 on Meloidogyne incognita and the Bacterial community in tomato rhizosphere soil[J]. 3 Biotech,2018,8:319.
[22]陳思宇,张志谊,张荣盛,等. 水稻纹枯病拮抗细菌的筛选及鉴定[J]. 植物保护学报,2013,40(3):211-218.
[23]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:364-398.
[24]Saitou N,Nei M. The neighbor-joining method:a new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution,1987,4(4):406-425.
[25]Salzberg S L,Sommer D D,Schatz M C,et al. Erratum to:genome sequence and rapid evolution of the rice pathogen Xanthomonas oryzae pv.oryzae PXO99A[J]. BMC Genomics,2008,9(1):534.
[26]葛平华,马桂珍,付泓润,等. 海洋解淀粉芽孢杆菌GM-1菌株发酵液抗菌谱及稳定性测定[J]. 农药,2012,51(10):730-732,741.
[27]Kilanifeki[KG*2/3]O,Khedher[KG*2/3]S[KG*2/3]B,DammakM,etal.Improvementof
[HT8.][KG2]antifungal metabolites production by Bacillus subtilis V26 for biocontrol of tomato postharvest disease:theory and applications in pest management[J]. Biological Control,2016,95(5):73-82.
[28]Dunlap C A,Kim S J,Kwon S W,et al. Phylogenomic analysis shows that Bacillus amyloliquefaciens subsp. plantarum is a later heterotypic synonym of Bacillus methylotrophicus[J]. International Journal of Systematic and Evolutionary Microbiology,2015,65(7):2104-2109.
[29]Aoki T,Aoki Y,Ishiai S,et al. Impact of Bacillus cereus NRKT on grape ripe rot disease through resveratrol synthesis in berry skin[J]. Pest Management Science,2017,73(1):174-180.
[30]Kumar S N,Sreekala S R,Chandrasekaran D,et al. Biocontrol of Aspergillus species on peanut kernels by antifungal diketopiperazine producing Bacillus cereus associated with entomopathogenic nematode[J]. PLoS One,2014,9(8):e106041.
[31]张荣胜,陈思宇,王晓宇,等. 解淀粉芽胞杆菌Lx-11防治水稻细菌性条斑病应用技术研究[J]. 中国生物防治学报,2013,29(4):595-600.

