辣椒基因组SSR引物的开发及品种纯度分子鉴定
卢霞 邓志军 刘梦华 赵玉虎 司龙亭 李文虎 阿门

摘要:辣椒是世界上重要的蔬菜作物之一,基因组简单重复序列(simple sequence repeats,简称SSR)标记的开发对于辣椒分子育种和杂交种子纯度检测具有重要意义。为了检测辣椒品种绿陇3号杂交种子的纯度,基于辣椒全基因组序列开发了75对SSR标记。结果表明,只有SSR标记p50对父母本的扩增结果表现为带型清晰、共显性,且具有高多态性,可进一步用于杂交种的纯度检测。为了确保标记p50的准确性和可靠性,对其PCR产物进行了进一步测序。测序结果表明,在父母本中分别扩增出了251、293 bp的序列。用标记p50对绿陇3号辣椒进行纯度检测,结果显示,种子纯度为100%,鉴定结果与田间纯度一致。新SSR 分子标记的开发,为辣椒杂交种子纯度的鉴定提供了參考,也为辣椒种质资源遗传多样性分析及分子育种研究奠定了基础。
关键词:辣椒;SSR;分子标记;种子纯度鉴定
中图分类号: S641.303文献标志码: A
文章编号:1002-1302(2020)07-0065-04
辣椒(Capsicum annuum L.)属于茄科(Solanaceae)辣椒属(Capsicum),是我国的主要蔬菜作物之一,既可鲜食,又是重要的调料。辣椒品种的好坏对其产量及品质均有直接而明显的影响,因而辣椒新品种的选育至关重要。利用杂种优势选育优质高产的杂交种,是辣椒育种中行之有效的途径。目前,我国辣椒生产已经广泛使用杂交种,但是在实际制种过程中,由于人工去雄不及时、外来花粉干扰、母本自交、机械混杂等均影响了种子纯度,因此,为了保证辣椒种子的质量,纯度鉴定是种子销售中不可或缺的重要步骤[1]。在传统的形态学角度,辣椒种子的纯度鉴定主要依赖于果型、株型、绒毛等田间表型,其检测周期长、用地多,不仅费时费工,而且易受环境因素的影响,难以满足当年的生产需求。
近年来,分子生物学的发展使种子纯度鉴定进入基因水平。用分子标记鉴定种子纯度采用电泳方法检测基因组DNA的结构与组成,通过分析DNA水平上的差异来检验品种纯度与真实性,其遗传性稳定、多态性高,不受发育阶段、取材部位等环境因素的制约,目前DNA分子标记技术已经被广泛用于辣椒、番茄、茄子、黄瓜、西葫芦、西瓜等主要蔬菜作物的鉴定与纯度检测中[2-8]。目前,在利用DNA分子标记检测辣椒种子纯度方面已有部分研究,刘子记等对辣椒杂交种简单重复序列(simple sequence repeats,简称SSR)分子标记鉴定结果及表型鉴定结果进行比较分析,结果表明,筛选出的SSR分子标记可用于热辣3号杂交种纯度的快速鉴定[9];张曼用筛选出的标记CA885分别对2份辣椒品种F1代杂交种的96株单株进行纯度检测,检测结果与田间鉴定结果一致[10]。辣椒全基因组测序的完成[11-13],不仅有助于了解辣椒基因组的结构与功能,而且对于辣椒SSR位点的开发、加速辣椒育种进程都有重要的指导作用。随着更多辣椒SSR位点得到开发及研究应用,有望进一步推动SSR标记在种子纯度检验、遗传育种中的应用[14]。
本研究以江苏绿港现代农业发展有限公司选育的辣椒品种绿陇3号为试验材料,基于辣椒基因组序列,设计开发了1批SSR引物,筛选其中具有多态性、特异性强、重复性好的SSR引物,对绿陇3号杂交种子进行分子纯度鉴定,初步建立辣椒杂交种种子室内纯度鉴定的SSR体系,以期为辣椒杂交种子的纯度鉴定及品种遗传多样性分析提供理论基础。
1 材料与方法
1.1 试验材料
本试验所用辣椒品种购自江苏绿港现代农业发展有限公司,以绿陇3号的F1代及母本、父本种子作为试验材料,取144粒F1代种子、各12粒父母本种子播在穴盘中,在育苗棚中育苗,待长出第1张真叶时进行试验。
1.2 基因组DNA的提取与检测
辣椒基因组DNA的提取采用改良的十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,简称CTAB)法[15]。取30 mg幼嫩叶片放入2 mL离心管中,加入1个直径为4 mm的钢珠,盖紧盖子后将其放入液氮中90 s,然后用组织研磨仪磨样;在磨好的样中加入600 μL三氯甲烷CTAB缓冲液,55 ℃水浴20 min;12 000 r/min离心1 min,吸取400 μL 上清于干净的1.5 mL离心管中,加入350 μL体积比为24 ∶[KG-*3]1的三氯甲烷-异戊醇溶液,充分混匀;12 000 r/min离心1 min,取300 μL上清于另1个干净的1.5 mL离心管中,加入500 μL无水乙醇(提前于-20 ℃预冷)与50 μL乙酸铵,混匀,于-20 ℃冰箱放置2 h;13 000 r/min离心10 min,倒掉上清液,将离心管放置于室温条件下;待离心管中无乙醇味时,加入100 μL ddH2O溶解DNA。分别用超微量紫外可见分光光度计与1%琼脂糖凝胶电泳检测所提DNA的浓度与质量。
1.3 SSR分子标记的开发
从茄科基因组数据库(Sol Genomics Network)中下载辣椒的全基因组序列,通过Pilot Edit软件与SSR搜索工具SSR Hunter软件在基因组序列中有目的地搜索包含SSR位点的序列,以二、三、四、五、六核苷酸基序(motif)的最少重复次数在10次以上作为标准进行SSR位点序列的选择。用Primer 5设计引物,引物设计参数如下:引物长度为18~30 bp,最适长度为22 bp,正反引物的长度相差不超过3 bp,退火温度为50~60 ℃,GC含量在40%左右,PCR预扩增产物大小为100~300 bp。引物由浙江尚亚生物技术有限公司合成。
1.4 PCR扩增与检测
PCR采用15 μL体系,包含1 μL DNA模板、7.5 μL Taq Mix、各1 μL正反向引物、4.5 μL ddH2O。PCR扩增条件如下:95 ℃预变性5 min;94 ℃ 变性60 s,58 ℃退火60 s,72 ℃延伸60 s,35个循环;72 ℃ 延伸2 min,16 ℃终止反应。
扩增完成后,将扩增产物在8%聚丙烯酰胺凝胶上电泳,电泳完成后,进行硝酸银溶液染色、氢氧化钠甲醛溶液显色。在自然光下,对每对引物扩增出来的条带进行判断,当某对引物的扩增条带在父母本中具有多态性,并在F1代中同时显示出父母本的特征条带时,则确定该引物可用于纯度鉴定,否则表明该引物不适合用于鉴定杂交种的纯度。
1.5 SSR标记的克隆与测序
为了验证所选标记片段的大小,对父母本进行PCR扩增,对扩增产物进行胶回收,然后连接至pMD19-T载体上,送至浙江尚亚生物技术有限公司进行测序。
2 结果与分析
2.1 多态性引物的筛选
利用笔者所在公司自主开发的75对SSR标记对辣椒品种绿陇3号及其父母本进行PCR扩增,对扩增产物进行8%聚丙烯酰胺凝胶电泳。由图1可以看出,标记p50在绿陇3号父母本中都能扩增出清晰的条带,且在绿陇3号中表现为父母本带型互补的条带。重复试验结果表明,标记p50扩增的带型稳定、多态性高,且为共显性标记。
2.2 新开发标记p50的序列信息及相应测序结果
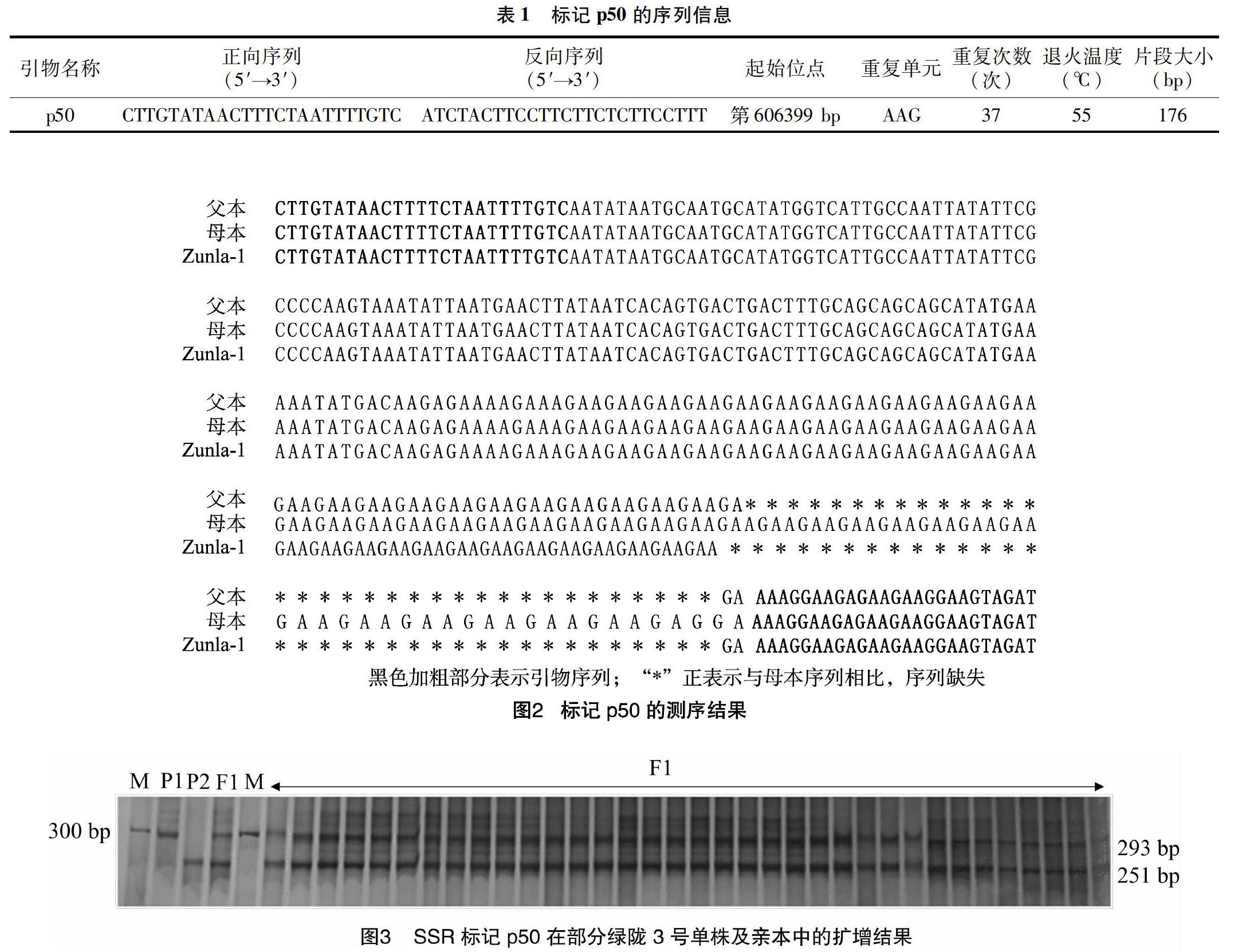
2.2.1 标记p50的序列信息 以栽培辣椒品种Zunla-1全基因组序列开发的标记p50的序列信息见表1。
2.2.2 标记p50扩增DNA的测序结果 为了在分子水平上确定所选SSR标记的准确性与可靠性,对用标记p50扩增的DNA片段进行了测序。由图2的测序结果看出,绿陇3号父母本存在42 bp的序列差异,在其母本中扩增出了293 bp的序列,而在其父本中扩增出了251 bp的序列,父母本对应的差异序列为(GAG)1与(AAG)13。该结果与聚丙烯酰胺凝胶电泳结果完全一致,因此,本试验选用标记p50来鉴定绿陇3号辣椒的种子纯度。
2.3 杂交种绿陇3号的纯度鉴定
随机选取144粒绿陇3号的种子,在育苗棚中育苗后,提取其叶片基因组DNA,并以标记p50作为引物进行SSR扩增,检测辣椒绿陇3号的纯度。结果表明,绿陇3号所有种子均呈父母本互补带型(图3),杂交种子的纯度达到100%。进行大田种植后,根据植株的表型鉴定结果,在136株绿陇3号群体中,有2株的表型表现与亲本一致,田间鉴定得到的种子纯度为98.5%,与分子标记鉴定的结果基本一致。
3 讨论
种子纯度鉴定是商业育种中必不可少的重要步骤,是衡量种子质量的关键。辣椒是我国的重要蔬菜作物之一,每年通过传统的田间试验来鉴定其纯度虽然有效,但是效率太低,不仅费时费力,且易受外界环境因素的影响。而利用分子标记技术,可以快速高效地完成种子纯度鉴定,不但节约了种子公司的成本,为市场提供了优质种子,还对我国的辣椒育种具有重要的指导意义[1]。随着分子生物学技术的飞速发展,分子标记技术已经成为作物品种真实性和纯度鉴定的发展方向。目前,SSR分子标记技术在蔬菜作物品种鉴定与纯度检测方面已得到了广泛应用。近年来,国内外学者对辣椒全基因组测序的完成,为SSR标记的开发提供了新途径,使引物开发费用逐渐降低[11,13],更多的辣椒SSR位点被开发,将进一步推动SSR标记在种子纯度检验、遗传育种及其他研究领域中的应用。
本研究基于栽培辣椒品种Zunla-1全基因组序列信息,开展了辣椒SSR位点的挖掘与设计,开发了75对SSR引物,并筛选出了1对特异性条带清晰、多态性强、便于识别、方便对辣椒杂交种绿陇3号进行种子纯度分析的SSR引物p50。新开发的标记p50在基因组中的起始位点为第606399 bp,重复单元为AAG,重复了26次。但是有趣的是,对绿陇3号亲本的测序结果显示,双亲存在42 bp的序列差异,且母本序列比基因组参考序列多12个GAA与1个GAG序列,而父本序列较参考序列少1个GAA序列,这与p50的重复单元及数量并不相同,表明GAG可能是1个高变异位点,因而在不同辣椒品种中的存在模式有差异。本研究结果可用于亲缘关系较近的种质资源遗传分析研究。
本研究用标记p50对绿陇3号及其父母本进行SSR扩增后,能够准确地将父母本、杂交种及假杂种区分开来,绿陇3号种子的纯度为100%,与田间表型鉴定的结果高度一致。为了确保鉴定结果的准确性和可靠性,对绿陇3号父母本的扩增产物进行测序后,在母本中检测出了293 bp的序列,在父本中检测出了251 bp的序列,该测序结果与电泳结果完全一致,表明新开发的标记p50符合绿陇3号的DNA特点,筛选出的引物针对性强,适用于绿陇3号辣椒杂交种纯度的鉴定。综合分析可知,本研究结果为亲缘关系较近的辣椒种质资源遗传多样性分析及分子标记辅助育种研究奠定了基础。
参考文献:
[1]白占兵,李雪峰,戴雄泽. 利用SSR分子标记建立辣椒纯度鉴定体系[J]. 辣椒杂志,2010(1):32-34.
[2]王 飞,姚明华,尹延旭,等. 辣椒SSR多态性引物的筛选及品种纯度鉴定[C]//中国园艺学会.中国园艺学会2017年论文摘要集. 2017:126.
[3]卢国强,卢海林,潘学春,等. 辣椒品种镇研22种子纯度的SSR分子比较鉴定[J]. 辣椒杂志,2017(2):33-35.
[4]张录霞,甘中祥,李倍金,等. 利用InDel标记鉴定加工番茄杂交种纯度[J]. 分子植物育种,2016,14(6):1533-1537.
[5]刘 军,周晓慧,庄 勇. 茄子杂交品种种子纯度的SSR分子标记鉴定[J]. 分子植物育种,2013,11(6):790-794.
[6]周勝军,张 鹏,朱育强,等. 黄瓜‘浙秀1号种子纯度的SSR鉴定[J]. 分子植物育种,2013,11(5):557-561.
[7]林春晶,张春宝,董英山. DNA分子标记在作物杂交种纯度鉴定中的应用[J]. 分子植物育种,2015,13(3):702-710.
[8]李超汉,刘 莉,刘 翔,等. 基于SSR标记的5个西瓜新品种纯度鉴定及特异性分析的研究[J]. 中国农学通报,2015,31(33):177-185.
[9]刘子记,李静婷,杨 衍,等. 辣椒杂交种SSR分子标记鉴定及表型比较分析[J]. 华北农学报,2014,29(1):69-72.
[10]张 曼. 基于分子标记的辣椒杂交种真实性和纯度的检验[D]. 郑州:河南农业大学,2012.
[11]Qin C,Yu C S,Shen Y,et al. Whole-genome sequencing of cultivated and wild peppers provides insights into Capsicum domestication and specialization[J]. PNAS,2014,111(14):5135-5140.
[12]Lee J M,Nahm S H,Kim Y M,et al. Characterization and molecular genetic mapping of microsatelliite loci in pepper[J]. Theoretical and Applied Genetics,2004,108(4):619-627.
[13]Kim S,Park M,Yeom S I,et al. Genome sequence of the hot pepper provides insights into the evolution of pungency in Capsicum species[J]. Nature Genetics,2014,46(3):270-278.
[14]杜培粉. 14個辣椒杂交种纯度鉴定的SSR引物筛选[J]. 长江蔬菜,2017(14):46-49.
[15]Aljanabi S M,Martinez I. Universal and rapid salt-extraction of high quality genomic DNA for PCR-based techniques[J]. Nucleic Acids Research,1997,25(22):4692-4693.

