GmVP1 基因克隆与转GmVP1/GmNHX1 双价基因的大豆发状根耐盐性分析
赵甜甜,范会芬,孙天杰,肖付明,张 洁,王冬梅
(1.河北农业大学 生命科学学院/河北省植物生理与分子病理学重点实验室,河北 保定 071001;2.河北省邯郸市农业科学院,河北 邯郸 056001)
土壤盐碱化是严重影响大豆生长与产量的因素之一。不同研究者发现植物耐盐性调控机制复杂,且具有多基因控制同一性状的特点。因此,借助基因工程技术,通过改变一个或几个耐盐基因的表达量,可以更加精确、稳定和快速地改良作物的耐盐性[1]。位于液泡膜上的Na+/H+逆向转运蛋白,具有将盐胁迫条件下植物吸收的过多Na+转运至植物液泡中的功能,在维持植物在高盐条件下原生质中的内稳态和抵御盐分危害中具有重要作用[2]。在高盐环境下,植物通过保持胞质内低Na+浓度来实现自我保护,其主要措施有3 种:拒Na+、Na+的外排和Na+的区隔化[3]。在植物中,Na+/H+逆向转运蛋白可以将Na+排到胞外或者将Na+区隔至液泡或其他细胞器,如高尔基体等,从而维持胞内Na+含量稳定及Na+/H+相对平衡,减少盐碱对植物的伤害。H+-焦磷酸酶是一种独特的质子泵,仅由1 条多肽链组成,分子量约为80 kD,以焦磷酸为底物,该酶定位在植物细胞的液泡膜上[4]。H+-焦磷酸酶是研究高能磷酸键水解与质子转位之间偶联机理的一种模型,其在液泡膜上的定位与H+-焦磷酸酶的生理功能密切相关[5]。H+-焦磷酸酶在植物抵御盐[6-9]、干旱[10]、矿物营养元素匮乏[11-12]和低温[13-14]等非生物胁迫过程中发挥重要作用。已有研究表明,将具有Na+外排和区隔化作用的Na+/H+逆向转运蛋白(NHX)和能够为其提供跨液泡膜H+梯度驱动力的液泡膜H+-焦磷酸酶(VP)共转化可以明显提高植物抗盐性[15]。课题组前期克隆得到了大豆GmNHX1 基因,初步证明该基因能够提高拟南芥的抗盐性并且恢复酵母nhx1 盐敏感突变体菌株的耐盐性[16]。本研究从大豆耐盐品种‘冀豆7 号’中克隆得到液泡膜H+-焦磷酸酶基因GmVP1,利用大豆发状根转化体系,初步验证其耐盐功能;在此基础上,通过构建GmVP1 和GmNHX1 双价基因植物表达载体,进一步验证双基因转化是否能够更有效地提高大豆耐盐性,为利用双价基因转化体系培育优质抗盐大豆新品种奠定基础。
1 材料与方法
1.1 试验材料
试验选用河北省优良大豆品种‘冀豆7 号’和盐敏感品种‘五星2 号’[17],农杆菌菌株K599 及植物双元表达载体pCAMBIA3301,以上材料均由河北农业大学生命科学学院植物逆境研究室提供。克隆载体pEASY®-Blunt Cloning Vector、大肠杆菌感受态细胞Trans1-T1 购自北京全式金生物科技有限公司。
载体构建及农杆菌培养使用的主要培养基参见刘海坤[18];发状根培养使用的主要培养基参见黄姗[8]的方法。
1.2 盐胁迫条件下大豆液泡膜 H+-焦磷酸酶基因的表达量分析
根据拟南芥液泡膜 H+- 焦磷酸酶基因AtVP1的序列信息在NCBI 数据库进行序列比对,找到大豆中同源性最高的序列LOC100794166,根据该基因序列设计引物( 上游引物:5'-CCGGGGCTCTAGTTTCTGGC -3',下游引物: 5'-CCCCAATAACAGCTGCCTTG -3'),选用EF1A基因作为内参基因,序列信息参见文献[19],利用RNAiso Plus 试剂分别提取 0、35、70、105、140、175、200 mmol/LNaCl 处理条件下的‘冀豆7号’和‘五星2 号’叶片 RNA(参见Takara 公司RNAiso Plus 说明书),利用RT-qPCR 检测不同盐胁迫处理条件下大豆GmVP1 基因的转录水平。
1.3 目的基因的克隆与表达载体的构建
‘冀豆7 号’种子萌发至第2 轮三叶长出时,提取叶片总RNA 并反转录为cDNA,利用PCR 技术扩增GmVP1 基因。目的基因引物序列为:上游引物为5'- acgggggactcttgaCCATGGttATGGGTGCTGC TCTGCTGT -3',下游引物为5'- gggaaattcgagctGG TGACCTCAAAAGATCTTGAAAAGCAGGCCACC -3'。反应体系参见Prime STAR Max Premix 产品说明书,反应条件为:98 ℃ 2 min、98 ℃ 10 s、 55 ℃ 15 s、72 ℃ 2 min、30 个循环,72 ℃ 10 min。琼脂糖凝胶电泳检测PCR 产物。
从GmVP1 基因测序正确的大肠杆菌中提取质粒,用Nco Ⅰ和EcoO65Ⅰ对其进行双酶切,将得到的GmVP1 基因大片段与pCAMBIA3301 质粒载体连接,经双酶切鉴定成功后,转化发根农杆菌菌株K599。利用实验室前期构建好的pCAMBIA3301-GmNHX1, 设 计 引 物 扩 增GmNHX1 基 因 前 面CaMV35S 强启动子、后面Nos 终止子和目的基因序列,利用BamHⅠ及SacⅠ双酶切后,连接到pCAMBIA3301-GmVP1 载体的多克隆位点区域,转化大肠杆菌,挑取平板上阳性菌落,37 ℃条件下180 r/min 震荡培养过夜,提取质粒,用BamHⅠ和SacⅠ进行双酶切验证,将验证正确的质粒转化发根农杆菌菌株K599。构建的载体图谱如图1 所示。

图1 pCAMBIA3301-GmVP1、pCAMBIA3301-GmVP1-GmNHX1 载体的构建图谱Fig.1 Construction of vector pCAMBIA3301-GmVP1 and pCAMBIA3301-GmVP1-GmNHX1
1.4 大豆发状根的制备及转化
发根农杆菌的大豆遗传转化参见文献[9]的方法。
1.5 转基因大豆发状根的检测
按照王月月新改良的CTAB 法方法提取大豆基因组DNA[20],以Bar 基因区段特异引物进 行PCR 扩 增, 引 物 序 列 为: 上 游 引 物:5'- CAAATCTCGGTGACGGGC -3', 下 游 引 物:5'- GCACCATCGTCAACCACTAC -3'。 采 用94 ℃ 5 min、94 ℃30 s、55 ℃ 30 s、72 ℃ 140 s 的 PCR 程序,进行35 个循环后,72 ℃ 10 min,扩增480 bp 片段。琼脂糖凝胶电泳检测PCR 扩增产物。
用Bar 免疫性试纸条检验大豆发状根,操作方法参见杭州港隆生物转基因EPSPS 速测试纸说明书进行。
1.6 转基因发状根的耐盐性分析
将经过Basta 筛选,并经 PCR 和免疫性试纸检测验证的大豆转基因发状根和非转基因发状根,分别转移到NaCl 浓度分别为0、70 和150 mmol/L 的添加6 mg/L Basta、200 mg/L Cef 的1/2 MS 固体培养基中。经15 d 培养后,观察记录发状根的生长情况,并统计发状根数量以及最大根长。以不含外源表达载体的 K599 菌株侵染产生的发状根作对照,均设3 次重复。
1.7 转基因发状根POD 和SOD 活性及MDA 含量的测定
大豆发状根的POD 酶活性测定、SOD 酶活性测定、MDA 含量测定按照文献[9]中的方法进行操作。
2 结果与分析
2.1 目的基因的表达分析
根据拟南芥液泡膜 H+- 焦磷酸酶基因AtVP1(Arabidopsislyrata subsp. lyrata vacuolar-type H+pumping pyrophosphatase 1)的序列信息在NCBI 数据库进行序列比对,找到大豆中同源性最高的序 列:DEFINITION PREDICTED: Glycine max pyrophosphate-energized vacuolar membrane proton pump (LOC100794166),根据该基因序列设计引物,利用RT-qPCR 检测了盐胁迫处理条件下大豆GmVP1基因的转录水平。结果表明,经不同浓度NaCl 处理 12 h,抗盐品种‘冀豆7 号’中GmVP1 的表达量在35 ~140 mmol/LNaCl 浓度下呈现较高水平表达,而在盐敏感品种‘五星2 号’中GmVP1 的表达量随NaCl 浓度的升高变化不明显,相较对照略有下降(见图2)。初步证明GmVP1 在转录水平响应盐胁迫,可能在大豆抵御盐胁迫过程中发挥重要作用。

图2 大豆盐胁迫处理条件下GmVP1 的表达模式Fig.2 Expression patterns of GmVP1 after treatment with NaCl
2.2 GmVP1 基因的克隆与pCAMBIA3301-GmVP1-GmNHX1 植物表达载体的构建
为进一步验证该基因的功能, 根据LOC100794166 序列信息设计引物,采用RT-PCR技术进行同源克隆,其产物经1%琼脂糖凝胶电泳检测,扩增的PCR 产物大小为2307 bp。经测序验证后与LOC100794166 进行蛋白序列比对发现,在第18 位由V 变为A、第568 位由L 变为S,序列同源率达到99.74%,个别氨基酸的差异可能是由于不同大豆品种间存在差异所致。生信分析表明,该基因的蛋白序列与拟南芥AVP1 相似度最高(90.2%),而拟南芥AVP1 属于Ⅰ型H+-焦磷酸酶,故将本试验克隆的基因命名为GmVP1。
将GmVP1 基因片段连接到双元表达载体pCAMBIA3301 中,利用Nco Ⅰ和Eco O65 Ⅰ对构建好的pCAMBIA3301-GmVP1 质粒进行双酶切鉴定(见图3),表明pCAMBIA3301-GmVP1 植物双元表达载体构建成功。

图3 pCAMBIA3301-GmVP1 双酶切鉴定图谱Fig.3 Digestion of pCAMBIA3301-GmVP1 plasmid with double restriction enzymes
利用本实验室前期已构建好的pCAMBIA3301-GmNHX1 载体,设计引物扩增GmNHX1 基因前面CaMV35S 强启动子、后面Nos 终止子和目的基因序列,构建到pCAMBIA3301-GmVP1 载体的多克隆位点区域(构建后的载体图谱如图1 所示),经BamH Ⅰ和Sac Ⅰ进行双酶切验证,酶切结果与预期结果一致(见图4),表明pCAMBIA3301-GmVP1-GmNHX1 植物双元表达载体构建成功。

图4 pCAMBIA3301-GmVP1-GmNHX1 双酶切鉴定图谱Fig.4 Digestion of pCAMBIA3301-GmVP1-GmNHX1 plasmid with double restriction enzymes
2.3 转基因发状根的分子生物学鉴定
将酶切验证正确的pCAMBIA3301-GmVP1 载体和pCAMBIA3301-GmVP1-GmNHX1 载体以及对照载体转化发根农杆菌菌株K599,然后进行大豆‘五星2 号’子叶转化。在含有6 mg/L Basta 的RM 培养基中培养15 d,得到生长状态良好的发状根。取未经Basta 处理的由K599 空菌侵染子叶产生的发状根(CK)和具有Basta 抗性的发状根,提取基因组DNA,经PCR 扩增Bar 基因部分序列(如图5 ~6 所示),证明转化的发状根均呈现阳性,说明 携 带pCAMBIA3301、pCAMBIA3301-GmVP1、pCAMBIA3301-GmVP1-GmNHX1 载体的发根农杆菌已成功转入大豆;进一步利用Bar 蛋白的免疫试纸条对发状根进行检测,发现所验证的发状根均检测到Bar 蛋白的免疫条带(见图7),说明在转基因大豆发状根中由35S 启动子调控的GmVP1 基因和GmVP1-GmNHX1 双价基因均已成功在蛋白质水平表达。
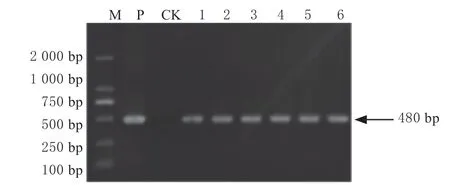
图5 转pCAMBIA3301-GmVP1 发状根的PCR 检测Fig.5 PCR detection of transgenic pCAMBIA3301-GmVP1 hairy roots

图6 转pCAMBIA3301-GmVP1-GmNHX1 发状根的PCR 检测Fig.6 PCR detection of transgenic pCAMBIA3301-GmVP1-GmNHX1 hairy roots

图7 转化发状根的Bar 特异性试纸检测Fig.7 Bar-specific strip test for transforming hairy roots
2.4 盐胁迫下转基因发状根的表型鉴定
以‘五星2 号’大豆品种为材料,将共培养后 的pCAMBIA3301、pCAMBIA3301-GmVP1、pCAMBIA3301-GmVP1-GmNHX1 大豆子叶转接于分别含有0、70、150 mmol/LNaCl 的RM 培养基中进行胁迫处理,结果发现在不同浓度NaCl 处理条件下,不同转化材料的发状根的生长均受到一定程度的影响(见图8)。经70、150 mmol/LNaCl 处理后,转GmVP1/GmNHX1 双价基因的大豆发状根的平均最大根长均明显大于转GmVP1 基因以及空载体对照的发状根,且呈显著性差异;70 mmol/LNaCl 处理时平均发根数多于转GmVP1 基因以及对照,差异显著;但在150 mmol/LNaCl 处理时平均发根数与转GmVP1 基因以及对照无差异。初步证明GmVP1/GmNHX1 双价基因过表达比GmVP1 单基因过表达更能提高大豆发状根相对生长量及其耐盐性。

图8 不同NaCl 浓度处理下pCAMBIA3301-GmVP1-GmNHX1 发状根表型Fig.8 Hairy root phenotype of pCAMBIA3301-GmVP1-GmNHX1 treated with different NaCl concentration
2.5 盐胁迫下转基因发状根的生理指标检测
单独转化GmVP1 基因的发状根,在70 mmol/L NaCl 浓度下POD 酶活性明显高于转空载体对照,在150 mmol/LNaCl 浓度下SOD 酶活性明显高于转空载体对照,并且MDA 的含量在2 个不同盐浓度处理条件下均明显低于对照。而转GmVP1/GmNHX1双价基因的发状根POD 酶活性在70、150 mmol/L NaCl 浓度下均高于转GmVP1 单价基因的发状根及对照;在70 mmol/LNaCl 浓度下,转GmVP1/GmNHX1 双价基因的发状根SOD 酶活性均明显高于单独转化GmVP1 基因以及空载体的对照,在150 mmol/LNaCl 浓度条件下明显高于空载体对照,但是与单独转化GmVP1 基因的相比不明显;转GmVP1/GmNHX1 双价基因发状根的MDA 含量,在70 mmol/LNaCl 浓度下明显低于对照但高于单独转化GmVP1 基因,在150 mmol/LNaCl 浓度下均低于转GmVP1 基因和空载体对照(见图9—11)。进一步说明GmVP1/GmNHX1 双价基因与单独转化GmVP1 基因相比能够更有效地降低盐胁迫对细胞造成的伤害,并增强大豆发状根抵御盐胁迫的能力。

图9 不同NaCl 浓度处理下转基因发状根POD 活性测定Fig.9 Determination of POD in roots of transgenic roots treated with different NaCl concentration

图10 不同NaCl 浓度处理下转基因发状根SOD 活性测定Fig.10 Determination of transgenic hairy root SOD at different NaCl concentration
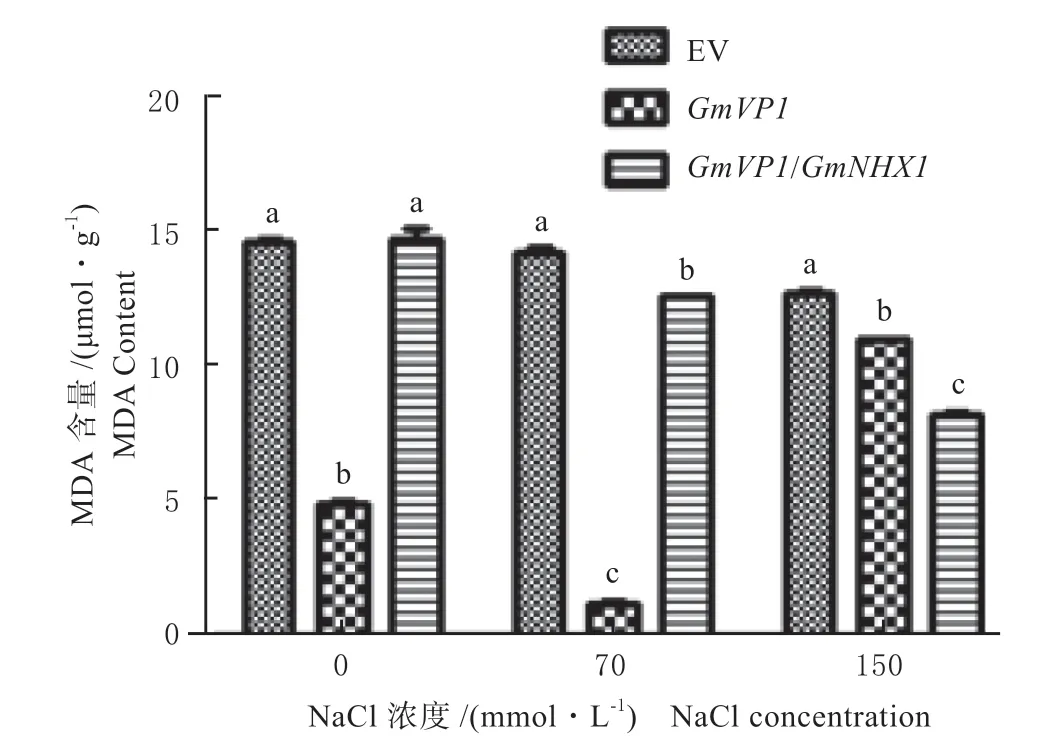
图11 不同NaCl 浓度处理下转基因发状根MDA 含量测定Fig.11 MDA determination of transgenic hairy roots under different NaCl concentration
3 讨论与结论
3.1 VP 基因在植物抵御盐胁迫过程中的作用
根据对不同阳离子的敏感程度及同源性相关程度,拟南芥H+- 焦磷酸酶被分为两种类型:Ⅰ型H+-焦磷酸酶对K+敏感,代表基因为AVP1;Ⅱ型H+-焦磷酸酶对K+不敏感而对Ca2+敏感,代表基因为AVP2[21]。Sarafian 等人率先从拟南芥中克隆了第一个H+-焦磷酸酶的cDNA(数据库登录号M81892)[22]。已有大量研究表明,在拟南芥、棉花、白三叶等多种植物中的焦磷酸酶基因均表现出一定的抗盐功能[6-8,23]。但在大豆中关于VP 基因的相关研究还很少。黄姗克隆得到了与拟南芥AVP2相似度高的大豆H+-焦磷酸酶基因GmVP,其编码蛋白属于Ⅱ型H+-焦磷酸酶,证明大豆H+-焦磷酸酶基因GmVP 过表达能提高盐胁迫下大豆发状根的相对伸长率,提高发状根的耐盐性[9],本研究根据序列信息克隆得到大豆液泡膜H+-焦磷酸酶基因,经生信分析该基因与拟南芥AVP1 相似度最高,其编码蛋白可能属于Ⅰ型H+-焦磷酸酶,故将之命名为GmVP1。
有研究表明,液泡膜焦磷酸酶基因GmVP 在大豆耐盐品种‘文丰7 号’中,经NaCl 处理后1、8和24 h 其表达量高于对照,而在盐敏感品种‘Union’中,经NaCl 处理3 h 后上调表达而后呈下调表达,且表达量低于对照[9]。并且,GmVP 表达量还受到ABA、PEG 等物质的影响,初步证明GmVP 响应盐碱、植物激素与干旱胁迫[9]。本研究发现经不同浓度NaCl 处理后,在抗盐品种‘冀豆7 号’中GmVP1 的表达量随NaCl 浓度的升高整体呈现先升高后下降的趋势,而在盐敏感品种‘五星2 号’中GmVP1 的表达量变化不明显且整体呈现较低的表达水平。推测随着盐浓度增加,耐盐品种中GmVP1呈较高水平表达,产生了更多的跨膜质子梯度,为液泡膜Na+/H+逆向转运蛋白提供了更大的驱动力,进而有助于细胞将钠离子区隔化到液泡中,减轻高盐浓度对细胞的伤害,其详细作用机制有待深入探讨。
3.2 双价基因转化在提高植物耐盐中的应用
植物的耐盐性是受多基因控制和环境综合影响的数量性状,将多价基因共转化应用于植物耐盐性状的改良,具有巨大发展潜力。近年来,多项研究表明双基因共转化可提高植物耐盐性[24-25]。其中,将NHX 和VP 两种基因构建双价表达载体,进行双基因共转化,比单基因转化抗盐效果更佳[26-27]。有研究表明,单独提高液泡膜Na+/H+逆向转运蛋白或H+-PPase 表达量后,均能够提高转基因棉花的耐盐能力[28];而将大豆液泡膜 Na+/H+反向转运蛋白GmNHX1 和百脉根液泡膜H+-PPaseLcVP1 双价基因整合到棉花基因组后,不同程度地提高了转基因株系耐盐能力,进一步证明二者共表达有助于提高棉花的抗盐能力。另外,Bao 等从旱生植物霸王中克隆到的液泡膜Na+/H+逆向转运蛋白和 H+-PPase 编码基因ZxNHX1 和ZxVP1-1 聚合导入紫花苜蓿,与野生型相比,转基因株系的耐盐性、抗旱性和耐贫瘠性均显著增强[15,24,27],并且T2 代共表达ZxNHX1和ZxVP1-1 转基因紫花苜蓿稳定遗传了T0和T1代转基因植株的耐盐抗旱性[29]。本研究将GmNHX1和GmVP1 构建在同一载体,获得了转双价基因的大豆发状根。经不同浓度的NaCl 处理后发现,转化GmVP1 和GmNHX1 双价基因的大豆发状根比转化GmVP1 单基因的大豆发状根在盐胁迫下具有更长的生长量,更强的POD 等保护酶酶活性,进一步印证了双价转化比单独转化具有更高的抗盐效率。

