急性盐度胁迫对克氏原螯虾抗氧化和非特异性免疫性能的影响
乔雁冰,李世顺,崔文博,左然涛,常亚青
(大连海洋大学,农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
克氏原螯虾(Procambarusclarkii),属节肢动物门(Arthropoda)、甲壳纲(Crustacea)、十足目(Decapoda)、爬行亚目(Reptantia)、螯虾科(Cambaridae)、原螯虾属[1](Procambarus),俗称小龙虾、红螯虾、淡水小龙虾及红色沼泽螯虾等。克氏原螯虾的原产地是美国南部和墨西哥北部[2-3]等。在20世纪30年代作为外来物种从日本引进到中国南京,因其适应性强、生长快、繁殖周期短和成活率高等特点,如今已经广泛分布在中国江苏、湖北和安徽等省市[4-9]。据《2019年中国渔业统计年鉴》数据显示[10],2018年克氏原螯虾产量为1 638 662 t,比2017年增长45.05%,表明克氏原螯虾已经成为中国重要的水产经济虾类。
近年来,甲壳动物在全国范围内的产业推广和人工养殖方面取得了较大的发展[11],养殖面积不断扩大,同时也面临着严峻的病害问题,制约着水产养殖业的产业经济发展[12-13]。在甲壳动物人工养殖过程中,相关疾病的暴发是由各种原因综合形成的,环境因子作为甲壳动物疾病暴发的主要原因之一[14],与机体的免疫防御息息相关,已引起了学者的广泛关注。盐度是一种重要的环境生态因子,水体盐度的变化对甲壳动物的生存、生长、生活习性和生理过程都有显著的影响[15-16]。在养殖过程中,盐度急剧变化会破坏甲壳动物的渗透压平衡,引起机体产生一系列生理生化反应,在此过程中免疫机能会显著降低,严重时会导致生物较高的死亡率[17]。国内外已有大量关于环境因子对甲壳动物免疫防御能力影响的研究[14,18-21],但渗透环境对甲壳动物的影响是近几年随着养殖业的迅速发展和养殖环境的改变才得到了关注。盐度对虾蟹类的呼吸代谢、生长存活和免疫都具有显著的影响。研究发现高盐和低盐胁迫对三疣梭子蟹(Portunustrituberculatus)的非特异性免疫会产生显著影响并产生比较强的应激反应[22];在对中华绒螯蟹(Eriocheirsinensis)的研究中发现,高盐胁迫会激活免疫因子进而影响其免疫防御能力[23]。
随着市场需求的增加,克氏原螯虾养殖面积不断扩大,近年来国内开始尝试盐碱地养殖,但是该养殖模式下克氏原螯虾的产量和成活率都较低,亟需探明盐度胁迫对克氏原螯虾生理指标的影响规律,用以指导生产实践,减少经济损失。张龙岗等[24]研究发现低盐度可激活克氏原螯虾肝胰腺中抗氧化酶活性,金彩霞等[25]研究发现盐度胁迫对克氏原螯虾血淋巴渗透压、Na+/K+-ATPase酶和生物胺活性具有显著影响,刘国兴[26]发现盐度变化会显著影响克氏原螯虾摄食量、摄食时间和运动比率。本研究通过急性盐度胁迫实验,探究克氏原螯虾在不同盐度条件下血淋巴中抗氧化能力和非特异性免疫响应,以期为开展盐碱地养殖克氏原螯虾提供理论参考。
1 材料与方法
1.1 实验设计和样品采集
实验所用克氏原螯虾购买自大连市长兴水产品交易市场,选择结构完整、体色鲜明、活力较好、大小均匀,体重为(11.05±0.12)g的克氏原螯虾用于实验。在实验室条件下玻璃钢水槽(1 000 L)中暂养一周,暂养期间,每天换水1/2,按体重的3%投喂商业人工配合饲料(粗蛋白28%、粗脂肪6%和灰分≤15%)2次,投喂2 h后吸出残饵和粪便。实验期间,水温18~20 ℃,溶解氧保持6 mg/L以上,pH在7.8~8.2之间。
实验用淡水均为经过彻底曝气并存放一周的无氯淡水,用提前准备的无氯淡水和经过砂滤处理的自然海水调配盐度(15‰和30‰),并以无氯淡水组(0‰)作为对照。在实验开始前一天暂停饵料投喂,选取暂养池中活力较好的360只克氏原螯虾进行随机分组试验,每个处理3个重复组,每个重复随机投放40只大小均匀的克氏原螯虾。实验采用自然光照,水槽中投放庇护物,防止打架和互残,实验期间一切管理措施和暂养期间一致。实验开始后,从胁迫开始计时,在15 min、24 h和48 h时随机取样,每次取样时每个水槽迅速捞出4只虾,用1 mL无菌注射器从每一只擦拭干净的虾的头胸甲2/3处插入,在心脏中抽取血淋巴液于2 mL离心管中,此过程在碎冰上进行,每组平行中克氏原螯虾的血淋巴样品为一个单独样本,4 ℃条件下过夜,之后取出凝固的血淋巴并捣碎,于4 ℃条件下8 000 g离心20 min[27],将上清液转移到1.5 mL离心管中,放置在-80 ℃冷冻保存,待检。
1.2 样本检测
抗氧化酶和非特异性免疫酶酶活性测试均采用南京建成生物工程研究所生产的试剂盒,所有检测步骤严格按照试剂盒上的说明书操作。采用黄嘌呤氧化酶法测定超氧化物歧化酶(superoxide dismutase,SOD)活性;采用分光光度计比色法测定过氧化氢酶(catalase,CAT)活性;采用分光光度计测定酚氧化酶(phenoloxidase,POX)活性;采用TBA显色法测定丙二醛(malondialdehyde,MDA)含量;采用磷酸苯二钠法测定碱性磷酸酶(alkaline phosphatase,AKP)活性;采用可见分光光度法测定酸性磷酸酶(acid phosphatase,ACP)活性和采用比色法测定溶菌酶(lysozyme,LZM)活性。
1.3 数据分析
所有实验数据采用Excel 2013和SPSS 22.0软件进行数据分析,采用单因素方差进行数据处理,比较不同处理组或者不同取样时间之间的均值差异采用Turkey方法进行多重比较,以P<0.05作为不同处理组之间差异显著标准。数据以“平均值±标准差”(mean±SD,n=3)表示。
2 结果
2.1 盐度对克氏原螯虾血淋巴中SOD和CAT活性的影响
如表1所示,与对照组相比,盐度15‰和30‰组在胁迫下,克氏原螯虾血淋巴中SOD活性变化显著,48 h之内均呈现出先升高后降低的趋势(P<0.05),并都在24 h达到最大值。在同一时间点上,随着盐度的升高SOD活力也出现了显著的变化,与对照组比较,在15 min和24 h时,盐度15‰和30‰组显著高于对照组(P<0.05),胁迫48 h时,3个实验组之间没有显著差异(P>0.05)。
如表2所示,盐度对克氏原螯虾血淋巴中CAT活性具有显著影响(P<0.05),24 h时盐度15‰组的CAT活力显著高于对照组和盐度30‰组(P<0.05),而对照组和盐度30‰组之间没有显著变化(P>0.05);盐度15‰组的CAT活性在24 h时显著高于胁迫15 min和48 h(P<0.05),在其它时间点上则没有差异(P>0.05)。

表1 盐度对克氏原螯虾血淋巴中SOD活性的影响Tab.1 Effects of salinity on SOD activity of haemolymph in Procambarus clarkii U·mL-1, n=3
注:同列数据肩标中不同小写字母表示差异显著(P<0.05);同行数据肩标中不同大写字母表示显著差异(P<0.05)。下同。

表2 盐度对克氏原螯虾血淋巴中CAT活性的影响Tab.2 Effects of salinity on CAT activity of haemolymph in Procambarus clarkii U·mL-1,n=3
2.2 盐度对克氏原螯虾血淋巴中POX活性的影响
如表3所示,盐度胁迫对克氏原螯虾血淋巴中POX活性具有显著影响(P<0.05)。盐度30‰组的POX的活性随着时间的推移呈现降低趋势,且在胁迫15 min时显著高于胁迫24 h和48 h(P<0.05),在其它实验组则没有显著性差异(P>0.05);在胁迫15 min时,盐度30‰组的POX的活性显著高于对照组(P<0.05),在其它时间点则没有显著性差异(P>0.05)。

表3 盐度对克氏原螯虾血淋巴中POX活性的影响Tab.3 Effects of salinity on POX activity of haemolymph in Procambarus clarkii ng·mL-1,n=3
2.3 盐度对克氏原螯虾血淋巴中MDA含量的影响
如表4所示,盐度胁迫对克氏原螯虾血淋巴中MDA含量具有显著影响(P<0.05),随着盐度的升高呈现增加的趋势,在盐度30‰组15 min时MDA含量最高。在15 min和48 h时,盐度30‰组的MDA含量显著高于其他2个组(P<0.05),在24 h时各实验组之间没有显著性变化(P>0.05);在盐度30‰组中,MDA含量在胁迫15 min时显著高于24 h和48 h时间点(P<0.05)。
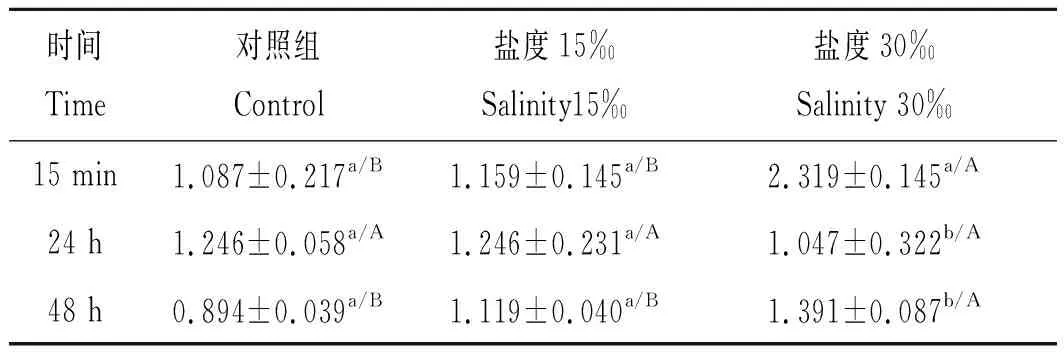
表4 盐度对克氏原螯虾血淋巴中MDA含量的影响Tab.4 Effects of salinity on MDA content of haemolymph in Procambarus clarkii nmol·mL-1,n=3
2.4 盐度对克氏原螯虾血淋巴中LZM活性的影响
如表5所示,在对照组中,克氏原螯虾血淋巴中LZM的活性在15 min时显著高于48 h(P<0.05),在盐度15‰和30‰条件下,LZM活性未受胁迫处理时间的显著影响(P>0.05);在48 h时,盐度15‰的LZM活性显著高于对照组(P<0.05),而盐度15‰和30‰组之间没有显著性差异(P>0.05)。
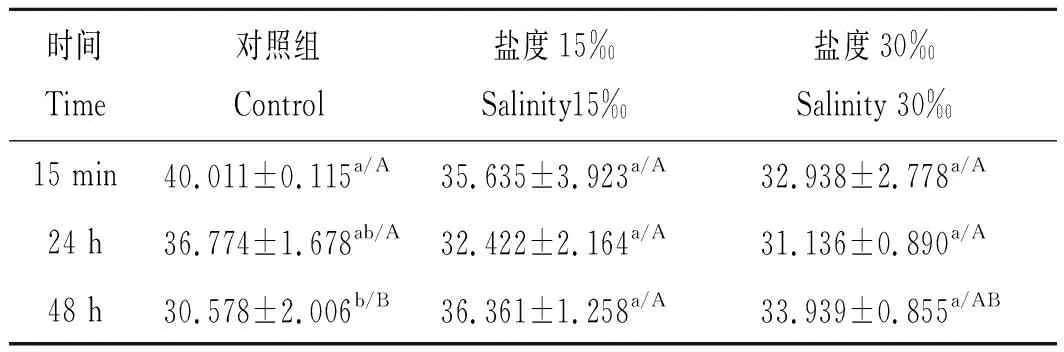
表5 盐度对克氏原螯虾血淋巴中LZM活性的影响Tab.5 Effects of salinity on LZM activity of haemolymph in Procambarus clarkii U·mL-1,n=3
2.5 盐度对克氏原螯虾血淋巴中AKP和ACP活性的影响
如表6所示,盐度组ACP活性均随着处理时间延长呈降低趋势(P<0.05),盐度30‰组在15 min时ACP活力最高。在盐度15‰组中,随着时间的延长ACP活性显著降低,其中处理48 h时显著低于15 min时(P<0.05),而15 min和24 h之间ACP活性没有显著变化(P>0.05);在盐度30‰组中,随着时间的延长ACP活性也呈现显著降低的趋势,在48 h时显著低于15 min和24 h(P<0.05),而24 h时ACP活性也显著低于15 min(P<0.05)。在15 min时,盐度15‰和30‰组显著高于对照组(P<0.05);在24 h时,盐度15‰组酶活力最高,显著高于盐度30‰和对照组(P<0.05),盐度30‰组也显著高于对照组(P<0.05)。
盐度对克氏原螯虾血淋巴中AKP活性的影响如表7所示。盐度15‰和30‰组AKP活性均随着时间的延长均呈降低的趋势(P<0.05)。随着时间的延长,盐度15‰组AKP活性在各时间点之间具有显著差异(P<0.05),随着时间的推移显著降低,在48 h时AKP活性显著低于15 min和24 h(P<0.05);在盐度30‰组中AKP活性也具有显著性差异,在15 min和24 h时显著高于48 h(P<0.05),而在15 min时也显著高于24 h处理组(P<0.05)。在同一时间点不同盐度之间也呈现逐渐升高的趋势,在15 min时各盐度组显著高于对照组(P<0.05),而盐度15‰和30‰组之间没有显著变化(P>0.05);在24 h时出现了相似的显著性变化趋势,盐度15‰和30‰组显著高于对照组(P<0.05)。
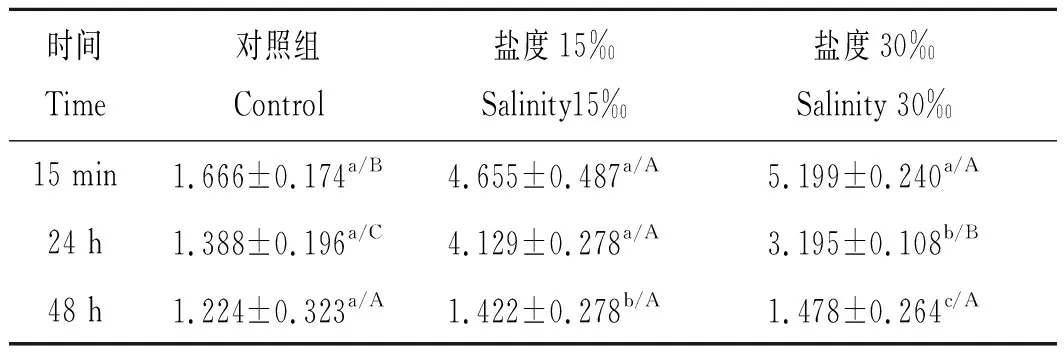
表6 盐度对克氏原螯虾血淋巴中ACP活性的影响Tab.6 Effects of salinity on ACP activity of haemolymph inProcambarus clarkii 金氏单位·(100mL)-1,n=3
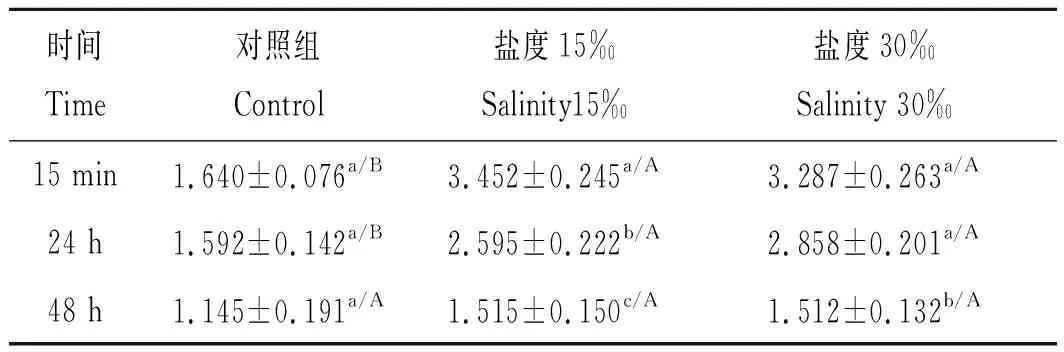
表7 盐度对克氏原螯虾血淋巴中AKP活性的影响Tab.7 Effects of salinity on AKP activity of haemolymph inProcambarus clarkii 金氏单位·(100mL)-1,n=3
3 讨论
盐度是水体中无机盐含量的指标,甲壳动物对盐度的适应主要是通过机体渗透压的调节,当水体盐度突变后机体需要进行动态的渗透调节,从而达到可以适应外界环境的新的平衡状态,若盐度突变幅度过大或者超过了机体的调节能力将造成不可逆的渗透调节,导致死亡[28]。本研究中,48 h内未见克氏原螯虾死亡,这说明克氏原螯虾具有较强的盐度调节和适应能力。
生物体内部清除过多自由基的系统包括非酶系统和抗氧化酶系统。其中抗氧化酶系统主要包括超氧化物歧化酶(清除超氧阴离子)、过氧化氢酶(清理过氧化氢)、谷胱甘肽过氧化物酶及谷胱甘肽-硫-转移酶(清除脂质氢过氧化物)等[29]。本研究中,克氏原螯虾处理组的血淋巴中超氧化物歧化酶(SOD)活性随着时间的推移(0~48 h)呈现出先升高后降低的趋势。在急性盐度胁迫短时间内(15 min~24 h)克氏原螯虾血淋巴中SOD活力升高,这与陈宇锋等[30]的研究成果相似,该研究发现盐度胁迫导致锯缘青蟹(Scyllaserrata)SOD活性在24 h内显著升高。苏诗娟[31]研究发现东方对虾(Penaeusorientalis)在高盐度30‰时SOD活性显著升高。这说明急性盐度胁迫能够激活克氏原螯虾机体的SOD酶,从而增强机体抵抗盐度胁迫的能力,然而当胁迫时间超出一定耐受范围后,SOD酶活性也会受到抑制,克氏原螯虾抗氧化能力显著下降。本研究发现,在低盐条件下,随着时间的延长,CAT活性呈先升高后降低的趋势,分析认为低盐度胁迫会激活克氏原螯虾机体的抗氧化酶系统,随之增加机体对盐度胁迫的抵抗能力,以维持机体的机能,而在高盐条件下,机体的抗氧化酶活性受到抑制,导致抗氧化能力降低。李娜等[32]研究认为盐度30‰条件下凡纳滨对虾(Litopenaeusvannamei)血淋巴中SOD活性会出现峰值,而血淋巴中CAT活性总体呈现先升高后降低的趋势,与本研究结果类似。
酚氧化酶及其因子构成了一个复杂的酶级联反应系统,即酚氧化酶原激活系统(prophenoloxidase-activated system, proPO-As),POX是酚氧化酶原激活系统的产物,在识别异物、释放调理素促进血细胞的吞噬和包囊以及产生杀灭和排除异物的凝集素和溶菌酶等免疫功能方面发挥重要的作用,因此与机体的免疫功能有直接关系[31]。一些学者认为在外界刺激和胁迫下,机体会迅速激活血淋巴PO系统,酚氧化酶活力升高,并产生一定程度的免疫反应[33-35]。本研究结果表明,在高盐度30‰胁迫初期15 min时POX活性最高,随着时间的延长呈现降低的趋势,这一结果验证了上述说法。另陈宇锋等[30]研究发现锯缘青蟹在盐度胁迫后会显著影响血淋巴中PO活性,并伴随时间的延长而减低,本研究结果与之相似。
机体内的脂质氢过氧化物在分解时经常会产生醛类,脂质过氧化产生较多的醛类之一就是丙二醛[36-37]。而机体MDA含量主要反映脂质过氧化程度,从而间接的反映细胞损伤的程度。赵玉超等[38]研究认为盐度能显著影响凡纳滨对虾仔虾体内的MDA含量,并造成机体免疫功能降低。在本研究中,随着盐度的升高MDA含量也显著升高,机体脂质过氧化程度增加,说明外界盐度条件会导致机体的细胞出现氧化损伤,造成机体免疫能力下降。
溶菌酶(LZM)具有溶菌活性,作为非特异性免疫生物防御因子对某些细菌发挥着先天抵抗作用,并可以诱导其他免疫因子的合成和分泌[39]。本研究中,在不同盐度组和不同时间点上,LZM活性差异不大,说明盐度胁迫对克氏原螯虾血淋巴中活性影响较小,分析认为盐度胁迫对克氏原螯虾体内的LZM活性也影响较小。赵玉超等[38]发现高盐度胁迫对凡纳滨对虾血淋巴中溶菌酶活性没有显著影响,本实验结果与之一致。对照组中LZM活性随时间的延长呈现降低的趋势,分析认为是在实验开始前进行了一天的饥饿处理导致克氏原螯虾机体的LZM活性增加,之后出现了降低,这与芦光宇等[40]研究结果一致,该研究认为饥饿会影响克氏原螯虾抗氧化系统,导致抗氧化酶活性随着饥饿时间的延长呈现先升高后降低的变化趋势。
在甲壳动物的免疫防御体系中,酸性磷酸酶(ACP)和碱性磷酸酶(AKP)直接参与磷酸基团的转移和代谢,可以加速机体物质的摄取和转运,能形成水解酶体系,破坏和消除侵入体内的异物,对维持虾、蟹类的生存和生长有特别重要的意义[41]。同时ACP会伴随血细胞进行吞噬和包囊反应过程而被释放[42-43]。因此通过分析AKP和ACP活性变化,有助于了解盐度胁迫对机体营养物质消化吸收、物质运输及生物体抗氧化系统的影响。刘存歧[44]分析金属离子对中国对虾幼体AKP的影响,认为磷酸酶活性的高低可以作为判断机体免疫能力的指标。谭树华等[45]研究高浓度Zn2+对克氏原螯虾几种免疫学相关指标的影响,认为其可通过磷酸酶活性的增加抵御恶劣环境,清除体内产生的异物。在本实验中,随着盐度的升高AKP和ACP活性显著增加,分析认为随着盐度的升高,机体为进行渗透调节维持机体稳态而大量消耗ATP,而合成ATP必需的无机磷酸需要ACP和AKP催化水解磷酸脂类物质产生,进而导致AKP和ACP活性增加,从而增强机体免疫活性,在高盐胁迫对凡纳滨对虾免疫相关酶的研究中也发现了相似的结论[32]。当胁迫时间延长,AKP和ACP活性显著降低,体内这2种酶的活性受到了明显抑制,说明随着时间的延长,盐度胁迫会影响机体的免疫系统,进而降低机体的抗病能力,这与赵艳飞等[46]的研究结果相似,认为环境因子会影响机体内的AKP和ACP活性,进一步导致抗病能力下降。
综上,本研究以抗氧化酶和非特异性免疫酶活性作为评价克氏原螯虾应对急性盐度胁迫的免疫指标,证明在急性盐度胁迫短时间内(15 min~24 h)即能激活克氏原螯虾的抗氧化系统和非特异性免疫系统来抵御外界环境,48 h后各项生理指标可恢复至正常水平,从而实现对环境的适应,为开发盐碱地养殖克氏原螯虾模式的可行性提供了理论参考。

