葡萄卷叶伴随病毒2实时荧光定量RT-PCR技术的检测应用
任芳 张尊平 范旭东 胡国君 张梦妍 董雅凤


摘要 通过引物筛选和体系优化建立了葡萄卷叶伴随病毒2 Grapevine leafroll-associated virus 2(GLRaV-2)的SYBR Green Ⅰ染料法实时荧光定量RT-PCR检测技术。该技术标准曲线扩增效率为102.2%,决定系数为0.999,最低检出限可达10-3稀释梯度,是常规RT-PCR的100倍。对不同季节和不同部位葡萄样品的检出率普遍高于常规RT-PCR。春夏秋季样品检出率分别为67%、89%和86%,比常规RT-PCR检出率分别高42%、28%和17%。冬季休眠枝条检出率最高(100%),与常规RT-PCR相同。夏季老叶柄和卷须、秋季和冬季枝条等样品检测效果最好,检出率均为100%。对来自我国17个省38个品种的116份田间葡萄样品检测结果表明,qRT-PCR共检测到10个样品为阳性,检出率略高于常规RT-PCR。
关键词 葡萄; 葡萄卷叶伴随病毒2; 实时荧光定量RT-PCR; 常规RT-PCR; 检测
中图分类号: S 432.1
文献标识码: A
DOI: 10.16688/j.zwbh.2019119
Application of a real-time quantitative RT-PCR for detection of
Grapevine leafroll-associated virus 2
REN Fang, ZHANG Zunping, FAN Xudong, HU Guojun, ZHANG Mengyan, DONG Yafeng
(National Center for Eliminating Viruses from Deciduous Fruit Trees, Research Institute of Pomology,
Chinese Academy of Agricultural Sciences, Xingcheng 125100, China)
Abstract
A SYBR GreenⅠ based real-time quantitative RT-PCR (qRT-PCR) method for Grapevine leafroll-associated virus 2 (GLRaV-2) was established. An excellent linear correlation (0.999) and amplification efficiency (102.2%) were obtained from the standard curve. The detection limit of the method was 10-3 dilution fold, which was 100 times higher than that of conventional RT-PCR. The method was subsequently used to detect grapevine samples in different seasons and different positions of plant. The detection efficiency of qRT-PCR for grapevine samples in most seasons and positions were generally higher than that of conventional RT-PCR. The detection rates of qRT-PCR for samples in spring, summer and autumn were 67%, 89% and 86%, which were 42%, 28% and 17% higher than those of conventional RT-PCR, respectively. For dormant branches in winter, the detection rates were the same for the two methods (100%). In general, the old petioles and tendrils in summer, branches in autumn and winter were the best materials for GLRaV-2 detection by qRT-PCR, with the detection rates of 100%. For field samples (belonging to 38 cultivars) from 17 provinces in China, 10 of 116 samples were detected to be positive by qRT-PCR, and the detection efficiency was higher than that of conventional RT-PCR.
Key words
grapevine; Grapevine leafroll-associated virus 2; qRT-PCR; conventional RT-PCR; detection
葡萄卷叶病是一种世界性病毒病害,也是我国葡萄上的主要病害,由多种葡萄卷叶伴随病毒Grapevine leafroll-associated virus (GLRaV)引起,其中GLRaV-2和GLRaV-3是我国葡萄卷叶病的主要病原。GLRaV-2属于长线病毒科Closteroviridae长线病毒属Closterovirus,为RNA病毒,基因组全长16.5 kb,包含9个ORFs,分别编码一个大的多聚蛋白、p6、Hsp70h、p63、CPm、CP、p19和p24等蛋白[13]。GLRaV-2除了引起葡萄卷叶病外,还可导致嫁接不亲和、部分品种嫁接后死亡和幼樹“速衰”等症给葡萄生产造成很大危害[45]。除我国外,GLRaV-2在美国、意大利等多个国家普遍发生,且分为多个变异组群,不同分离物间遗传变异性较大[3,6],给病毒检测和防控带来很大困难。病毒检测是葡萄病毒病防控的关键环节,实时荧光定量RT-PCR(qRT-PCR)检测技术特异性强、灵敏度高,在世界上已经应用多年[5,78],但我国还未见GLRaV-2 qRT-PCR检测技术的相关研究报道。本实验室前期建立的葡萄病毒A Grapevine virus A(GVA)qRT-PCR技术,检测特异性好且灵敏度高,灵敏度可达到常规RT-PCR的100倍以上[9],表明该技术在葡萄病毒检测中具有较好应用前景。因此本研究建立并优化了GLRaV-2的qRT-PCR检测技术体系,并将其应用到不同季节和不同部位葡萄样品的检测中,以期为丰富GLRaV-2检测手段、提高病毒检测效率打下基础。
1 材料与方法
1.1 材料
本研究以辽宁省兴城市中国农业科学院果树研究所国家落叶果树脱毒中心毒源保存圃采集的感染GLRaV-2的葡萄样品(表2)以及来自我国不同葡萄产区的田间葡萄样品(表3)为试材。
1.2 主要仪器和试剂
本研究所用实时荧光定量PCR仪为CFX ConnectTM Real-Time System(BIO-RAD,美国)。主要试剂10×PCR Buffer、dNTPs、Taq酶、DNA marker DL2000、反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser 和Escherichia coli DH5α感受态购自大连宝生物公司(TaKaRa);2×SYBR GreenⅠ qPCR Mix、pTOPO-TA载体、胶回收试剂盒购自北京艾德莱生物有限公司。
1.3 总RNA提取及反转录
取葡萄样品约80 mg,采用吸附柱法[10]提取总RNA,-80℃保存。采用反转录试剂盒(M-MLV Reverse Transcriptase,TaKaRa),参照任芳等[9]反转录方法合成cDNA,-20℃保存。
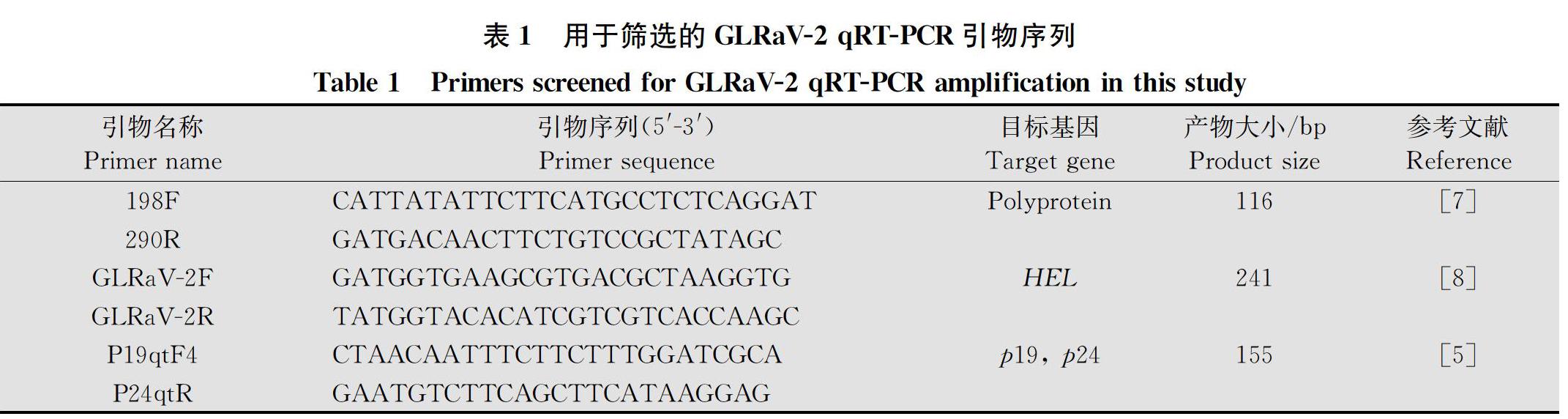
1.4 引物筛选及克隆验证
根据文献报道选择198F/290R[7]、GLRaV-2F/2R[8]和P19qtF4/P24qtR[5]等3对引物作为本研究GLRaV-2实时荧光定量PCR候选引物(表1)。分别采用常规RT-PCR和qRT-PCR对引物特异性及扩增效果进行比较。qRT-PCR反应体系13 μL,含2× SYBR GreenⅠqPCR Mix 6.25 μL、正反向引物各0.25 μL、DEPC水 5.25 μL 和cDNA 1 μL。反应条件:95℃预变性3 min;95℃ 15 s,58℃15 s,72℃ 20 s,40个循环,熔解曲线分析温度60~95℃,每5 s增加0.5℃。以扩增曲线Cq值(扩增产物荧光信号达到设定阈值所经过的循环次数)<30且熔解曲线为单一峰时判定为阳性。根据常规RT-PCR和qRT-PCR扩增效果选择1对引物作为本研究qRT-PCR检测引物,将所选引物PCR扩增产物割胶回收纯化,连接pTOPO-TA载体并转化大肠杆菌DH5α,挑取阳性克隆送北京诺赛基因组研究中心进行测序,序列比对分析验证引物正确性。
1.5 qRT-PCR体系优化及标准曲线构建
以10-1倍稀释的cDNA作为模板,在54.0~64.0℃退火温度梯度下进行qRT-PCR扩增选择最佳退火温度;采用100、200、300、400 nmol/L和500 nmol/L引物浓度进行qRT-PCR扩增选择最佳引物浓度。在最佳退火温度和引物浓度下,以1~10-7梯度稀释的cDNA为模板进行qRT-PCR标准曲线构建。
1.6 qRT-PCR技术的检测及应用
1.6.1 特异性检测和灵敏度比较
分别采集感染了葡萄病毒A Grapevine virus A(GVA)、葡萄病毒B Grapevine virus B(GVB)、葡萄病毒E Grapevine virus E(GVE)、GLRaV-1、GLRaV-2、GLRaV-3、GLRaV-4、葡萄扇葉病毒Grapevine fan leaf virus(GFLV)、葡萄斑点病毒Grapevine fleck virus(GFkV)和沙地葡萄茎痘病毒Grapevine rupestris stem pitting associated virus(GRSPaV)的葡萄样品用于qRT-PCR特异性检测。以GLRaV-2阳性样品1~10-7梯度稀释的cDNA 为模板,分别进行常规RT-PCR和qRT-PCR检测,比较检测灵敏度。
1.6.2 田间葡萄样品检测
选择感染GLRaV-2的4个品种(‘赤霞珠‘红地球‘克瑞森无核和‘品丽珠)6株葡萄植株,分别在春夏秋季采集上部(枝条顶端嫩梢从上往下第2、3 片叶)嫩叶、嫩叶柄、下部(枝条基部自下往上第2、3片叶)老叶、老叶柄、卷须和枝条等6个部位样品,冬季采集休眠枝条,共114个样品(表2),分别进行常规RT-PCR和qRT-PCR检测。并收集来自我国17个省38个品种的116份田间葡萄样品(表3),分别采用常规RT-PCR和qRT-PCR进行检测。
2 结果与分析
2.1 引物筛选及克隆验证
选择16个感染GLRaV-2的葡萄样品采用3对引物进行常规RT-PCR检测。电泳结果表明,引物198F/290R仅有7个样品扩增到目的条带,且目的条带与引物二聚体区分不明显;引物GLRaV-2F/2R有1个样品未扩增到目的条带,且有4个样品条带较弱;引物P19qtF4/P24qtR扩增效果最好,16个样品全为阳性且特异性好(图1)。
同时将上述样品进行qRT-PCR检测,结果表明引物198F/290R仅6个样品为阳性;引物GLRaV-2F/2R16个样品均获得扩增曲线,为阳性,但阴性对照也有扩增曲线,表明该引物特异性较差,易导致样品假阳性产生;引物P19qtF4/P24qtR检测16个样品全为阳性,且健康对照为阴性,特异性较好。
综上,常规RT-PCR和qRT-PCR扩增效果最好的引物均为P19qtF4/P24qtR。将引物P19qtF4/P24qtR扩增6个阳性样品的扩增产物回收克隆并测序,共获得6个克隆序列,经NCBI BLAST分析及DNAStar软件比对,所获得6个克隆序列分为两组,其中1组包含3个克隆序列,与已报道的GLRaV-2 PN(AF039204)及14G463(MH814501)等多个分离物目标片段序列一致,同源性为100%。另一组3个克隆序列则与GLRaV-2 RG(登录号AF314061)及12G4102(MH814500)等分离物对应片段序列一致,同源性为100%。表明本研究所选引物扩增片段与GLRaV-2目的片段正确匹配,可用于下一步GLRaV-2 qRT-PCR检测。
2.2 qRT-PCR体系优化及标准曲线构建
不同退火温度下,相同样品Cq值差异较小(21.56~21.88),56.0℃和57.9℃两个温度的相对荧光强度最强,选择58℃作为本研究GLRaV-2最佳退火温度。不同引物浓度下,300 nmol/L和400 nmol/L时Cq值和相对荧光强度相近且优于其余3个浓度,但300 nmol/L扩增阴性对照Cq值更低,因此选择300 nmol/L作为本研究GLRaV-2最佳引物浓度。
在最佳退火温度和引物浓度条件下扩增梯度稀释样品并构建标准曲线。结果表明,1~10-4倍稀释样品扩增曲线呈梯度分布,标准曲线Cq值与模板浓度线性关系良好,扩增效率和决定系数均较高(E=102.2%,R2=0.999)(图2)。
2.3 qRT-PCR检测特异性及灵敏度
用建立的qRT-PCR方法检测分别感染GLRaV-2和其他9种葡萄病毒的样品,只有GLRaV-2感染样品为阳性,Cq值19.11,熔解曲线为单一峰,其余样品为阴性,表明其可特异性检测GLRaV-2。检测梯度稀释的GLRaV-2阳性样品时,常规RT-PCR最低只能检测10-1倍稀释样品,而qRT-PCR
检测10-3倍稀释样品时Cq值仍小于30,为阳性,检测灵敏度可达普通RT-PCR的100倍(图3)。
2.4 不同季节和不同部位葡萄样品检测
qRT-PCR和常规RT-PCR两种方法对感染GLRaV-2的6株葡萄植株不同季节和部位共114个样品(表2)检测结果及各季节和各部位样品平均检出率(图4)对比结果表明,两种方法对冬季休眠枝条检测效果相当且检出率最高(均为100%),对其余各季节和部位样品qRT-PCR检出率均高于常规RT-PCR。尤其是对春季样品,RT-PCR检出率很低,而qRT-PCR检出率可达67%,比常规RT-PCR提高了42百分点。qRT-PCR对夏季和秋季样品检测效果相当,检出率达89%和86%,分别比常规RT-PCR高28百分点和17百分点。不同部位样品比较,qRT-PCR对老叶、老叶柄、卷须和枝条样品检出率相当(83%~88%),嫩叶检出率最低,但所有部位样品检出率均高于常规RT-PCR(图4)。综合比较各季节各部位样品检测效果,qRT-PCR对夏季老叶柄、卷须、秋季枝条和冬季休眠枝条检出率最高,均达100%,其次为夏季和秋季其余部位样品及春季老叶样品,检出率均为83%(表2)。
2.5 不同产区葡萄田间样品检测
对来自17个省不同产区38个品种的116份田间葡萄样品(表3)分别进行了常规RT-PCR和qRT-PCR检测,常规RT-PCR有8个样品检测为阳性,检出率6.9%,qRT-PCR共检测到10个样品为阳性,其中包括常规RT-PCR检测为阳性的8个样品,qRT-PCR检出率8.6%,略高于常规RT-PCR。
3 讨论
本研究根據文献报道的引物筛选及体系优化建立了GLRaV-2的qRT-PCR检测技术,检测灵敏度可达常规RT-PCR的100倍,与本实验室建立的GVA[9]等葡萄病毒qRT-PCR检测灵敏度相当,并且采用减半反应体系13 μL,降低了试剂耗材等检测成本。为了检验该技术的实际应用效果,我们对不同季节、不同部位以及不同产区不同品种的葡萄样品进行了检测。结果表明,GLRaV-2 qRT-PCR检测技术极大地提高了对不同季节或部位样品的检测效果,春夏秋季样品检出率比常规RT-PCR提高了17~42百分点,对不同部位的样品检出率比常规RT-PCR提高了9~39百分点。对来自我国辽宁、山东、河北等17个省38个品种的116个田间葡萄样品检测结果也表明,其与常规RT-PCR检测结果基本一致且检出率更高。同时,研究结果还可为选择GLRaV-2检测或脱毒的最佳取样时间或部位提供参考依据,在一定程度上提高病毒检测准确率,减少漏检情况的发生,如夏季老叶柄、卷须、秋季枝条和冬季休眠枝条检测效果最好,检出率均达100%,其次为春季老叶和夏秋季其余部位样品。与之相反,在选择材料用于葡萄病毒脱除时,则可选择春季幼嫩组织以提高脱毒效率。不同葡萄病毒在不同季节或部位葡萄样品中的检测效果也有所不同,如GVA在不同季节间检出率差异较明显,大多部位在春夏季较低,在秋冬季较高[9],而本研究采用qRT-PCR检测GLRaV-2,检出率除春季外,其余季节间无明显差异,与GLRaV-3夏季浓度最高,生长季末期检出率较高等
特征较一致[11]。GLRaV-2各部位间检出率差异也较小,但嫩叶检出率较低这一点与GVA一致,与GFLV不同[12]。影响不同病毒和不同葡萄样品检测效果的因素目前尚不清楚,是否与病毒种类有关以及是否与病毒在寄主体内的时空分布规律呈正相关等有待于下一步研究。
参考文献
[1] 王萌,费菲,周涛,等.葡萄卷叶伴随病毒2号和3号辽宁分离物部分基因组的序列分析[J].植物病理学报,2009,39(5):458465.
[2] LIU Yuping, PEREMYSLOV V V, MEDINA V, et al. Tandem leader proteases of Grapevine leafroll-associated virus 2: host-specific functions in the infection cycle [J]. Virology, 2009, 383(2): 291299.
[3] MARTELLE G P. Grapevine Virology Highlights: 20102012. Proceedings of the 17th Congress of ICVG [C]. Davis, California, USA. 2012: 1331.
[4] MENG Baozhong, LI Caihong, GOSZCZYNSKI D E, et al. Genome sequences and structures of two biologically distinct strains of Grapevine leafroll-associated virus 2 and sequence analysis [J]. Virus Genes, 2005, 31(1): 3141.
[5] BEUVE M, SEMPE L, LEMAIRE O. A sensitive one-step real-time RT-PCR method for detecting Grapevine leafroll-associated virus 2 variants in grapevine [J]. Journal of Virological Methods, 2007, 141(2): 117124.
[6] 任芳,董雅凤,张尊平,等.葡萄病毒研究最新进展[J].园艺学报,2014,41(9):17771792.
[7] OSMAN F, LEUTENEGGER C, GOLINO D, et al. Real-time RT-PCR (TaqMan) assays for the detection of Grapevine Leafroll associated viruses 1-5 and 9 [J]. Journal of Virological Methods, 2007, 141(1): 2229.
[8] POOJARI S, ALABI O J, OKUBARA P A, et al. SYBR() Green-based real-time quantitative reverse-transcription PCR for detection and discrimination of grapevine viruses [J]. Journal of Virological Methods, 2016, 235: 112118.
[9] 任芳,董雅凤,张尊平,等.葡萄病毒A实时荧光定量RT-PCR 检测技术的建立及应用[J].园艺学报,2018,45(11):22432253.
[10]FAN Xudong, HONG Ni, DONG Yafeng, et al. Genetic diversity and recombination analysis of Grapevine leafroll-associated virus 1 from China [J]. Archives of Virology, 2015, 160(7): 16691678.
[11]TSAI C W, DAUGHERTY M P, ALMEIDA R P P. Seasonal dynamics and virus translocation of Grapevine leafroll-associated virus 3 in grapevine cultivars [J]. Plant Pathology, 2012, 61(5): 977985.
[12]KREBELJ A J, CˇEPIN U, RAVNIKAR M, et al. Spatio-temporal distribution of Grapevine fanleaf virus (GFLV) in grapevine [J]. European Journal of Plant Pathology, 2015, 142(1): 159171.
(責任编辑:杨明丽)
收稿日期: 20190312 修订日期: 20190712
基金项目:国家重点研发计划(2019YFD1001800);国家现代农业产业技术体系建设专项(CARS-29-bc-1)
致 谢: 参加本试验部分工作的还有江代礼、谭翰杰、张能和纪烨斌等同学,特此一并致谢。
通信作者E-mail:yfdong@163.com
#为并列第一作者

