具铁载体活性病原细菌的筛选及铁摄取干预对其生长影响
何翔 张庆 李楚 番华彩 李铭刚 徐胜涛 陈齐斌 杨明英 杨佩文

摘要 絕大多数病原菌可分泌铁载体,利用螯合性铁载体及病原菌对Fe3+的竞争可实现病害的有效防控。从植物病原菌中筛选高产铁载体的优势菌株,并基于EDTA对铁离子的强螯合性,可为病害防控提供新的方法。本研究采用CAS检测法和光吸收法对42株供试植物病原菌株进行定性、定量筛选及铁载体类型的初步鉴定,依据菌株形态电镜观察和分子生物学技术对优势菌株进行分类鉴定,并基于微量稀释法测定EDTA对优势菌株的最低抑菌浓度。经定性、定量筛选,确定7株供试细菌为高产铁载体优势菌株,分泌铁载体类型为儿茶酚型和异羟肟酸型;根据形态特征观察和分子生物学鉴定,菌株TZT-057和TZT-058与恶臭假单胞菌Pseudomonas putida的一致性最高,TZT-059、TZT-063和TZT-064与肺炎克雷伯氏菌Klebsiella pneumoniae的一致性最高,TZT-062、TZT-073分别与鲁氏不动杆菌Acinetobacter lwoffii、迪克氏菌Dickeya zeae的一致性最高。根据微量稀释法抑菌活性测定结果可知,EDTA对菌株TZT-058、TZT-073的抑菌效果较好,抑菌率分别为85.16%、80.08%,表明强螯合剂EDTA能有效干预病原细菌对铁元素的摄取过程,进而影响其生长繁殖。
关键词 植物病原菌; 铁载体; 筛选鉴定; 乙二胺四乙酸
中图分类号: S 476
文献标识码: A
DOI: 10.16688/j.zwbh.2019131
Abstract
Most pathogenic microorganisms have the function of secreting siderophore, and the competition between sorghum siderophore and pathogens against Fe3+ can be used to effectively prevent and control diseases. The dominant strains producing high-yield siderophore were screened from plant pathogens, and based on the strong chelating property of EDTA to iron, it could provide a new method for the control of plant diseases. In this study, we qualitatively and quantitatively screen the pathogenic strains of different host plants and preliminarily identified the siderophore types by using the CAS method and light absorption method. Meanwhile, the biological identification of the dominant strains was performed by using the electron microscopy and 16S rDNA sequence. The minimum inhibitory concentration of EDTA against dominant strains was determined based on the microdilution method. The results showed that there were 7 strains that were identified as high siderophore-producing dominant strains from the test bacteria through qualitative and quantitative screening, and the types of secretory siderophore were catecholates and hydroxamates. Base on the morphological characteristics and molecular identification, the strains TZT-057 and TZT-058 shared similarity with Pseudomonas putida; the strains TZT-059, TZT-063 and TZT-064 were very similar to Klebsiella pneumoniae; the strain TZT-062 was analogous to Acinetobacter lwoffii, and strain TZT-073 resembled Dickeya zeae. According to the microbial dilution assay, EDTA had better antibacterial activity against strains TZT-058 and TZT-073, and the inhibition rates were 85.16% and 80.08%, respectively. The results suggested that EDTA could effectively affect the uptake process of iron by pathogenic bacteria, and affect its growth and reproduction.
Key words
plant pathogen; siderophore; screening and identification; EDTA
鐵在地壳和土壤中的含量十分丰富,同时铁作为地球上几乎所有生物体必需的营养元素之一,在各项机能代谢活动和酶促反应中发挥着重要作用;但在自然界中性或碱性有氧条件下,铁主要以难溶的Fe3+化合物形式存在,可溶性Fe2+含量较匮乏,生物可利用率极低[13]。农业生产中植株缺铁现象较为普遍,给农林作物生物量的生产和植株系统抗性造成极大的影响。为适应高氧低铁的胁迫环境,许多微生物自身诱导合成分泌一类与Fe3+具高亲和性且能与其特异性螯合的小分子次级代谢产物—铁载体,用以螯合宿主体内或周围环境中大量难溶性的铁,并通过氧化还原反应将其转化为可溶性的铁,为生物体提供充足的铁元素,同时也能有效减少环境中病原菌可利用铁的含量而降低其致病力,增强植株抗性[45]。
关于铁载体的研究早在1950年前后就有报道,根据铁载体官能团和中心结构的多样性,可分为儿茶酚型(catecholates)、异羟肟酸型(hydroxamates)和羧酸盐型(carboxylates)[67]。相较于其他微生物次级代谢产物,关于植物病原菌分泌铁载体的研究还较少[89]。目前,有关植物根际促生菌(plant growth-promoting rhizobacteria, PGPR)、植物内生菌(endophyte)等微生物分泌铁载体的研究较多,且主要为铁载体产生菌初步分离筛选的研究[1012]。而有关植物病原菌分泌铁载体的研究,目前国内外的报道还较少。乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)是一种重要的强螯合剂,能与环境中的碱金属、稀土元素和过渡金属等形成稳定且水溶性较好的螯合物。微生物纯培养环境中,EDTA的外源添加能介导微生物对必需金属元素的吸收利用,进而影响其生长繁殖。因此对铁载体产生菌进行相关研究,充分利用具分泌铁载体功能的植物病原菌菌种资源,并测定抑菌药物对其的最低抑菌浓度(MIC),探索分泌型铁载体在植物病害防治中的作用机制具有重要的研究前景和补充意义。
为挖掘更多的微生物资源,本研究采用CAS检测法和光吸收法,从不同宿主植物病原细菌中筛选高产铁载体的优势菌株,并基于微量稀释法测定EDTA对其最低抑菌浓度(MIC),以期为具分泌铁载体能力的植物病原菌菌种资源的研究、开发和应用提供一定的理论依据和数据支撑。
1 材料和方法
1.1 供试菌株
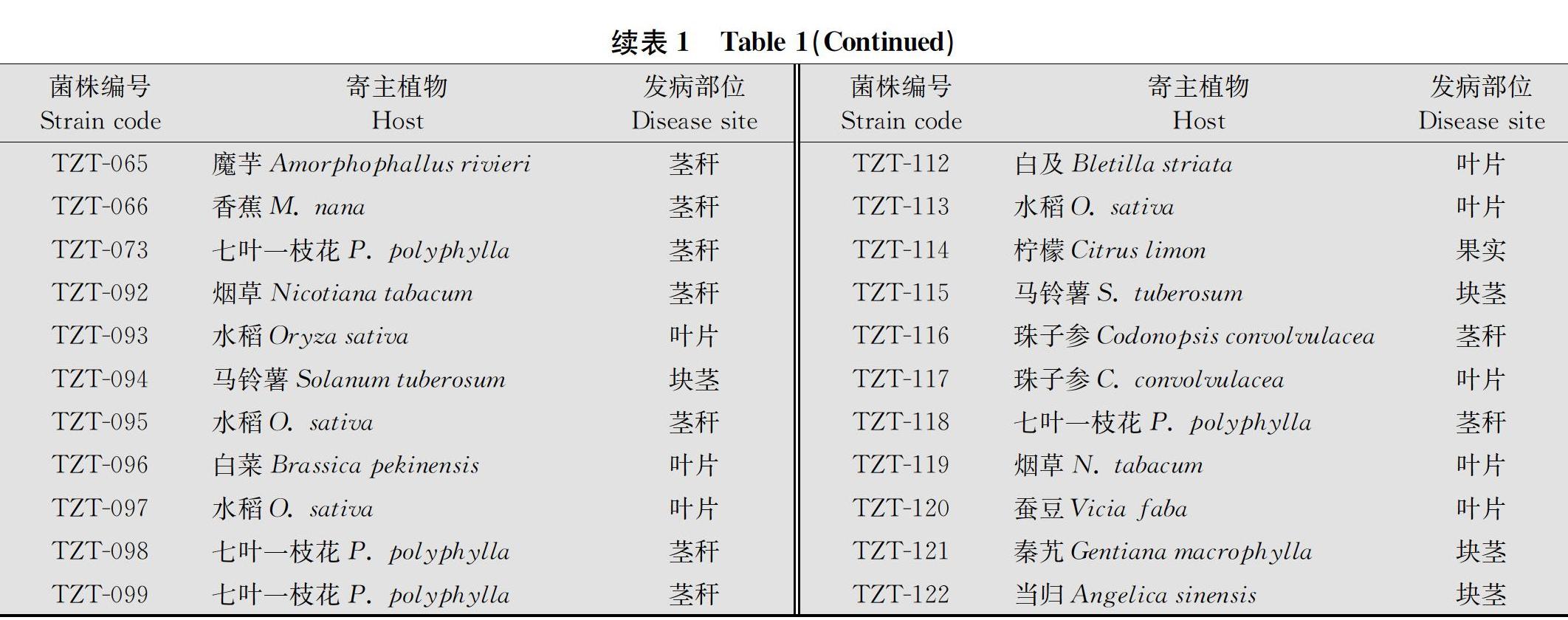
42株供试植物病原细菌均为云南省农业科学院农业环境资源研究所保藏菌种(表1)。
1.2 供试溶液及培养基的制备
CAS检测液:称取0.060 5 g铬天青S(chromeazurol S, CAS)溶于50 mL去离子水中,并加入10 mL FeCl3溶液(1 mmol/L FeCl3·6H2O+10 mmol/L HCl)搅拌混匀,标记为“A液”;再称取0.072 9 g十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide, HDTMA)溶于40 mL去离子水,标记为“B液”;最后将A液缓慢倒入B液中,并搅拌均匀。
TTC显色剂的制备:称取1.0 g氯化三苯基四氮唑(triphenyltetrazolium chloride, TTC)溶于10 mL去离子水中,用0.22 μm无菌滤膜过滤后转入无菌EP管中保存备用,得到0.1 g/mL 的无菌TTC溶液。
EDTA药液的制备:称取40 mg EDTA溶于2 mL去离子水中,并用0.22 μm无菌滤膜过滤后转入无菌EP管中保存备用,得到20 mg/mL的无菌测试母液。
醋酸盐缓冲液的配制:将847 mL 0.1 μmol/L的H3COOH溶液加入到容量瓶内,并加0.1 μmol/L的CH3COONa溶液,定容至1 000 mL,盖紧瓶塞振荡混匀。
供试菌株菌悬液的制备:无菌条件下,在供试菌株斜面内加入2 mL无菌去离子水并刮取菌苔,转入无菌EP管中保存备用;吸取一定量的菌液于无菌试管内,加入无菌去离子水稀释,采用麦氏比浊法测定待测液的OD625,使稀释后的待测液OD625介于0.098 0~0.220 9之间。
无铁查氏液体培养基:葡萄糖30.0 g/L、硝酸钠2.0 g/L、三水合磷酸钾1.0 g/L、氯化钾0.5 g/L、七水合硫酸镁0.5 g/L、8-羟基喹啉0.75 g/L、去离子水1.0 L。
LB去铁液体培养基:酵母提取物5.0 g/L、氯化钠10.0 g/L、蛋白胨10.0 g/L、8-羟基喹啉0.75 g/L、去离子水1.0 L,pH自然(固体斜面培养基添加琼脂,15~20 g/L)。
TTC-LB液体培养基:40 mL常规无菌LB液体培养基中加入2.0 mL 0.1g/mL TTC溶液,混匀后密封保存备用。
1.3 分泌型铁载体产生菌定性初筛和定量复筛
从LB固体斜面培养基上活化的细菌中挑取单菌落接种至LB去铁液体培养基内,每株菌株3个重复,置于28℃微生物培养箱内培养2~3 d,当液体培养基表面出现浑浊时,吸取50 μL发酵培养液于96孔板内,加入等体积CAS检测液充分混匀,以饱和的EDTA溶液(与CAS检测液反应呈红色)为阳性对照,未接种的培养液与CAS检测液等体积混合作为阴性对照,观察并记录颜色变为红色、橙红色的培养液,并将相应菌株作为复筛菌株。
初筛入选的菌株用无铁查氏液体培养基于28℃ 150 r/min的恒温摇床(型号:HS-200B)上培养48 h,培养结束后吸取2~5 mL培养液用0.22 μm无菌滤膜过滤后加入等体积的CAS检测液,静置1 h后用全波长酶标仪(型号:Multiska GO)测定其OD630(记作“As”),用相同方法测定未接菌的液体培养基的OD630作为参比值(记作“Ar”)。铁载体的浓度用铁载体活性单位(siderophore unit, SU)表示,SU=[(Ar-As)/Ar]×100%,测定重复3次,取平均值进行比较分析。
1.4 复筛菌株铁载体的化学结构初步鉴定
1.4.1 异羟肟酸型铁载体
采用氯化铁检测法(FeCl3 test)鉴定:1 mL培养滤液中加入1 mL 2% FeCl3溶液,出现红色或紫色表明测试样品中含有铁载体物质。用紫外分光光度计检测,在420~450 nm 之间出现吸收峰则说明螯合物为异羟肟酸型铁载体。
1.4.2 儿茶酚型铁载体
采用氯化铁检测法鉴定:1 mL培养滤液中加入1 mL 2% FeCl3溶液,用紫外分光光度计检测,如果在495 nm附近出现吸收峰则说明螯合物为儿茶酚型铁载体。
1.4.3 羧酸型铁载体
采用分光光度法鉴定:1 mL培养滤液中加入1 mL 0.25 μmol/L CuSO4溶液和2 mL pH4.0的醋酸盐缓冲液,用紫外分光光度计检测,在190~280 nm之间出现吸收峰则说明螯合物为羧酸型铁载体。
1.5 菌株16S rDNA扩增测序、序列分析及菌落形态电镜观察
分泌型铁载体产生菌菌株的16S rDNA扩增测序参照王丽丽等[13]的方法。測序结果经BLAST 搜索(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)后与 GenBank数据库中相关种属的基因序列进行比较分析,选用同源性较高的模式菌株序列作为参比对象,用Clustal X 1.8软件进行多序列比对,计算供试菌株与参比菌株序列的相似性。系统发育分析时排除碱基缺失位点,采用邻接法(neighbor-joining analysis)用MEGA 7构建供试菌株与参比菌株之间的系统发育树。其中,Bootstrap值设定为1 000,其余均为默认值。分泌型铁载体产生菌菌落形态扫描电镜观察参照侯旭等[14]的方法。
1.6 EDTA对分泌型铁载体产生菌生长的影响
1.6.1 定性检测
采用微量稀释法进行定性检测,每菌株各3个重复。分别在96孔板内添加100 μL无菌TTC-LB液体培养基;A1~A12设置为阴性对照,只添加100 μL无菌TTC-LB液体培养基,不添加菌悬液,B1~B12设置为生长对照,添加100 μL无菌TTC-LB液体培养基和100 μL菌悬液;在C1、D1、E1孔内加入100 μL 20 mg/mL的无菌EDTA药液,并采用倍半稀释的方法对EDTA药液进行稀释,直至最后一孔,此时该三列孔内EDTA的浓度从左往右依次为:10、5、2.5……0.156 25 mg/mL,而后每孔再加入100 μL稀释好的菌悬液,此时每孔的药液浓度从左到右依次为:5、2.5、1.25……0.078 1 mg/mL;将96孔板放入30℃恒温培养箱培养16 h,定期观察并记录孔板的颜色变化。
1.6.2 定量测定
采用微量稀释法进行定量测定,每菌株各3重复。分别在96孔板内添加100 μL无菌LB液体培养基;A1~A12设置为阴性对照,只添加100 μL无菌LB液体培养基,不添加菌悬液,B1~B12设置为生长对照,添加100 μL无菌LB液体培养基和100 μL菌悬液;在C1、D1、E1孔内加入100 μL 20 mg/mL的无菌EDTA药液,并对EDTA药物进行倍半稀释直至最后一孔,此时该三列孔内浓度从左往右依次为:10、5、2.5……0.156 25 mg/mL,而后再加入100 μL稀释好的菌悬液,此时每孔的药液浓度从左到右依次为:5、2.5、1.25……0.078 1 mg/mL;将96孔板放入30℃恒温培养箱培养16 h,测定每块板的OD630,并根据公式计算EDTA对供试菌株的抑菌率。测定过程中,药品组吸光度值与生长对照组区别不大的孔样可忽略不计,仅明显低于对照组的样品的吸光度值才进行抑制率计算。计算公式如下:
抑制率=(生长对照组吸光度—药品组吸光度)/生长对照组吸光度×100%。
2 结果与分析
2.1 分泌型铁载体产生菌的定性初筛和定量复筛
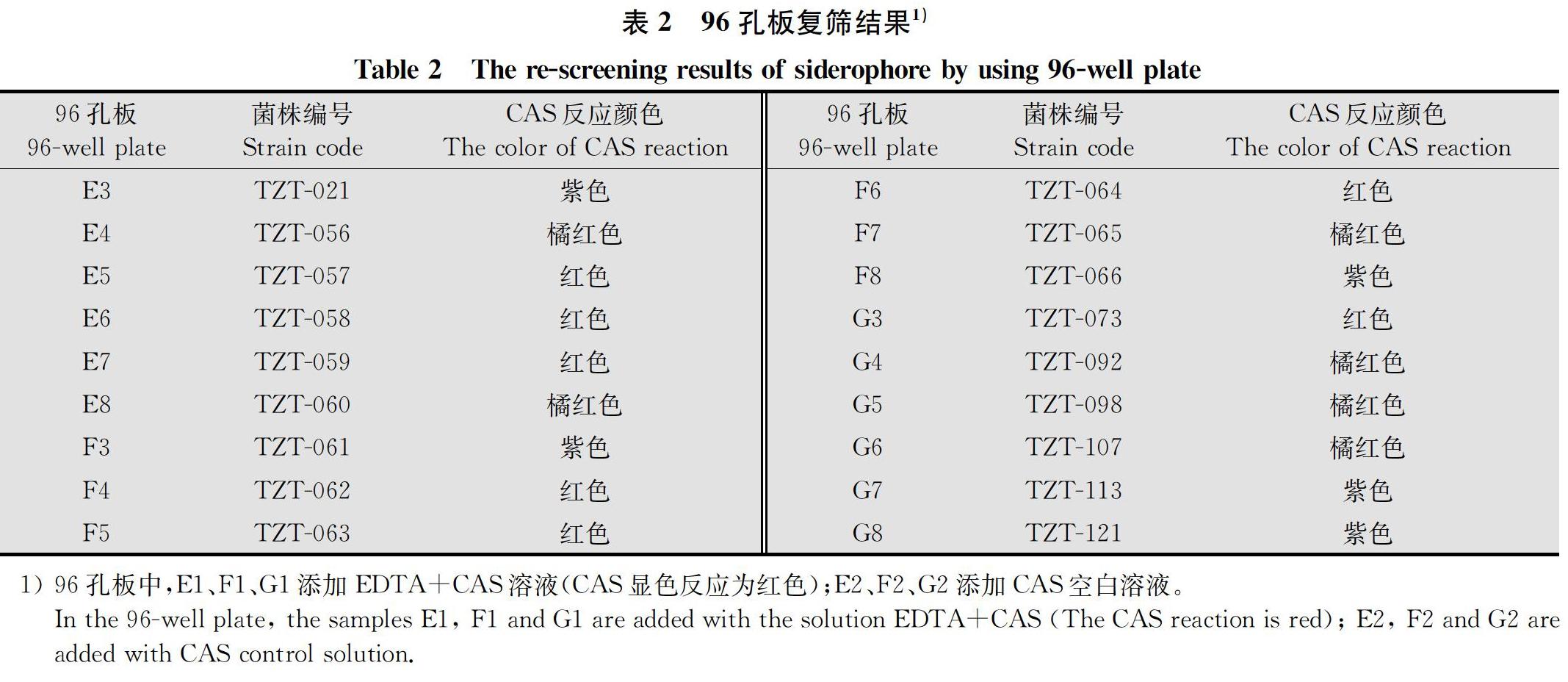
根据CAS检测液特有的显色反应,从42株供试细菌中初步筛选出18株有颜色变化的细菌,其中有13株为红色或橙红色,5株为紫色(表2),因而可将这18株细菌作为复筛目标菌株。根据18株复筛菌株培养液和CAS检测液混合后颜色变化的深浅可知,菌株TZT-057、TZT-058、TZT-059、TZT-062、TZT-063、TZT-064和TZT-073与CAS检测液显色反应过程较迅速,反应后呈鲜红色,表明分泌铁载体的活性最强。因而这7株复筛菌株作为后续研究对象。
如表3所示,复筛选出的7株优势菌株其As/Ar均小于0.5,且铁载体活性单位(SU)均大于50.0%,表明所选的7株优势菌株均为高产铁载体菌株。
2.2 复筛菌株铁载体类型的鉴定
如表4所示,菌株TZT-059、TZT-062、TZT-063、TZT-064能合成分泌儿茶酚型铁载体和异羟肟酸型铁载体,菌株TZT-057、TZT-058和TZT-073只能合成分泌儿茶酚型铁载体。
2.3 分泌型铁载体产生菌的分子生物学鉴定
2.3.1 菌株16S rDNA序列分析结果及系统发育进化树的构建
在初步形态鉴定的基础上,利用16S rDNA序列PCR扩增通用引物进一步对筛选到的7株高产铁载体优势菌株进行目标序列的PCR扩增、测序。测序结果在GenBank数据库中进行相似性搜索,并与同源性较高的典型标准菌株序列进行同源对比,明确菌株的生物学分类地位。
研究结果表明:菌株TZT-059(登录号:MH922846)、TZT-063(登录号:MH930397)和TZT-064(登录号:MH930398)的16S rDNA基因片段分别为1 439、1 441、1 445 bp。其中,菌株TZT-059和肺炎克雷伯氏菌K.pneumoniae(登录号:MF767577)的相似性达99.73%,TZT-063和肺炎克雷伯氏菌K.pneumoniae(登录号:KJ803926)的相似性达99.86%,TZT-064和肺炎克雷伯氏菌K.pneumoniae(登录号:KU937377)的相似性达99.85%,菌株间均具有极高同源性。
如图1所示,菌株TZT-057(登录号:MH922842)、TZT-058(登录号:MH922845)、TZT-062(登录号:MH930396)和TZT-073(登录号:MH820116)的16S rDNA基因片段分别为1 397、1 398、1 401 bp和1 351 bp。采用BLAST搜索与GenBank 数据库中收录序列比对,选择有详细信息的18株标准菌株(type culture strain)作为参比菌株,进行Clustal W多重比对,并构建系统发育进化树。菌株TZT-057、TZT-058和P.putida(登录号:NR114479)间具有极高同源性,初步鉴定为普罗特斯门,γ普罗特斯纲,假单胞菌目,假单胞菌科,假单胞菌属,恶臭假单胞P.putida。菌株TZT-062和A.lwoffii(登录号:NR026209)的相似性达99.76%,菌株间具有极高同源性,初步鉴定为变形菌门,γ-变形菌纲,假单胞菌目,莫拉氏菌科,不动杆菌属,鲁氏不动杆菌A.lwoffii。菌株TZT-073和D.zeae(登录号:NR041923)的相似性達99.81%,菌株间具有极高同源性,初步鉴定为变形菌门,γ-变形菌纲,肠杆菌目,果胶杆菌科,欧文氏菌属,迪克氏菌Dickeya zeae。
2.3.2 分泌型铁载体产生菌菌落形态电镜观察
4株产铁载体优势菌株经扫描电镜放大21 000倍后其形态结果如图2所示。菌株TZT-057为椭圆状单球菌,直径0.63~0.75 μm,菌株表面附着一层细且短的菌毛,顶端着生粗且长的丝状单生鞭毛;菌株TZT-058为长杆状菌,长2.26 μm,宽0.71 μm,菌株表面附着少量细短的菌毛,顶端着生粗且长的丝状单生鞭毛;菌株TZT-062呈圆球状,为双球菌,直径0.86~0.88 μm,菌株表面无菌毛,顶端着生略短的单生鞭毛;菌株TZT-073为长杆状菌,长2.14 μm,宽0.84 μm,菌株表面附着一层细短的菌毛,顶端着生粗且长的丝状鞭毛。
2.4 EDTA对分泌型铁载体产生菌生长的影响
根据微量稀释法对7株优势菌株定性、定量抑菌活性测定结果及判定标准可知,EDTA对菌株TZT-058(Accession no.MH922845)、TZT-073(Accession no.MH820116)有较好的抑菌活性。菌株TZT-058生长对照组吸光度值为0.505 1,药品组平均吸光度值为0.074 9,根据计算公式,EDTA对菌株TZT-058的抑菌率为85.16%,对应的最低抑菌浓度为0.019 5 mg/mL;菌株TZT-073生长对照组吸光度值为0.296 4,药品组平均吸光度值为0.059 1,根据计算公式,EDTA对菌株TZT-058的抑菌率为80.08%,对应的最低抑菌浓度为0.312 5 mg/mL。结果表明,当培养环境中存在强螯合剂EDTA时,其能更有效地干预病原细菌对铁元素的摄取过程,影响自身的各项机能代谢活动,抑制生长繁殖。
3 讨论
EDTA能与铁离子特异性螯合,且可溶性的铁离子又在微生物各项机能代谢过程中发挥着重要作用。前期研究表明,当植物病原菌培养环境中存在EDTA溶液时,EDTA能利用其较强的螯合能力更有效的竞争环境中的铁离子,使病原物处于缺铁胁迫条件,延缓铁蛋白复合物的形成,直接影响病原物对铁离子的吸收利用机制,进而抑制其生长繁殖,起到防控病害的作用。本研究首次以植物病原细菌为筛选靶标,采用CAS检测法和光吸收法对42株不同宿主植物病原细菌进行产铁载体活性筛选,并确定7株高产铁载体的优势菌株。经铁载体化学结构的初步鉴定,所产铁载体类型为异羟肟酸型和儿茶酚型。有研究指出,细菌主要合成分泌异羟肟酸型和儿茶酚型铁载体[15],本研究结果与之相吻合。此外,比较分析本研究两种类型铁载体的铁螯合能力,儿茶酚型>异羟肟酸型,与Wang等[16]的研究结果一致;此外,本研究筛选到的7株植物病原菌均能分泌儿茶酚型铁载体,且SU均大于50%。本研究还开展了抑菌药物EDTA对优势菌株的抑菌活性研究,结果表明EDTA对P.putida和D.zeae均具有较好的抑菌活性。
经分子生物学鉴定,本研究筛选到7株产铁载体优势菌株均为革兰氏阴性菌,K.pneumoniae 3株、P.putida 2株、A.lwoffii和D.zeae各1株。目前尚未有关于A.lwoffii和D.zeae分泌铁载体的研究报道,因而本研究筛选出的这两株菌株可作为后续铁载体相关研究工作的优选材料。目前,已有大量关于克雷伯氏菌属、假单胞菌属、不动杆菌属和欧文氏菌属微生物分泌铁载体的研究报道。肺炎克雷伯氏菌为常见的高产铁载体微生物,目前国内外学者对其研究较为全面[1012]。假单孢菌属也是常见的高产铁载体优势属,研究者们先后从不同寄主植株或根际土壤中发现铜绿假单胞菌[17]、荧光假单胞菌[18]、恶臭假单胞菌[1921]、栖稻黄色假单胞菌[22]、沼泽红假单胞菌[23]、草假单胞菌[24]、摩氏假单胞菌[25]、地中海假单胞菌[26]等不同种的微生物均能分泌铁载体,且主要为儿茶酚型铁载体。此外,研究者们还从醋酸钙不动杆菌[27]、鲍曼不动杆菌[28]、溶血不动杆菌[29]、约氏不动杆菌[30]、嗜油不动杆菌[31]和皮氏不动杆菌[32]等不动杆菌属微生物中筛选到分泌型铁载体产生菌,并对所产铁载体的化学结构和形式作了详细的解析。目前,有关欧文氏菌属分泌铁载体的研究还较少,仅发现胡萝卜软腐欧文氏菌[33]、解淀粉欧文氏菌[34]、菊欧文氏菌[35]和草生欧文氏菌[36] 4个种的微生物能分泌合成铁载体。
本研究从植物病原菌中筛选高产铁载体的优势菌株,以期解析分泌型铁载体在植物体内或根际土壤中的响应机制,以及分泌型铁载体介导的寄主与病原互作机制,为植物病害防治提供新的作用靶点,同时也在生防菌的开发应用等方面具有重要的实践意义。
参考文献
[1] WANG Zongping, GUO Yizhou, LIU Zizheng, et al. Catechin as a new improving agent for a photo-Fenton-like system at near-neutral pH for the removal of inderal [J]. Photochemical & Photobiological Sciences Official Journal of the European Photochemistry Association & the European Society for Photobiology, 2015, 14(2): 473480.
[2] ARIFK K, ARCHANA G, DESAI A J. Engineering heterologous iron siderophore complex utilization in rhizobia: Effect on growth of peanut and pigeon pea plants [J]. Applied Soil Ecology, 2012, 53(1): 6573.
[3] MUSIANI F, CIURLI S. Evolution of macromolecular docking techniques: the case study of nickel and iron metabolism in pathogenic bacteria [J]. Molecules, 2015, 20(8): 1426514292.
[4] AHMED E, HOLMSTROM S J M. Siderophores in environmental research: roles and applications [J]. Microbial Biotechnology, 2014, 7(3): 196208.
[5] GASSER V, GUILLON L, CUNRATH O, et al. Cellular organization of siderophore biosynthesis in Pseudomonas aeruginosa: Evidence for siderosomes [J]. Journal of Inorganic Biochemistry, 2015, 148: 2734.
[6] LOCHHEAD A G, BURTON M O, THEXTON R H. A bacterial growth-factor synthesized by a soil bacterium [J]. Nature, 1952, 170(4320): 282.
[7] FRANCIS J, MADINAVEITIA J. Isolation from acid-fast bacteria of a growth-factor for Mycobacterium johnei and of a precursor of phthiocol [J]. Nature, 1949, 163(4140): 365366.
[8] 钱丽红. 茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J]. 微生物学通报, 2010, 37(11): 16281633.
[9] 刘侃, 郝葆青, 伍红. 沼泽红假单胞菌对金黄色葡萄球菌抑制作用的试验[J]. 黑龙江畜牧兽医, 2018(8): 171174.
[10]毛得奖, 朱亚玲, 韩宁. 假单胞菌铁载体及色素研究[J]. 微生物学通报, 2013, 40(3): 500516.
[11]周婷, 陈吉祥, 杨智, 等. 一株嗜油不动杆菌(Acinetobacter oleivorans)的分离鉴定及石油降解特性[J]. 环境工程学报, 2015, 9(11): 56265632.
[12]徐水宝, 金嘉琳. 高毒力肺炎克雷伯菌的分子致病机制[J]. 微生物与感染, 2017, 12(5): 320326.
[13]王丽丽, 周旭东, 李国安, 等. 番茄青枯病病原菌拮抗菌株的筛选及其田间防控作用研究[J]. 植物保护, 2017, 43(1): 182185.
[14]侯旭, 张国庆, 胡晓, 等. 桃褐腐病菌拮抗性内生细菌的筛选及其抑病效果[J]. 微生物学通报, 2017, 44(8): 1874188.
[15]HAAS H. Molecular genetics of fungal siderophore biosynthesis and uptake: the role of siderophores in iron uptake and storage [J]. Applied Microbiology & Biotechnology, 2003, 62(4): 316330.
[16]WANG Zongping, LIU Zizheng, YU Fang, et al. Siderophore-modified fenton-like system for the degradation of propranolol in aqueous solutions at near neutral pH values [J]. Chemical Engineering Journal, 2013, 229(8): 177182.
[17]朱慧明, 張彦, 杨洪江. 高产铁载体假单胞菌的筛选及其对铁氧化物的利用[J]. 生物技术通报, 2015, 31(9): 177182.
[18]赵翔, 陈绍兴, 谢志雄, 等. 高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f的筛选鉴定及其铁载体特性研究[J]. 微生物学报, 2006, 46(5): 691695.
[19]于素芳, 丁延芹, 姚良同, 等. 一株棉花根际铁载体产生菌E19的分离鉴定[J]. 生物技术, 2007, 17(6): 1921.
[20]BAR-NESS E, CHEN Y, HADAR Y, et al. Siderophores of Pseudomonas putida as an iron source for dicot and monocot plants [J]. Plant & Soil, 1991, 130(1/2): 231241.
[21]VENTURI V, OTTEVANGER C, BRACKE M, et al. Iron regulation of siderophore biosynthesis and transport in Pseudomonas putida WCS358: involvement of a transcriptional activator and of the Fur protein [J]. Molecular Microbiology, 2010, 15(6): 10811093.
[22]滕松山, 刘艳萍, 赵蕾. 具ACC脱氨酶活性的碱蓬内生细菌的分离、鉴定及其生物学特性[J]. 微生物学报, 2010, 50(11): 15031509.
[23]胡碧惠, 赵春贵, 杨素萍. 铁对产铁载体的沼泽红假单胞菌光合色素与铁载体合成的影响[J]. 微生物学报, 2014, 54(4): 408416.
[24]梅新兰, 闪安琪, 蒋益, 等. 适应玉米的溶磷细菌筛选及其对玉米生长的影响[J]. 土壤学报, 2016, 53(2): 502509.
[25]黄伟红, 丁延芹, 姚良同, 等. Pseudomonas mosselii E1铁载体合成相关基因cysI的克隆与功能初步分析[J]. 微生物学报, 2007, 47(5): 910913.
[26]田方, 丁延芹, 朱辉, 等. 烟草根际铁载体产生菌G-229-21T的筛选、鉴定及拮抗机理[J]. 微生物学报, 2008, 48(5): 631637.
[27]NUDEL C, GONZALEZ R, CASTANEDA N, et al. Influence of iron on growth, production of siderophore compounds, membrane proteins, and lipase activity in Acinetobacter calcoaceticus BD 413 [J]. Microbiological Research, 2001, 155(4): 263269.
[28]YAMAMOTO S, OKUJO N, SAKAKIBARA Y. Isolation and structure elucidation of acinetobactin, a novel siderophore from Acinetobacter baumannii [J]. Archives of Microbiology, 1994, 162(4): 249254.
[29]OKUJO N, SAKAKIBARA Y, YOSHIDA T, et al. Structure of acinetoferrin, a new citrate-based dihydroxamate siderophore from Acinetobacter haemolyticus [J]. Biometals An International Journal on the Role of Metal Ions in Biology Biochemistry & Medicine, 1994, 7(2): 170176.
[30]TIAN Shijing, MUHAMMAD A, XIE Li, et al. Genome-sequence analysis of Acinetobacter johnsonii MB44 reveals potential nematode-virulent factors [J/OL]. SpringerPlus, 2016, 5(1): 986.https:∥doi.org/10.1186/s4006401626685.
[31]NEILANDS J B. Microbial iron compounds [J]. Annual Review of Biochemistry, 2003, 50(1): 715731.
[32]ZANDER E, BONNIN R A, SEIFERT H, et al. Characterization of blaOXA-143 variants in Acinetobacter baumannii and Acinetobacter pittii [J]. Antimicrobial Agents & Chemotherapy, 2014, 58(5): 27042708.
[33]BULL C T, ISHIMARU C A, LOPER J E. Two genomic regions involved in catechol siderophore production by Erwinia carotovora [J]. Applied & Environmental Microbiology, 1994, 60(2): 662669.
[34]SMITS T H, DUFFY B. Genomics of iron acquisition in the plant pathogen Erwinia amylovora: insights in the biosynthetic pathway of the siderophore desferrioxamine E [J]. Archives of Microbiology, 2011, 193(10):693699.
[35]FRANZA T, MAHE B, EXPERT D. Erwinia chrysanthemi, requires a second iron transport route dependent of the siderophore achromobactin for extracellular growth and plant infection [J]. Molecular Microbiology, 2010, 55(1):261275.
[36]BERNER I, KONETSCHNY-RAPP S, JUNG G, et al. Characterization of ferrioxamine E as the principal siderophore of Erwinia herbicola (Enterobacter agglomerans) [J]. Biology of Metals, 1988, 1(1):5156.
(責任编辑:田 喆)
收稿日期: 20190317 修订日期: 20190512
基金项目:国家自然科学基金(31600349,31660600,31760019);国家公益性行业(农业)科研专项(201503119-03-02)
致 谢: 参加本试验部分工作的还有江代礼、谭翰杰、张能和纪烨斌等同学,特此一并致谢。
通信作者 E-mail:398036877@qq.com
# 为并列第一作者

