等效均匀剂量在乳腺癌保乳术后调强放射治疗优化中的应用
孙 博 陈星宇 王俊杰*
当前,乳腺癌发病率增高,并呈现年轻化趋势,早期乳腺癌保乳术后行全乳放射治疗可增加局部控制率,但放射治疗可能引起危及器官(organ at risk,OAR)的不良反应,而靶区剂量的均匀性是影响美容效果的重要因素之一。目前,调强放射治疗(intensity modulated radiation therapy,IMRT)计划常用剂量体积(dose volume,DV)进行剂量优化,约束条件对剂量-体积直方图(dose-volume histogram,DVH)上指定的点起作用,而不能对整个DVH曲线进行优化[3]。虽然优化结果中靶区内冷点区域可接受,但冷点的存在可能会导致肿瘤未控或复发。使用等效均匀剂量(equivalent uniform dose,EUD)进行优化,可以提高靶区内冷点剂量,降低OAR受照剂量[4]。
本研究尝试通过应用EUD优化,提高早期乳腺癌保乳术后调强计划靶区剂量均匀性,减少靶区冷点导致的肿瘤未控或复发,提高肿瘤局部控制率和生存率,减少放射治疗对患侧肺和健侧乳腺产生的不良反应,同时也提高了美容效果。在OAR中使用EUD优化可降低正常器官受照剂量,降低放射性肺炎的发生率,放射性心脏病和健侧乳腺第二肿瘤的发生[3]。本研究对接受保乳术后调强放射治疗的早期乳腺癌患者在计划设计时使用EUD优化的剂量学特点进行分析和比较。
1 资料与方法
1.1 临床资料
采用数表法随机选取于2016年在北京大学国际医院接受保乳术后行IMRT的15例左侧早期乳腺癌患者,年龄35~50岁,中位年龄42岁;手术切缘为阴性,术后病理分期为pT1~2N0M0,卡氏评分(Karnofsky)状态评分>90分。根据PTV和OAR,按不同的优化方法分为PTV组、PTV+EUD组和PTV+OAR+EUD组进行计划设计。所有患者均签署知情同意书。
1.2 仪器设备
采用590RT型大孔径CT模拟定位机(美国GE公司);Truebeam直线加速器(美国瓦里安公司);Varian Eclipse治疗计划系统(treatment planning system,TPS)(美国瓦里安公司)。
1.3 治疗方法
1.3.1 模拟定位
患者行仰卧位,采用头臂托加真空垫固位,手臂置于头臂托支架上,患侧乳腺轮廓用铅丝标记。采用590RT型大孔径CT模拟定位机在患者平静呼吸下进行CT扫描,扫描层厚5 mm,扫描范围从环状软骨至肝脏的下缘。图像传输至Varian Eclipse TPS进行靶区和OAR勾画。
1.3.2 靶区勾画
由医生勾画靶区及OAR,临床靶区(clinical target volume,CTV)为术后全部乳房,计划靶区(planning target volume,PTV)为CTV在头足方向外放1 cm,胸骨、腋窝及肺方向外放0.5 cm,皮肤方向不外放(限皮下0.5 cm)。OAR勾画双侧肺、脊髓、心脏及健侧乳腺。
1.3.3 计划设计
采用Eclipse TPS13.5治疗计划系统,使用Truebeam直线加速器,采用6 MV X射线治疗。根据PTV和OAR,按不同的优化方法分3组进行计划设计。①PTV组,对PTV及OAR进行DV优化;②PTV+EUD组,对PTV进行DV和EUD优化,OAR进行DV优化;③PTV+OAR+EUD组,对PTV及OAR进行DV和EUD优化。计划设计布野角度外侧范围为115°~140°,内侧角度范围为290°~320°。3种方式均设计4野调强计划,从乳腺切线方向布野,角度间隔为15°[5-6](见图1)。
图1 乳腺切线方向布野角度
计算网格大小为2.5 mm。为提高靶区适形度,在患者体内形成1.5 cm×3.5 cm的距靶区限量环(R1)。
1.3.4 计划优化
(1)DV优化。PTV及OAR优化条件包含最大剂量、最大体积、最小剂量和最小体积,PTV处方剂量均为50 Gy,单次2 Gy,共25次。靶区要求100%处方剂量包绕95%的PTV,110%处方剂量的体积为0,优化权重为150。OAR限量患侧肺受到20 Gy剂量照射的肺体积(V20)<15%,心脏V30<10%,健侧乳腺最大剂量(Dmax)<5 Gy,优化权重为100。
(2)EUD优化。在DV优化基础上添加的优化,包括最大EUD,最小EUD,a值。PTV靶区Dmina=-30,Dmaxa=35。患侧肺和心脏的Dmaxa=2。健侧乳腺的Dmaxa=15。
(3)EUD。用于评价某一肿瘤组织或者正常组织受到不均匀剂量照射的生物学效应[7-8]。EUD计算为公式1:
式中N是一个组织结构中体素数目;Di是第i个体素的剂量;a是该组织的生物学参数(对DV反应的描述,a表示一定照射剂量或受累剂量对肿瘤和OAR的生物效应)。a<0时用于肿瘤组织,越小代表肿瘤组织的生物效应受到剂量冷点的影响越大;当a>0时,用于控制高剂量,a值越大组织对高剂量热点的影响越大[9-10]。
1.4 评价指标
计划满足100%的剂量包绕95%的PTV,对PTV组分别与PTV+EUD和PTV+OAR+EUD组的靶区的最大剂量(Dmax),2%体积的剂量(D2%),平均剂量(Dmean),中位剂量(Dmedian),最小剂量(Dmin),超过处方剂量105%的体积V105,适形度指数(conformity index,CI)和均匀度指数(homogeneity index,HI)。OAR肺V20、V10和V5的平均肺部剂量(mean lung dose,MLD),心脏(V25,V30,V40,Dmean)[11]和健侧乳腺(V5,Dmean)的受照剂量进行评价比较。CI和HI计算为公式2和公式3:

式中Vt,ref为参考等剂量线面所包绕的靶区体积,Vt为靶区体积,Vref为参考等剂量线面所包绕的体积[13]。CI值范围是 0~1,值越大,表示适形度越好。

式中D2为PTV2%体积接受的剂量,D98为PTV 98%体积接受的剂量,D50为PTV 50%体积接受的剂量,HI越接近于0,均匀性越好。
1.5 统计学方法
利用SPSS22统计软件进行数据处理,采用配对t检验分析,计量资料数据经正态性检验符合正态分布。选择95%置信区间(confidence interval,95%CI),用均数±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 靶区剂量学比较
PTV+EUD组的PTV的CI和HI均优于PTV组,差异有统计学意义(t=5.002,t=5.668;P<0.05),PTV+EUD组较PTV组Dmin提升了5%,差异有统计学意义(t=-3.909,P<0.05),V105体积降低了26.8%,差异有统计学意义(t=6.74,P<0.05)。PTV+OAR+EUD组PTV的CI和HI均劣于PTV组,差异有统计学意义(t=4.154,t=-4.265,P<0.05),PTV+OAR+EUD组较PTV组Dmin剂量提升了4.8%,差异有统计学意义(t=-2.713,P<0.05),V105体积增加了36.4%,差异有统计学意义(t=-3.102,P<0.05),见表1。
表1 三组计划各项指标靶区剂量比较(±s)
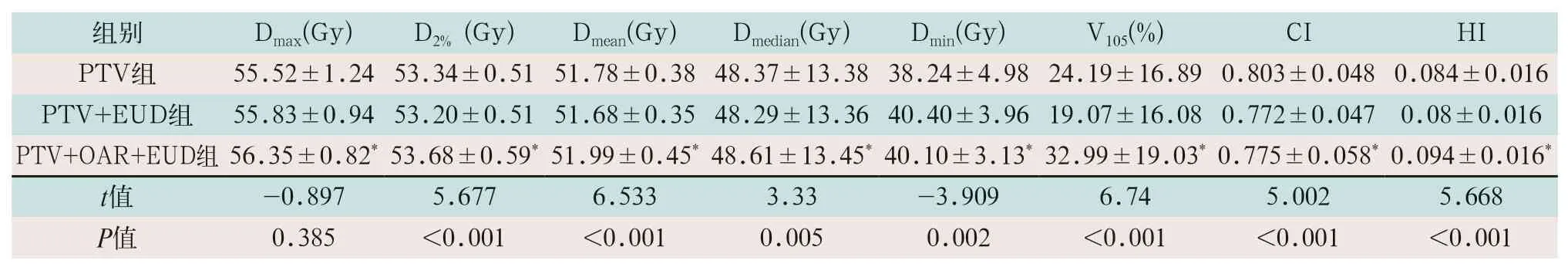
表1 三组计划各项指标靶区剂量比较(±s)
注:表中*为PTV+OAR+EUD组与PTV组各项指标比较,差异有统计学意义(t=-2.67,t=-3.127,t=-3.953,t=-4.03,t=-2.713,t=-3.102,t=4.154,t=-4.265;P<0.05)
表2 三组OAR剂量参数比较(±s)
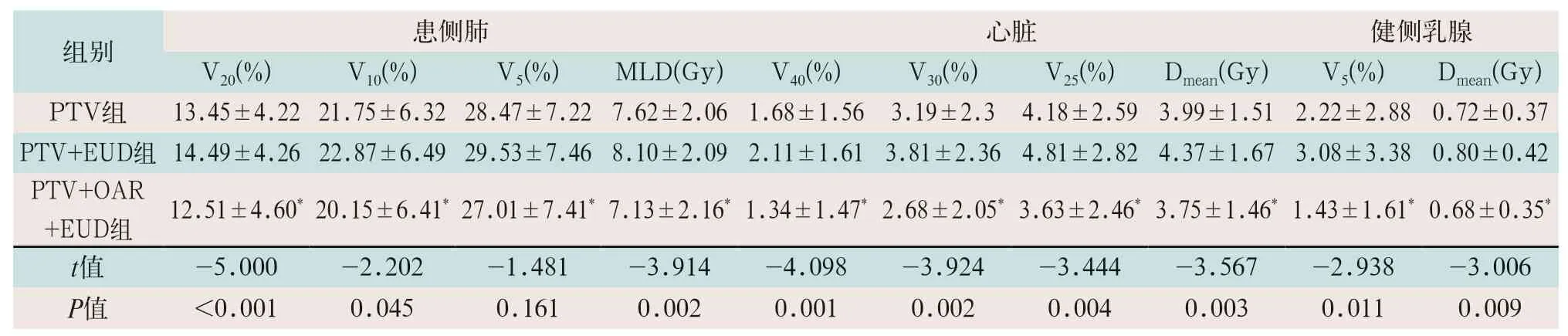
表2 三组OAR剂量参数比较(±s)
注:①表中*为PTV+OAR+EUD组与PTV组比较,差异有统计学意义(t患侧肺=5.95,t=4.172,t=4.156,t=7.182;t心脏=2.73,t=3.8,t=4.041,t=3.79;t健侧乳腺=1.844,t=2.351;P<0.05);②MLD为平均肺部计量
2.2 OAR剂量学比较
同侧肺受照剂量比较中,PTV+EUD组的V20、V10、MLD高于PTV组计划,差异有统计学意义(t=-5.000,t=-2.202,t=-3.914;P<0.05),PTV+OAR+EUD组的V20、V10、V5、MLD低于PTV组计划,差异有统计学意义(t=5.95,t=4.172,t=4.156,t=7.182;P<0.05)。心脏的受照剂量体积比较中PTV+EUD组的V40、V30、V25、Dmean均高于PTV组,差异有统计学意义(t=-4.098,t=-3.924,t=-3.444,t=3.567;P<0.05);PTV+OAR+EUD组的V40、V30、V25、Dmean均低于PTV组,差异有统计学意义(t=2.730,t=3.800,t=4.041,t=3.790;P<0.05)。健侧乳腺的受照剂量体积比较中,PTV+EUD组的V5、Dmean均高于PTV组,差异有统计学意义(t=-2.938,t=-3.006;P<0.05);PTV+OAR+EUD组的V5、Dmean均低于PTV组,差异有统计学意义(t=1.844,t=2.351;P<0.05),见表2。
3 讨论
本研究结果显示,PTV+EUD组与PTV组比较,PTV的Dmin、V105评价指标明显均优于PTV组,具有显著性差异。但同时也增加了OAR的受照剂量。PTV+OAR+EUD组与PTV组相比,PTV+OAR+EUD组靶区的CI和HI值变差,除健侧乳腺V5以外OAR的受照剂量均有降低,PTV的冷点剂量有提升,且PTV热点剂量升高[14-16]。若只针对患侧肺和PTV进行DV与EUD优化后,其他OAR使用DV优化,患侧肺的受量降低,PTV的Dmin略有降低,PTV其他评价指标与DV优化无差异[17]。DV优化可以根据临床要求确切的给出优化条件,但EUD优化是整体优化,临床做计划时,对于要降低多个剂量体积限制的OAR,可以先用EUD优化,对于不达标的某一剂量体积限值的OAR,辅助增加使用DV优化。
DV优化是以剂量或者剂量体积为基础,EUD优化与放射治疗的生物效应有关,根据公式(1),EUD的优化是对目标函数所有体素的优化,EUD优化a值的不同,产生的剂量分布结果不同。a<0时,用于肿瘤组织优化,a值越小,对于靶区Dmin的作用力越强[7]。当a>0时,用于靶区和OAR,a值越大,对于靶区的Dmax的作用力越强。Eclipse TPS13.5的a值推荐范围是-40≤a≤40,如a<-10时,用于靶区,随着a值的减小,Dmin值增大,当a≥-25时,对于冷点的作用效果不明显,当a<-25时,Dmin值增大明显[18]。a=1时用于OAR的优化,相当于限制Dmean。a取较小值时,如a<4时,用于并行器官,当a值趋近于1时,DVH上体现为剂量均匀减少,当a值越大时,高剂量区域的剂量降低明显。串行器官a取较大值时,如a>8,8<a≤25时,随a值的增大Dmax减小明显,25<a≤40时,Dmax减小幅度平缓;对于PTV,DV优化基础上单独使用EUD降低热点时,不论a值为多少,对于Dmax作用均不明显。但使用EUD提高Dmin时,若不同时使用EUD降低Dmax,则随a值的减小,Dmax增大明显[19]。此外,EUD优化可简化优化参数,与DV优化相比,EUD优化使用单一目标函数,可以降低DVH上某一体积范围的受照剂量。例如,在乳腺癌保乳术后的计划中,限制肺20 Gy以内的体积时,单独使用物理函数需使用至少3个剂量体积限值,若使用EUD优化,可用剂量10 Gy,a取1.5~2.5[15,20]。所以使用EUD优化,可减少优化时间,提高优化效率。
本研究中根据15例乳腺癌保乳术后病例,因切线野调强技术比其他技术更能提高靶区的适形度和降低OAR受照剂量,因此采取切线固定野滑窗技术。但在优化过程中,调整心脏和患侧肺的受照剂量对PTV评价参数的影响较大,同时乳腺弯曲程度的不同,患侧肺和心脏的受照剂量差异较大,尤其是心脏的高剂量区域,以及靶区的V105、Dmean、Dmedian、CI和HI的变差,与计划实施技术有关。对于乳腺体积较小且弯曲度较大的病例,可使用VMAT技术,提高靶区的均匀性和适形度,但OAR低剂量区的受照剂量会增高,根据临床病例要求分析后选择相应技术[20-21]。
4 结论
DV优化是目前常用的优化函数,使用这种优化方法可以达到临床较满意的效果。使用EUD优化可以提高优化效率,对有剂量体积限制的OAR进行优化可以简化条件。在PTV的DV优化的基础上增加EUD优化,可提高靶区剂量均匀性和Dmin,不符合剂量限制要求的OAR使用EUD优化可降低受照剂量。目前基于EUD优化目标函数,a值是参照等效生物函数方程拟合还是通过多次实验结果得到,还需要大量的临床实验数据来验证。

