局部进展期直肠癌围放疗期外周血免疫功能指标的变化
陈若,沈琦,罗文广,雕丽琼,张红雁
(安徽医科大学附属省立医院、安徽省立医院肿瘤放疗科,合肥 230001)
直肠癌是我国常见的消化道肿瘤之一,在全球恶性肿瘤发病率中居第3 位,死亡率居第4 位[1-2]。由于直肠癌解剖位置局限在狭窄的骨盆内,增加了手术时保证完整切缘阴性的难度,也在一定程度上导致治疗后出现并发症风险增大、局部复发率增高,特别是对于局部进展期直肠癌,预后不良的比率更高[3]。现直肠癌的治疗方式有手术治疗、化学药物治疗、放射治疗等,且直肠癌治疗全程化的管理越来越趋向精细化、个性化。因此,如何利用多学科综合治疗的模式来提高直肠癌精准治疗程度以及降低直肠癌的死亡率,成为目前直肠癌临床研究中亟待解决的问题之一。
本研究通过流式细胞技术检测直肠癌患者围放疗期外周血T 淋巴细胞、CD4+T 细胞、调节性T 细胞(Treg 细胞)、自然杀伤细胞(NK 细胞)、血小板与淋巴细胞比值(PLR)的变化情况。
1 对象和方法
1.1 研究对象 选择安徽省立医院肿瘤放疗科2018 年1 月到2019 年10 月共54 例接受放射治疗的直肠癌患者,其中男性35 例,女性19 例;年龄范围27~87 岁,平均年龄为55.96 岁;病理为高分化腺癌8 例,中分化腺癌33 例,低分化腺癌13 例;根据美国癌症联合委员会(AJCC)制订的第8 版TNM分期标准Ⅱ期14 例,Ⅲ期40 例。术前短程快速大分割放疗9 例,术前常规分割放疗17 例,术后常规分割放疗28 例。本研究经安徽省立医院医学伦理委员会批准(伦理批件号:2019KY 伦审第101 号)。
1.2 纳入与排除标准 纳入标准:病理为直肠腺癌的患者;(2)无严重心、肝、肾功能不全,无全身性严重疾病;(3)未同时接受免疫治疗的患者;(4)MSS(microsatellite stable,微卫星稳定)基因检测未检测到MSI-H(microsatellite instability-high,高度微卫星不稳定);(5)无其他肿瘤以及放疗前CT、MRI 等各项影像学检查提示未见远处器官转移;(6)按照术前(已行手术患者)或放疗前(未行手术患者)定位扫描时MRI 分期,选择TNM 分期为Ⅱ-Ⅲ期的患者;(7)自愿参加并签署知情同意书。排除标准:(1)有远处转移的患者;(2)曾合并其他恶性肿瘤的患者;(3)同时接受慢性系统性免疫治疗的患者;(4)患者依从性差,不能配合完成本研究的信息采集。
1.3 治疗方案
1.3.1 方案推荐 局部进展期直肠癌患者现推荐行“新辅助放化疗+手术”或“手术+术后辅助放化疗”,采用6Mv-X 线IMRT(intensity-modulated radiation therapy,适形调强放疗)治疗,给予全盆腔照射,剂量分割方式有两种,25 Gy/5f/1 周和50 Gy/25f/5 周。
1.3.2 靶区勾画 (1)术前靶区定义:GTVnd(lymph node gross tumor volume,阳性淋巴结大体肿瘤体积)包含直肠MRI/盆腔CT 显示的直肠系膜区、骶前区、髂总、髂内、闭孔以及髂外大于1 cm 的转移淋巴结和癌结节。CTVp(primary tumor CTV,原发肿瘤临床靶区)特指原发灶的临床靶区,包括原发灶头脚方向外扩2 cm 的范围。CTV(clinical target volume,临床靶区)为包括高危淋巴结引流区,部分髂总、髂内、髂外(下界到股骨头出现水平)、闭孔、骶前、直肠系膜区以及腹股沟淋巴引流区(视患者具体情况确定是否包括),PTV(plan target volume,计划靶区)在CTVp 和CTV 基础上前后左右外放0.5~0.7 cm。(2)术后靶区定义:包括瘤床、吻合口[经腹直肠癌切除术(Dixon 术)]、会阴瘢痕(腹会阴联合直肠癌根治术(Miles 术)、术后高危淋巴结引流区及高危复发区,部分髂总、髂内、髂外(下界到股骨头出现水平)、闭孔、骶前、直肠系膜区以及腹股沟淋巴引流区,PTV 在CTV 基础上前后左右外放0.5~0.7 cm。正常组织限量:膀胱V50<50%,小肠V50<10%、最大剂量小于52 Gy,股骨头V50<5%。
1.3.3 具体方案 本研究根据患者个体化情况,治疗方案分为3 种:(1)术前短程大分割放疗(放疗后7~10 d 行手术)(2)术前常规分割放疗同步化疗(放疗后4~6 周行手术)(3)术后常规分割放疗同步化疗(术后4 周至6 周行放疗)。同步化疗方案为卡培他滨(正大天晴药业集团股份有限公司/上海罗氏制药有限公司产)化疗(卡培他滨剂量根据患者体表面积计算,用量为825 mg/m2,1 日2 次,每周第1 天至第5 天服用)。
1.4 检测方法 于研究对象实施第1 次放疗前1天、放疗计划结束后1 天及放疗结束后1 月抽取患者静脉血2 mL,采用流式细胞术检测患者外周血T细胞亚群的占比,采用三激光10 色法,检测患者血清T 淋巴细胞、CD4+T 细胞及NK 细胞占淋巴细胞百分比、Treg 细胞占CD4+T 细胞百分比。
1.5 统计学处理 应用SPSS 22.0 分析数据。主要数据为多时点观测计量资料,以描述,组间比较为单因素重复测量方差分析+组内各时点间两两比较差值t 检验。 P <0.05 为差异有统计学意义。
2 结果
2.1 外周血免疫功能指标变化 患者外周血T 淋巴细胞、CD4+T 细胞、Treg 细胞及NK 细胞绝对值放疗结束时较放疗开始时下降,放疗结束后1 月较放疗结束时绝对值升高,差异均有统计学意义。PLR 放疗结束时较放疗前升高,放疗结束后1 月较放疗结束时下降,差异有统计学意义。见表1。
2.2 相关性分析 Treg 细胞与PLR 的表达水平呈负相关,相关系数为-0.453,差异有统计学意义(P <0.05)。NK 细胞与PLR 的表达水平呈负相关,相关系数为-0.545,差异有统计学意义(P <0.05)。T 淋巴细胞与PLR 的表达水平呈负相关,相关系数为-0.604,差异有统计学意义(P <0.05)。CD4+T细胞与PLR 的表达水平呈负相关,相关系数为-0.592,差异有统计学意义(P <0.05)。
2.3 随访结果 截止至2020 年1 月,仅有4 例患者出现病情进展,各项指标与无进展组差异无统计学(P >0.05)。
3 讨论
目前直肠癌个体化精准治疗模式仍在不断探索中,荷兰的NICHE 研究[4]、checkmate 142 研究[5]等现在正在进行的研究都表明了免疫治疗对于提高患者直肠癌的缓解率有较大作用。近年来,直肠癌治疗领域除了放疗、手术、化疗和靶向治疗[6],已成为一个新的研究热点。本研究选择LARC 患者,采集患者放化疗期间外周血,通过观察、了解T 细胞亚群及NK 细胞等的变化,寻找免疫细胞在放射治疗模式中的作用机制,并寻找新的能在直肠癌治疗策略中评估预后、防止不良事件发生的特异性指标。
肿瘤微环境是一个复杂的系统[7],T 淋巴细胞作为细胞免疫中重要的一环,在肿瘤的发生、发展中有着不可或缺的作用[8-9]。本研究中LARC 癌患者T 淋巴细胞绝对值、CD4+T 细胞绝对值于放疗结束后到结束后1 月时免疫功能有一定回升的趋势,一定程度证明了放射治疗结束后患者免疫能力得到恢复。临床上可通过T 淋巴细胞亚群的检测来了解直肠癌患者机体免疫系统情况,为预后的预测以及治疗方案选择提供新思路。
在肿瘤微环境中,Treg 细胞占正常人外周血及脾脏组织中的CD4+T 细胞的5%~10%[10-11]。细胞缺乏或细胞功能障碍是恶性肿瘤患者自身免疫紊乱的原因[12-13],因此,它们是设计诱导或消除自身和非自身抗原的免疫耐受的良好靶点。本研究结果表明LARC 患者外周血Treg 细胞绝对值放疗结束时较放疗前下降,放疗结束后1 月较放疗结束时升高,差异有统计学意义(P <0.05)。以上结果一定程度上提示放疗结束后的一段时间,LARC 患者T淋巴细胞、CD4+T 细胞、Treg 细胞有增长趋势,Treg细胞高浸润对患者预后的改善有一定价值。Treg 细胞产生的外泌体可调控肿瘤细胞以及肿瘤的微环境,引起肿瘤免疫逃逸,影响肿瘤的形成、侵袭和转移[14],假设将Treg 细胞来源的外泌体作为治疗的手段,放疗后增高的Treg 细胞数目可以增加免疫治疗的靶点,从而改善预后。
NK 细胞是一种大颗粒淋巴细胞,相对于T 细胞,其通过激活和抑制细胞表面受体的信号,诱发快速的抗肿瘤反应[15-16]。本研究中放疗结束后1 月时NK 细胞较放疗结束时明显升高,一定程度上表明直肠癌患者治疗后体内免疫系统被调动,为临床提供了新思路:临床上是否可应用治疗方式增强其体内免疫系统活性以达到改善抗肿瘤反应的作用。
PLR 是综合反映全身炎性反应和免疫系统功能的关键指标之一。有文献通过检测结直肠癌的肿瘤标志物以及炎性指标指出PLR 的升高提示直肠癌患者可能已经存在远处器官转移[17],且比值升高与患者生存期呈负相关[18]。本研究中PLR 放疗结束时较放疗前、放疗结束后1 月较放疗前升高,差异有统计学意义(P <0.05),放疗结束后1 月较放疗结束时下降,差异有统计学意义(P <0.05)。放疗结束时较放疗前比值升高,考虑可能为直肠癌患者同步放化疗期间,出现的骨髓抑制对PLR 的升高产生一定程度上的影响。放射治疗计划结束后由于放疗具有远隔效应,从而使放疗结束后比值成下降趋势,提示放疗影响了患者的免疫功能。本研究中对比LARC 患者治疗前的T 细胞亚群绝对值和PLR 比值,两者为负相关关系,说明在肿瘤微环境中,免疫和炎症系统有着相互制衡的关系。
表1 接受放射治疗的直肠癌患者放疗前后免疫指标变化()
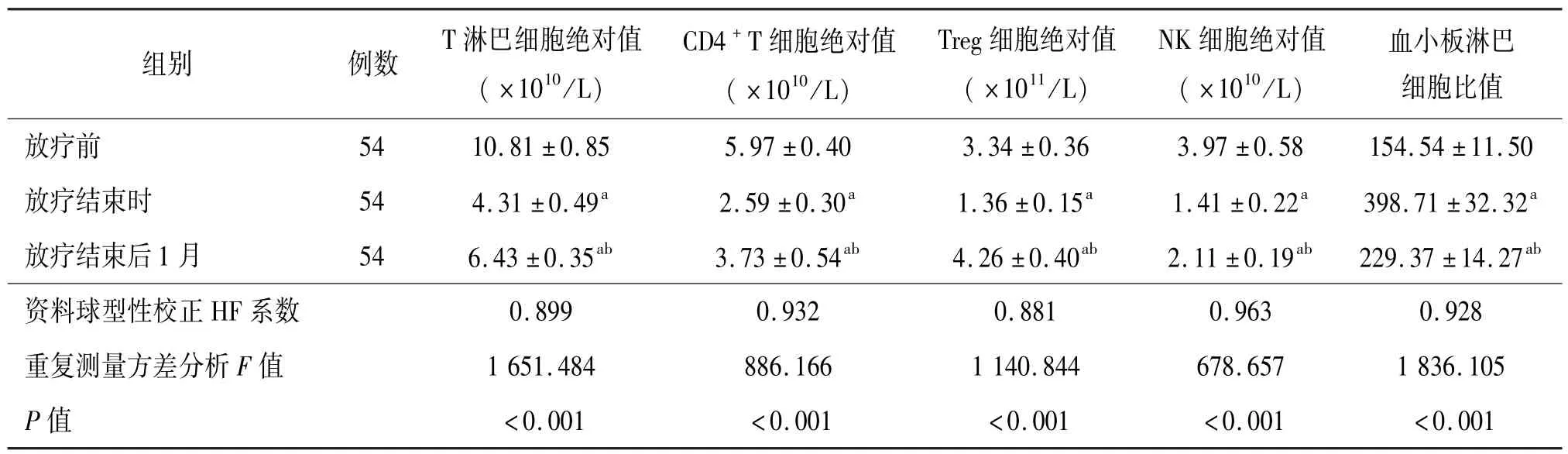
表1 接受放射治疗的直肠癌患者放疗前后免疫指标变化()
注:与放疗前比较,aP <0.05;与放疗结束时比较,bP <0.05
综上所述,本研究发现局部进展期直肠癌放疗前与放疗结束时、放疗前与放疗结束后1 月免疫细胞变化一定程度上提示放疗调动了细胞免疫,可以进一步改善患者的预后。PLR 围放疗期比值改变提示放疗可能通过改善患者的免疫功能来延长患者的生存期。T 细胞亚群检测联合炎症指标作为非侵入型手段,目的是筛选高获益人群,提高治疗的个体化以及精准化,预测疗效性预后。

