以大量腹水就诊的腹膜假黏液瘤一例
赵 琦 李 燕 陈岳祥 蒋彩凤
1 临床资料患者女,72岁,因“腹部胀痛6年余,腹围进行性增大3月余”于2018年10月17日入院。患者于2012年无明显诱因下间断出现全腹胀痛,排便、排气后可缓解,伴大便不成形。于外院就诊,查血常规、肝和肾功能、电解质均无异常;肿瘤标志物:血清CEA为40.44 μg/L(0~5 ng/mL)、CA19-9为46.11 U/mL(0~37 U/mL)、CA72-4为30.73 U/mL(0~6 U/mL);PET-CT检查示腹膜多发高代谢结节,少量腹水、盆腔积液。胃镜和结直肠镜检查均无明显异常。期间每年规律行腹部超声检查,间断行腹部CT检查,均发现少量腹水,未行进一步诊治。2018年7月起无诱因下出现腹围进行性增大,伴胸闷、双下肢水肿,活动后或平卧时胸闷加重,休息或坐起后胸闷略缓解。于外院住院治疗,查血清CEA>100 μg/L;腹部超声检查提示腹水;腹部CT检查提示大量腹水,盆腔、腹腔和腹膜后未见明显肿大淋巴结影;腹腔穿刺检查,抽出少量黄色胶冻样液体,腹水李凡他试验阳性。遂至上海长征医院就诊,为进一步诊治收入院。病程中患者体重增加5 kg,大便每天1次,不成形。患者曾行3次人工流产术(1976年),输卵管结扎术(1977年)。入院体格检查:腹部明显膨隆,中腹部触及一巨大包块,无触痛,边界不清,肝脾触诊不满意;中腹部叩诊浊音,移动性浊音阴性;双下肢轻度凹陷性水肿。肿瘤标志物:血清CEA为274 μg/L,CA125为40.91 U/mL,CA72-4为71.49 U/mL。腹部超声示:脐周上下腹腔内探及巨大蜂窝状混合回声团块,团块边缘不规则,内无气体;腹腔内探及游离液性暗区,液性暗区内可见絮状、点状回声。见图1。腹部CT检查:腹腔内见大量积液影,积液密度不均,腹腔左侧积液密度较右侧稍高,肠管受压右移,近后腹膜处见多个肿块影,呈囊实性,增强扫描呈不均匀强化;大网膜、肠系膜增厚。见图2。行腹腔穿刺,抽出少量(约5 mL)黄色胶冻样液体。于超声引导下行腹腔凝胶状团块穿刺活组织检查+腹腔积液置管引流术,引流管中抽出约100 mL胶冻样黏液。见图3。腹水脱落细胞学检查未发现肿瘤细胞,腹腔凝胶状团块穿刺物组织病理学检查:少量黏液,表面被覆少量柱状上皮,轻度异型,提示低级别腹膜假黏液瘤(pseudomucinous pefitonei,PMP)。免疫组织化学检查:CEA(+),Ki-67 10%阳性,绒毛蛋白(Villin,+),P53(-)。见图4。拟进一步行肿瘤细胞减灭术(cytoreduction surgery,CRS)联合腹腔内热灌注化学治疗(hyperthermic intraperitoneal chemotherapy,HIPEC),患者和家属均拒绝,予以出院随访。出院后患者未再于其他医院进一步就诊治疗,2个月后因病情恶化死亡。
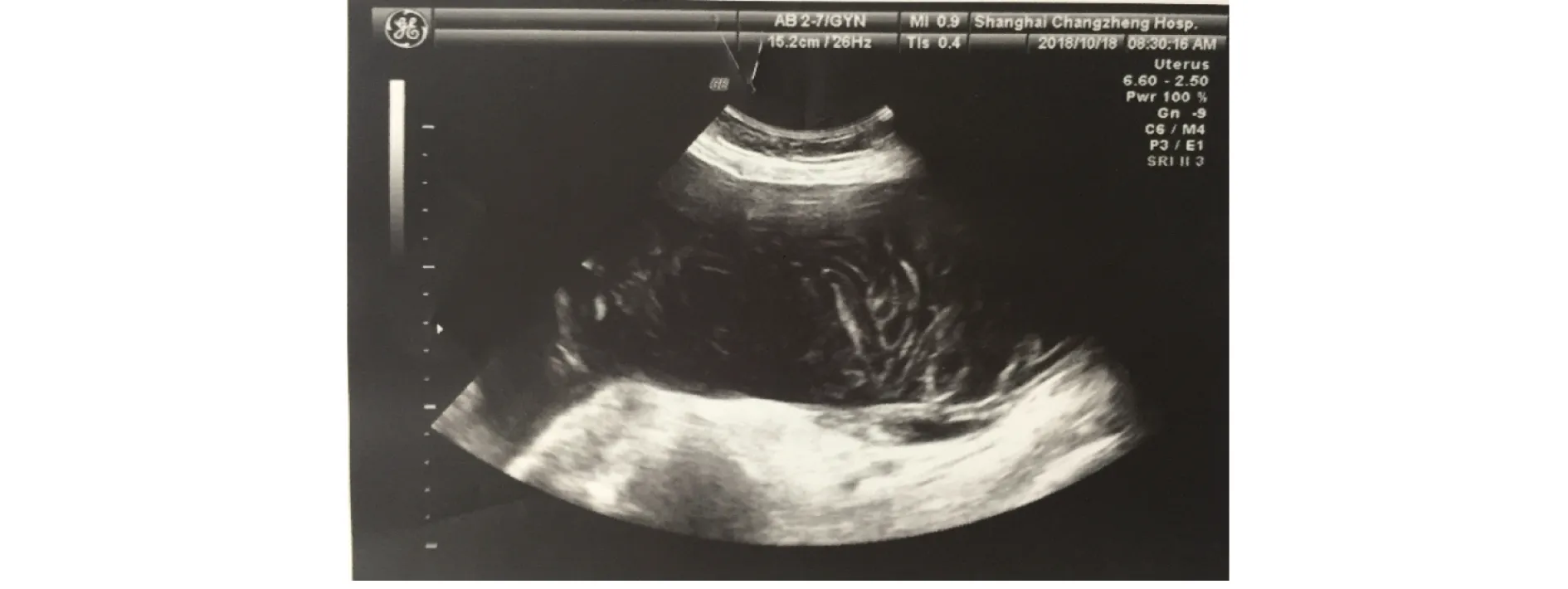
图1 腹部超声检查示腹腔内巨大蜂窝状混合回声
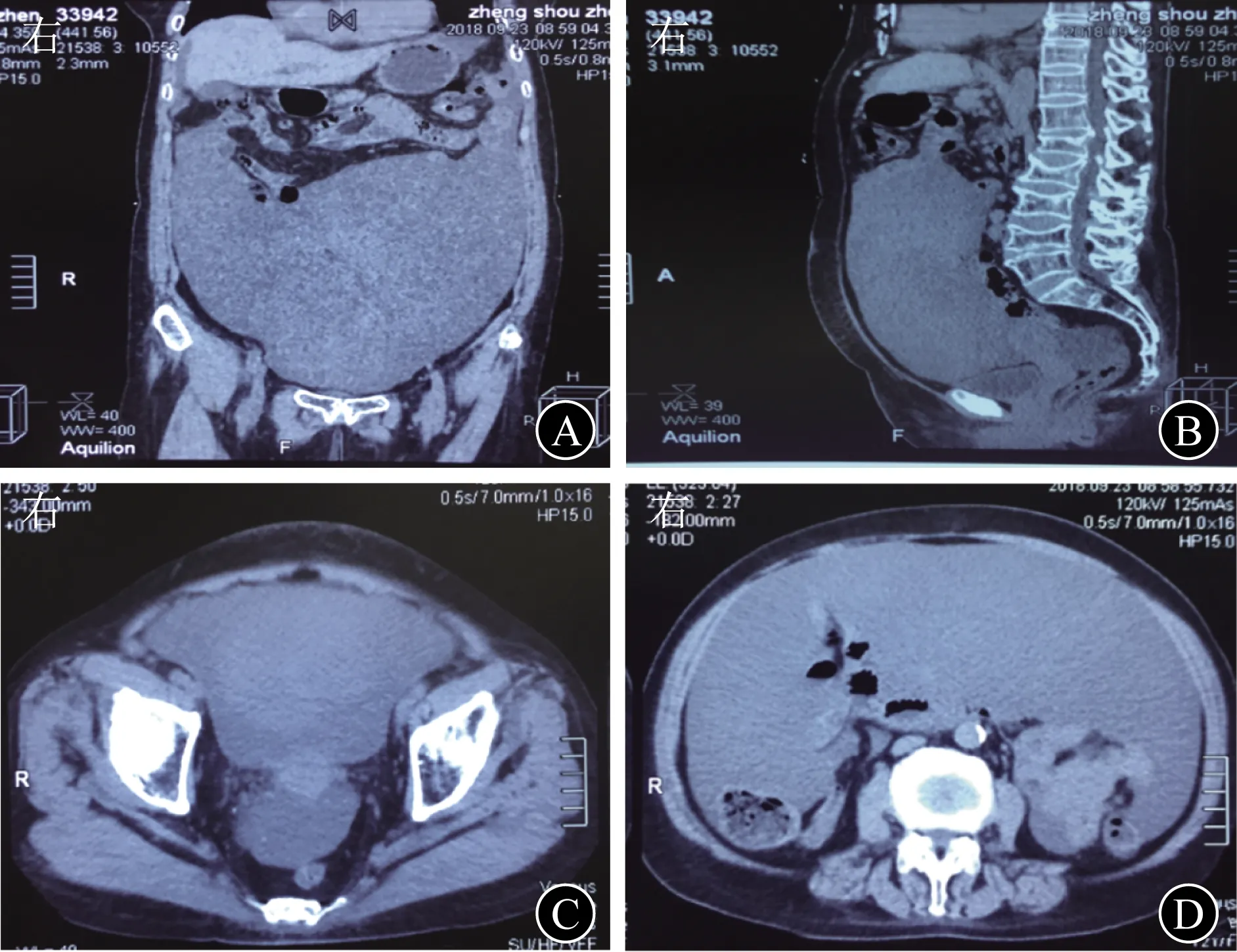
A 腹部CT冠状位示腹腔内大量积液,内密度不均,肠管受压 B 腹部CT矢状位示腹腔内大量积液影,积液密度不均,大网膜增厚 C 中腹部CT示腹腔大量积液,近后腹膜处见囊实性肿块 D 盆腔CT示盆腔大量积液,密度不均图2 腹部CT检查
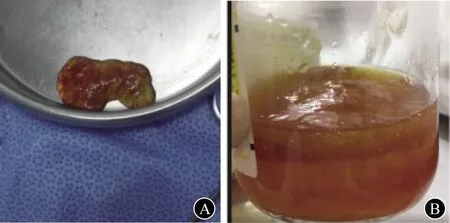
A 凝胶状团块 B 穿刺抽出黄色胶冻样黏液图3 腹腔穿刺活组织检查+腹腔积液置管引流术
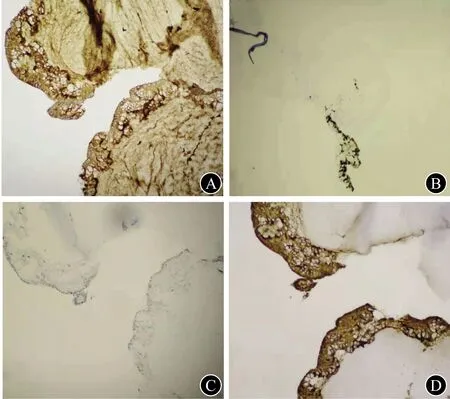
A CEA(+,×200) B Ki 67(10%阳性,×100) C P53(-,×40) D Villin(+,×200)图4 腹腔占位穿刺物免疫组织化学检查
2 讨 论PMP主要来源于卵巢或阑尾的黏液腺瘤囊腔破裂后,流动的黏液物质连同剥落下来的囊腔柱状上皮种植于腹膜、大网膜和腹腔脏器表面[1],导致腹腔内产生大量胶冻状黏液性腹水,黏液可刺激腹膜发生炎性反应引起粘连性肠梗阻。PMP 是一种低度恶性或交界性肿瘤,不浸润腹腔脏器本身[2]。
PMP在临床颇为少见,易被误诊、漏诊。PMP患者的病史较长,可达数年甚至数十年,其主要临床表现为腹围进行性增大、腹胀、腹痛、恶心、呕吐、食欲减退、消瘦等,亦可有反复发作的右下腹不适、腹部包块等症状或肠梗阻、腹膜炎等并发症症状。本例患者6年前以腹胀起病,腹部超声检查发现腹腔积液,但因其临床表现无特异性而漏诊。因此,对于有不明原因的顽固性腹水或腹部触及包块的患者,如腹腔穿刺不易抽出腹水或抽出的腹水呈胶冻样,需考虑该病。
近年来,腹部超声、CT等影像学检查对PMP的诊断起重要作用。CT检查的诊断阳性率最高,亦能很好地显示PMP病变的分布范围和形态特征,故可作为诊断PMP的首选方法。PET-CT对于治疗后疾病的复发具有良好的预测价值[3]。PMP的影像学表现具有一定特征性,可降低临床误诊率。PMP超声图像表现为腹腔内大量液性暗区,略呈灰白色,其内有粗大光点、光团和较多分隔,呈蜂窝状,在肝脏周围形成“贝壳征”[4-5]。CT图像表现为腹腔和盆腔内有黏液性腹水、分房状黏液团块和内脏表面扇贝形压迹等[6];黏液团块的密度较均匀,CT值略高于水,增强后边缘略有强化;肠系膜或大网膜增厚,密度增高或伴有网膜饼、结节等,累及范围广泛,甚至与脏器粘成一块,使肠管不同程度聚拢,无漂浮感,形成“冰冻腹”;肿瘤组织将肠曲固定在中央,如同戴上斗篷[7-8]。本例患者腹部超声检查显示,腹腔内有大量液性暗区和巨大蜂窝状混合回声团块,液性暗区内可见粗大光点;腹部CT检查显示,腹腔内有大量密度不均积液影,肠管受压右移,近后腹膜处见多个肿块影,大网膜、肠系膜增厚。上述检查结果与PMP的典型影像学表现类似,为进一步诊断,行腹腔穿刺,抽出黄色胶冻样液体后考虑诊断为PMP;遂于超声引导下对腹腔内凝胶状团块进行穿刺活组织检查,病理诊断为低级别PMP。
PMP的早期临床表现无特异性,影像学检查虽有特征性表现,但仍无法明确诊断。本例患者6年来多次行腹部超声和CT检查均未明确诊断,可能与疾病进展慢,腹水量少而影像学表现不典型,以及临床医师对PMP诊治经验不足有关。PMP既往多依靠腹腔镜或开腹探查获得病理诊断,随着影像介入技术的发展,对于腹腔内有黏液团块的PMP患者行腹部超声或CT引导下穿刺活组织检查的操作简单,是术前获得病理诊断的较好方法。
PMP的治疗目标是通过以手术为主的综合治疗改善并控制症状,减少复发,改善患者生活质量。目前公认的有效治疗方法为CRS联合HIPEC[9-11]。遗憾的是,本例患者因经济原因拒绝进一步治疗而出院,最终因疾病进展死亡。
综上所述,PMP较少见,临床表现无特异性,通常起病缓慢,易被误诊、漏诊。临床上对于不明原因的腹腔积液,若腹水呈胶冻状则需高度怀疑PMP,可选择囊实性部位穿刺行活组织检查,以及腹腔镜或开腹探查后行病理学检查明确诊断。

